甲型H1N1流感病毒RNA检测方法的建立及临床应用
2021-07-29曹红梅
唐 钧,曹红梅
(上海市金山区亭林医院检验科,上海 201505)
H1N1是甲型流感病毒的一种亚型,为RNA病毒,属正黏液病毒科,其“H”指的是血球凝集素(hemagglutinin,H),而“N”指的是神经氨酸酶(neuraminidase,N),2种都是糖蛋白,分布在病毒表面[1]。甲型H1N1流感病毒的宿主主要是犬科动物、鸟类和一些哺乳动物[2]。2009年3月,墨西哥首次发现了人感染甲型H1N1流感病毒的病例[3],然后传播到全球。多项研究发现,甲型H1N1流感病毒是一种变异后的新型甲型流感病毒,其基因组内存在四源重配,是由人流感、猪流感和禽流感病毒基因混合而成的,该病毒的PBl基因源自人流感H3N2病毒,HA、NA、NP、NS和M基因源自猪流感H1N1病毒,PB2和PA基因源自禽流感H1N1病毒[4-5]。甲型H1N1流感病毒可通过直接或间接接触、呼吸道等途径在人群中传播,临床症状与普通流行性感冒十分相似,仅凭症状无法确诊,且该病发展迅速,若不能及时治疗,会出现肺炎、呼吸衰竭、多器官功能损伤等并发症,死亡率极高[6-7]。以往主要通过血清诊断法、特异性抗体检测法、细胞培养或鸡胚培养分离病毒检测甲型H1N1流感病毒感染,但这些方法较复杂且耗时较长,疫情暴发初期无法获得毒株抗体,因此无法满足临床诊断需求[8]。所以,建立简便、快捷的病毒检测方法十分重要。本研究通过对甲型H1N1流感病毒HA基因和NA基因序列进行分析,设计引物和TaqMan探针,建立检测甲型H1N1流感病毒遗传物质的实时荧光定量逆转录聚合酶链反应(real-time fluorescence quantitative reverse transcription-polymerase chain reaction,RT-PCR)方法,以期为防控甲型H1N1流感提供帮助。
1 材料和方法
1.1 试剂和仪器
甲型H1N1流感病毒、H1~H16流感病毒、季节性流感病毒、猪流感病毒由生工生物工程(上海)股份有限公司惠赠,TRIzol试剂购自生工生物工程(上海)股份有限公司,甲型H1N1流感病毒(2009)RNA检测试剂盒购自中山大学达安基因股份有限公司,RNeasy Mini Kit核酸提取盒购自广州健仑生物科技有限公司,One Step PrimeScript RT-PCR试剂盒和酶、dNTP等试剂购自上海酷乐生物科技有限公司。ABI 7500全自动实时荧光定量PCR仪购自美国ABI公司,T7体外转录试剂盒购自上海泽叶生物科技有限公司,不同稀释度的甲型H1N1流感病毒、季节性流感病毒、禽流感病毒等流感病毒盲样由中国疾病预防控制中心(Chinese Center for Disease Control and Prevention,CDC)提供。
1.2 检测方法建立
1.2.1 引物和探针的合成 采用DNASTAR生物软件进行同源性分析,比较我国分离的甲型H1N1流感病毒HA基因和NA基因的核苷酸序列和GenBank数据库中存在的核苷酸序列(HA,GenBank:MT186158.1;NA,GenBank:MT138529.1),选择高度保守且特异的核苷酸区域设计特异性扩增引物和TaqMan探针,引物由生工生物工程(上海)股份有限公司合成,探针由大连宝生物工程有限公司合成。HA基因上游引物为5'-CCCTCTACCAGAATAATCATAC-3′,下游引物为5'-ATGAATTATTACTGGACAC-3',探针为5'-(HEX)AGTCAGAGAACAAGCAGGCAGA(ECLIPS)-3'。NA基因上游引物为5'-CCCATATCGAACATTGATG-3',下游引物为5'-TACAATGGCATAATAACAGAC-3',探针为5'-(HEX)CTGTCCTATTGGTGAGGTTCCTTCT(ECLIPS)-3'。利用BLAST软件分析探针序列的特异性。
1.2.2 病毒RNA的提取 采用TRIzol试剂提取季节性流感病毒、猪流感病毒RNA,置于-20 ℃冰箱保存备用。严格按照试剂盒说明书进行操作。将提取到的RNA作为RT-PCR模板,用于逆转录试验。
1.2.3 反应体系的建立 反应体系为25 μL,常规配置,包括RNA 2.0 μL,One Step RT-PCR 缓冲液12.5 μL(1×),Ex Taq HS 0.5 μL(1×),酶混合液0.5 μL(1×),PrimeScript RT enzyme MixⅡ 2 μL(1×),上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,TaqMan探针0.5 μL(10 μmol/L),RNase Free dH2O 5 μL。反应条件:50 ℃ 15 min;95 ℃ 15 s;95 ℃ 30 s,55 ℃ 45 s,共40个循环,退火结束后读取5-六氯荧光素氨基磷酸酯(5-hexachlorofluorescein phosphoramidite,HEX)实时荧光信号。根据收集的实时荧光曲线和扩增循环阈值(cycle threshold,Ct)判定结果。
1.2.4 RNA标准品制备 采用TRIzol试剂提取甲型H1N1流感病毒RNA,用HA探针及引物扩增后,用带T7启动子的引物进行二次扩增,用酚-氯仿溶液(V∶V=25∶24)纯化。纯化产物在体外按T7体外转录试剂盒说明书进行转录,采用SPT53-ZF7-B紫外分析仪(南京威美特科学仪器有限公司)测定浓度后分装,于-20 ℃冰箱保存备用。
1.2.5 反应体系优化 对反应体系中的不同引物与探针浓度组合、反应体积、扩增反应参数等条件进行优化,以达到最优组合。利用优化后的反应体系和反应条件建立实时荧光定量RT-PCR方法,然后检测甲型H1N1流感病毒、H1~H16流感病毒、季节性流感病毒、猪流感病毒的RNA。
1.2.6 敏感性试验及定量分析 用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水将RNA标准品进行10倍倍比稀释,利用建立的实时荧光定量RT-PCR方法对不同浓度的RNA标准品进行敏感性试验,RNA标准品浓度依次为107、106、105、104、103拷贝/μL,同时采用通过标准品扩增获得的标准曲线对样本进行定量分析。
1.3 重复性试验
以DEPC水为阴性对照,对106拷贝/μL RNA标准品进行重复性试验,批间检测重复3次,批内检测重复5次,根据Ct值结果计算批间、批内变异系数(coefficient of variation,CV)。
1.4 样本检测
收集2019年5月—2020年10月上海交通大学医学院附属瑞金医院传染病科流行性感冒患者的鼻咽拭子样本21份。采用柱提法提取RNA,取2 μL RNA,采用实时荧光定量RT-PCR检测,同时采用鸡胚培养法分离甲型 H1N1流感病毒。比较2种方法的符合率。
2 结果
2.1 特异性试验
同源性分析结果显示,设计的HA探针序列与甲型H1N1流感病毒H1基因序列的同源性达100%。
采用基于HA和NA探针及引物建立的实时荧光定量RT-PCR方法对构建的阳性质粒和甲型H1N1流感病毒、H1~H16流感病毒、季节性流感病毒、猪流感病毒的RNA进行检测。结果显示,HA探针的特异性好,甲型H1N1流感病毒核酸检测结果为阳性时,其他病毒检测结果均为阴性;NA探针对季节性流感病毒、猪流感病毒的检测结果为弱阳性,因此选用HA探针进行后续实验。见图1。
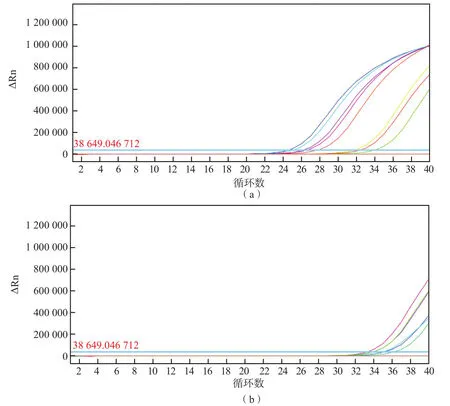
图1 基于HA和NA探针及引物的扩增动力学曲线
2.2 敏感性试验
实时荧光定量RT-PCR检测RNA标准品的敏感性为103拷贝/μL RNA分子,标准曲线r2=0.998。见图 2。

图2 实时荧光定量RT-PCR检测RNA标准品的敏感性试验结果及标准曲线
2.3 重复性试验
阳性RNA标准品Ct值的批内、批间CV均<10%,阴性标准品(DEPC水)重复检测的Ct值均<0,重复性良好。见图3。

图3 RNA阳性标准品及阴性标准品批内重复检测的扩增动力学曲线
2.4 样本检测结果
21份鼻咽拭子样本中有2份检测结果为阳性,Ct值分别为20.41、24.93;其他样本均为阴性,与鸡胚培养法的符合率为100%。
3 讨论
甲型H1N1流感是一种由甲型H1N1流感病毒引起的急性呼吸道传染病,可通过飞沫传染、接触传染在人群中传播[9]。2009年3月,甲型H1N1流感病毒在墨西哥被发现后,世界卫生组织(World Health Organization,WHO)把全球甲型H1N1流感大流行警告级别提高至5级;同时,我国也将其纳入《中华人民共和国传染病防治法》[10]规定的乙类传染病和《中华人民共和国国境卫生检疫法》[11]规定的检疫传染病管理,并对其采取甲类传染病的预防、控制措施。2009年6月11日,WHO将全球甲型H1N1流感大流行警告级别提高至6级,即警戒级别的最高级状态[12]。2010年8月10日,WHO宣布甲型H1N1流感大流行已经结束,甲型H1N1流感病毒的传播基本接近尾声,正步入后流感大流行阶段;但该阶段并不意味着甲型H1N1流感病毒已彻底消失;甲型H1N1流感病毒在未来几年内会继续存在,由于此时该病毒的动向具有非常高的不可预测性,因此仍需对其保持警惕[13]。临床上通常使用病毒培养法对流感病毒感染进行诊断,虽然有较高的诊断准确率,但受实验室条件和人员条件的限制,且耗时久,无法满足疫情暴发时的诊断需求[14]。因此,对病毒核酸进行检测,有助于疾病的早期诊断。
实时荧光定量RT-PCR能用少量的RNA识别出在某个特定时间细胞组织内的特定基因,特异性、敏感性、自动化程度均较高,操作简单、快捷,防污染效果较好,是检测甲型H1N1流感病毒RNA的有效方法[12,15-16]。
本研究根据甲型H1N1流感病毒HA基因和NA基因的核苷酸序列和GenBank数据库中的核苷酸序列设计引物和TaqMan探针,结果显示,HA探针仅与甲型 H1N1流感病毒RNA反应,与H1~H16流感病毒、季节性流感病毒、猪流感病毒的RNA无交叉反应,特异性好;而NA探针与季节性流感病毒、猪流感病毒呈弱阳性反应,特异性较差;因此,本研究采用HA基因的引物和探针建立反应体系并进一步优化,根据优化后的反应体系和反应条件建立检测甲型H1N1流感病毒的实时荧光定量RT-PCR方法。该方法的敏感性为103拷贝/μL RNA分子,阳性RNA标准品的Ct值批内、批间CV均<10%,阴性标准品(DEPC水)重复检测的Ct值均<0,重复性良好,与鸡胚培养法的符合率为100%。
综上所述,本研究建立了检测甲型H1N1流感病毒RNA的实时荧光定量RT-PCR方法。该方法操作简便、耗时较短、特异性较强、敏感性较高,可用于临床检测。