致密细斑点型抗核抗体在系统性自身免疫性风湿性疾病诊断中的意义
2021-07-29杨可可吴俊渊曹兴建
杨可可,吴俊渊,曹兴建
(南通市第一人民医院检验科,南通 江苏 226001)
近年来,自身免疫性疾病的发病率呈明显上升趋势,且当合并其他疾病时,患者的死亡率较高[1]。正常情况下,接触自身抗原的免疫细胞克隆会被清除,这种情况被称为免疫耐受。当机体对这些自身反应的免疫细胞克隆控制失败时,就会发生自身免疫性疾病[2]。目前,临床常见的自身免疫性疾病主要为系统性自身免疫性风湿性疾病(systemic autoimmune rheumatic disease,SARD),包括类风湿性关节炎、系统性硬化症、系统性红斑狼疮、抗磷脂综合征、干燥综合征、皮肌炎[3]。自身免疫性疾病实验室诊断的主要依据为自身抗体检测,包括自身抗体谱筛查和抗核抗体核型判断。特定的抗核抗体类型和某些疾病的发生具有一定的相关性[4]。抗核抗体常见的核型主要为核颗粒型、核均质型、胞浆颗粒型、着丝点型、核点型、核膜型等。致密细斑点型近几年已被列为抗核抗体检测中必报的核型之一[5]。致密细斑点型核型特征为细胞分裂中期浓缩染色质和分裂间期细胞核上分布着细小、均匀、一致的斑点颗粒[5]。本研究拟探讨致密细斑点型抗核抗体的检测方法及其对SARD的诊断价值。
1 材料和方法
1.1 研究对象
选取2017年10月—2018年12月至南通市第一人民医院门诊就诊或住院,疑似或确诊为SARD的患者1 683例,其中男556例、女1 127例,年龄16~73岁。本研究中的SARD特指弥漫性结缔组织病,包括系统性红斑狼疮606例、硬皮病67例、皮肌炎68例、类风湿性关节炎252例、干燥综合征690例,累及多系统、多器官(皮肤、关节、肌肉等)。
1.2 方法
1.2.1 样本采集 采集所有对象的血清或乙二胺四乙酸 、肝素抗凝血浆,避免使用严重脂血、黄疸、溶血及被污染的样本。
1.2.2 抗核抗体检测 抗核抗体(IgG)检测试剂盒[间接免疫荧光法(indirect immunofluorescence,IIF)]购自德国欧蒙医学实验诊断有限公司。样本的稀释比例分别为1∶100、1∶320、1∶1 000,其他步骤严格按试剂盒说明书操作。1∶100稀释:将5 μL血清加入495 μL PBST缓冲液(将10.2 g磷酸盐溶于1 L蒸馏水中,再加入2 mL Tween-20配制而成)中。1∶320稀释:将100 μL 1∶100稀释的血清加入220 μL PBST缓冲液中。1∶1 000稀释:将11.1 μL 1∶100稀释血清加入100 μL PBST缓冲液中。镜检:在20倍镜下判断荧光滴度(1∶100、1∶320、1∶1 000),在40倍镜下判断抗核抗体核型。
1.2.3 自身抗体检测 采用自身抗体谱(IgG)检测试剂盒(免疫印迹法,德国欧蒙公司)检测抗核糖核蛋白(nuclear ribonucleoprotein,nRNP)抗体、抗史密斯(Smith,Sm)抗体、抗天然干燥综合症A(Sjögren syndrome A,SS-A)抗体、抗干燥综合症B(Sjögren syndrome B,SS-B)抗体、抗Ro52抗体、抗硬皮病70(scleroderma-70,SCL-70)抗体、抗皮肌炎-系统性硬化症(polymyositis-sclerosis,PM-Scl)抗体、抗组氨酰转运RNA合成酶(aminoacyl tRNA synthase,Jo-1)抗体 、抗着丝点蛋白B(centromere protein B,CENP-B)抗体、抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、抗双链DNA(double-stranded DNA antibody,dsDNA)抗体、抗核小体抗体(antinucleosome antibody,AnuA)、抗组蛋白抗体(anti-histone antibody,AHA)、抗核糖体P蛋白抗体(anti-ribosomal P protein antibody,ARPA)、抗线粒体M2抗体(anti-mitochondrial antibody subtype M2,AMA-M2),严格按试剂盒说明书操作。结果判读:将膜条用KEWB83014型扫描仪(日本Canon公司)扫描,扫描结果分为0、1、2、3、4、5、6共7个等级,对应的血清IgG抗体水平分别为0~0.34、0.35~0.69、0.70~3.49、3.50~17.49、17.50~49.99、50.00~99.99和≥100.00 kU/L,以IgG抗体≥3.5 kU/L为阳性。
1.3 统计学方法
采用SPSS 13.0软件进行统计分析。计数资料以率表示,组间比较采用χ2检验。致密细斑点型抗核抗体滴度与SARD的相关性分析采用秩相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 IIF检测抗核抗体与免疫印迹法检测自身抗体的阳性率比较
分别采用IIF和免疫印迹法检测1 683例患者样本。IIF检测抗核抗体的阳性率与免疫印迹法检测自身抗体的阳性率比较,差异无统计学意义(P>0.05)。见表1。
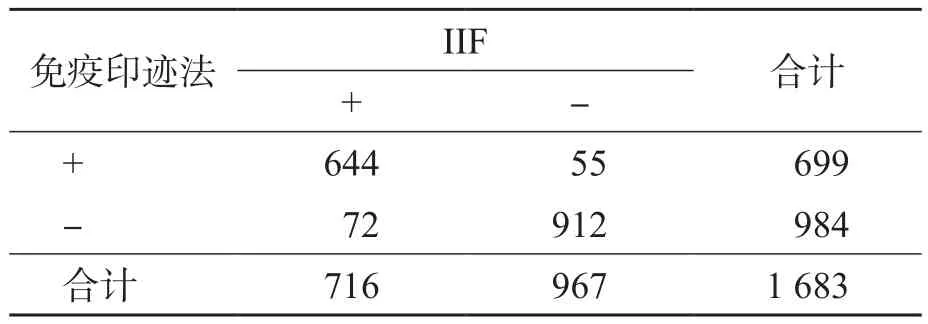
表1 IIF检测抗核抗体与免疫印迹法检测自身抗体的比较
2.2 72例IIF阳性、免疫印迹法阴性样本的核型分布
在7 2例I I F阳性、免疫印迹法阴性样本中,核颗粒型所占比例最高,为44.44%(32/72),然后依次为致密细斑点型[40.28%(29/72)]、均质型[12.50%(9/72)]、核仁型[2.78%(2/72)]。4种核型所占比例差异有统计学意义(χ2=36.333,P<0.001)。两两比较结果显示,致密细斑点型所占比例与核颗粒型比较,差异无统计学意义(χ2=0.148,P=0.701);与均质型、核仁型比较,差异均有统计学意义(χ2=10.526,P=0.001;χ2=23.516,P<0.001)。
2.3 致密细斑点型抗核抗体滴度与SARD的相关性分析
29例致密细斑点型抗核抗体中,荧光滴度为1∶100、1∶320、≥1∶1 000的分别有8例(27.59%)、17例(58.62%)、4例(13.79%),每个滴度对应的SARD确诊病例数分别为1例、5例、2例。秩相关分析结果显示,荧光滴度与SARD无相关性(r=-0.300,P=0.667)。
2.4 IIF和免疫印迹法均阳性样本的核型分布
IIF和免疫印迹法均阳性的644例样本的核型分别为核颗粒型、核均质型、胞浆颗粒型、着丝点型、核点型、核膜型、核仁型、溶酶体型、高尔基体型、胞浆纤维型和PCNA型,未见致密细斑点型。核颗粒型所占比例最高(38.98%),其次是胞浆颗粒型(22.05%)。除了核点型和核膜型,每种核型都对应着相应的自身抗体。抗Ro52抗体在多种核型中出现,未表现出特异性。见表2。

表2 IIF和免疫印迹法均阳性的644例样本的核型分布
3 讨论
本研究结果显示,IIF和免疫印迹法检测自身抗体结果的差异无统计学意义(P>0.05)。对IIF和免疫印迹法检测结果不一致的样本的核型进行分析,在IIF阳性而免疫印迹法阴性的结果中,致密细斑点型值得关注。
美国风湿病学协会将IIF作为抗核抗体筛查的“金标准”[6]。自从IIF的生物载片采用人喉癌细胞为基质后,其方法学的灵敏度大大提高,但降低了特异性,导致健康人和非自身免疫性疾病患者的抗核抗体阳性率升高[7]。因此,在临床工作中,除了用IIF筛查抗核抗体外,还应采用特异性较强的免疫印迹法联合检测自身抗体。本研究结果显示,IIF和免疫印迹法的阳性率差异无统计学意义(P>0.05);对于IIF阴性、免疫印迹法阳性的样本,免疫印迹法结果大多为抗Ro52抗体可疑、弱阳性或阳性。有研究结果显示,健康人群抗Ro52抗体也会出现阳性,因此仅抗Ro52抗体阳性与SARD关系不大,只有伴随抗SS-A抗体出现时有一定提示意义[8]。本研究结果还显示,抗Ro52抗体可在多种核型中出现,缺乏特异性;对于IIF阳性、免疫印迹法阴性的样本,核颗粒型所占比例最高,其次是致密细斑点型,核均质型和核仁型所占比例相对较低。核颗粒型是IIF抗核抗体检测中最常见的核型,且低滴度的核颗粒型最常见[4]。本研究,32例核颗粒核型中有4例荧光滴度≥1∶1 000。这4例高滴度的核颗粒型又被称为Ku颗粒型[5]。Ku颗粒型的核型特征为分裂中期染色质为阴性,分裂期细胞的细胞核核质均匀分布着分散的细颗粒,核仁阴性或阳性。与Ku颗粒型相关的疾病包括干燥综合征、系统性红斑狼疮、皮肌炎等弥漫性结缔组织病[5]。由于本研究使用的免疫印迹法膜条中未包被Ku抗原,所以免疫印迹法检测结果为阴性。鉴于Ku颗粒型的阳性率较低,因此在IIF阳性、免疫印迹法阴性的样本中,致密细斑点型最有价值。随着致密细斑点型抗核抗体滴度的升高,SARD确诊例数相应增多,但秩相关分析结果显示致密细斑点型抗核抗体的荧光滴度与SARD无相关性(r=-0.300,P=0.667)。由于本研究中致密细斑点型抗核抗体的阳性例数较少,因此其滴度与SARD的关系还有待进一步研究。
与致密细斑点型密切相关的自身抗体为转录激活因子p75,即晶状体上皮细胞源性生长因子,相对分子质量为75 000[9]。在研究的初期,研究者确认这种自身抗体的相对分子质量为7 0 0 0 0,因此致密细斑点型抗核抗体的靶抗原被称为致密细斑点-70(dense fine speckle-70,DFS-70)。有≤10%的健康者会出现抗DFS-70抗体阳性,与自身免疫性疾病关系不大;但在纤维肌痛患者中,有关节痛的患者的抗DFS-70抗体水平高于其他患者(P=0.024)[10]。这说明抗DFS-70抗体可能与一小部分自身免疫性疾病有关。与抗DFS-70抗体一样,致密细斑点型抗核抗体在自身免疫性疾病中也较少出现。有研究结果显示,经过4年的随访,40例致密细斑点型抗核抗体阳性的健康人均未发生自身免疫性疾病[11]。但在上述研究致密细斑点型抗核抗体和自身免疫性疾病相关性的报道中均未考虑抗体滴度。DELLAVANCE等[4]认为低滴度的致密细斑点型抗核抗体一般出现在健康人群中,中、高滴度的致密细斑点型抗核抗体阳性一般伴随着抗DFS-70抗体阳性;在致密细斑点型阳性的患者中,有86%的患者致密细斑点型的荧光滴度≥1∶640,免疫印迹法检测结果显示有98%的患者血清中存在抗DFS-70抗体[4];在IIF和免疫印迹法均阳性的患者中,只有39%的患者患有自身免疫性疾病,其中自身免疫性甲状腺炎占43.3%、系统性红斑狼疮占16.7%、多发性硬化症占0.03%,与本研究结果类似。根据SARD的诊断指南,SARD患者常表现出中、高滴度的抗核抗体阳性,且有对应的自身抗体阳性[12]。本研究结果显示,644例IIF和免疫印迹法均阳性的样本中包括SARD患者的样本,但这644例样本均未检出致密细斑点型抗核抗体。
综上所述,鉴于致密细斑点型抗核抗体与SARD无相关性,且644例2种方法均阳性的样本中均未检出致密细斑点型抗核抗体,因此致密细斑点型抗核抗体阳性可以用于排除SARD,有助于提高抗核抗体筛查对SARD诊断的特异性[13]。但每一种SARD疾病又有特征性的临床表现和特异性自身抗体。在实际工作中,致密细斑点型很容易与普通核颗粒型混淆[13],其判读需要丰富的阅片经验。另外,致密细斑点型抗核抗体阳性在日常工作中也较少见,本研究仅有29例,样本量较小。此外,本研究采用IIF筛查抗核抗体,荧光强度判断使用的是三系判断法,即1∶100、1∶320、1∶1 000。与三系判断法比较,五系判断法(1∶80、1∶160、1∶320、1∶640、1∶1 280)更详细、更精确,因此本研究结果还有待于进一步确认。