核磁共振波谱法与传统生化检测方法血脂检测结果相关性分析
2021-07-29彭琰君韩雪晶唐红霞陈俊萌贾克刚
彭琰君,韩雪晶,唐红霞,陈俊萌,贾克刚
(1.杭州市余杭区第二人民医院检验科,浙江 杭州 211121;2.天津医科大学心血管病临床学院 泰达国际心血管病医院检验科,天津 300457;3.河北北方学院医学检验学院,河北 张家口 075000)
目前,临床实验一般采用全自动生化分析仪检测血脂水平。近年来,随着技术的不断发展,一些新型的检测仪器,如核磁共振仪等逐步应用于临床,为同时测定包括血脂在内的一系列生物分子和代谢产物提供了有力的技术支持。核磁共振仪的原理是通过核磁共振波谱法(nuclear magnetic resonance spectroscopy,NMR)分析不同脂质甲基的特定振幅,从而得出血脂谱水平。NMR将低密度脂蛋白(lowdensity lipoprotein,LDL)按粒径分为6个亚组分(LDL1~LDL6),其粒径分别为22.2~23.0、21.3~22.1、20.6~21.2、19.8~20.5、19.1~19.7、18.3~19.0 nm,密度分别为1.019 ~1.031、1.032~1.034、1.035~1.037、1.038~1.040、1.041~1.044、1.045~1.060 g/mL[1]。NMR可测定6个LDL亚组分的胆固醇水平(以LDL1-C~LDL6-C表示)和颗粒浓度(以LDL1-P~LDL6-P表示)[2]。目前,临床一般通过采用酶法检测小而密低密度脂蛋白胆固醇(small and dense low-density lipoprotein cholesterol,sd-LDL-C)水平来反映密度为1.044~1.063 g/m3、粒径为22.0~25.5 nm的小而密低密度脂蛋白(small and dense low-density lipoprotein,sd-LDL)水平[3]。关于酶法与NMR检测sd-LDL-C及血脂4项[总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)]的相关性尚未见报道。为此,本研究拟探讨NMR与生化检测方法(生化分析仪)检测sd-LDL-C及血脂4项的相关性,并对LDL-C与低密度脂蛋白颗粒(low-density lipoprotein particle,LDL-P)不一致患者的sd-LDL-C水平进行分析。
1 材料和方法
1.1 研究对象
选择2019年8—9月泰达国际心血管病医院门诊患者54例,其中男28例、女26例,年龄(59.1±10.6)岁。54例患者中冠状动脉粥样硬化性心脏病34例,其中合并糖尿病11例、合并高血压30例,有抽烟史13例,有饮酒史4例。
1.2 方法
分别用肝素抗凝管和乙二胺四乙酸二钾(ethylenediaminetetraacetic acid-K2,EDTA-K2)抗凝管采集所有研究对象静脉血7 mL,EDTA-K2抗凝血样本(2 mL)1 700×g离心13 min,4 h内分离血浆,取400 μL,-80 ℃冻存,统一采用AvanceⅢ IVDr核磁共振波谱仪(美国Bruker公司)及配套数据处理系统检测LDL的颗粒大小和浓度。肝素抗凝血样本(5 mL)2 821×g离心5 min,分离血清,采用传统生化检测方法检测sd-LDL-C、TC、TG、HDL-C和LDL-C水平,sd-LDL-C试剂盒(酶法)购自北京九强公司,LDL-C试剂盒(选择保护法)、HDL-C试剂盒(抗体阻碍法)、TC试剂盒(酶法)和TG试剂盒(酶法)均购自日本和光公司,检测仪器为LABOSPECT 008AS全自动生化分析仪(日本日立公司)。样本采集过程严格参照我国卫生行业标准WS/T 225—2016中的规定。患者LDL-C水平尽可能分散并覆盖高、中、低浓度范围,高值、中值、低值分别占20%、20%、40%。
1.3 统计学方法
采用SPSS 22.0和Excel 2007软件进行统计分析。呈正态分布的数据以±s表示,组间比较采用配对样本t检验。呈非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,组间比较采用配对样本秩和检验。采用Pearson相关分析评估2种方法的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 传统生化检测方法与NMR血脂检测结果的相关性
传统生化检测方法与NMR检测sd-LDL-C、LDL-C、HDL-C、TG、TC的回归方程分别为:Y=0.457X+5.893(r2=0.640,P=0.000),Y=0.719X+21.656(r2=0.827,P=0.000),Y=0.800X+13.552(r2=0.875,P=0.000),Y=0.947X-6.217(r2=0.996,P=0.000),Y=0.961X+20.726(r2=0.928,P=0.000)。
2.2 sd-LDL-C与LDL亚组分的相关性
传统生化检测方法检测sd-LDL-C水平与NMR检测LDL5-C、LDL4-C+LDL5-C+LDL6-C、LDL5-C+LDL6-C、LDL6-C水平呈正相关(r值分别为0.326、0.341、0.352、0.800,P<0.05),与NMR检测LDL1-C、LDL2-C、LDL3-C、LDL4-C水平无相关性(r值分别为0.199、0.093、0.100、0.209,P>0.05)。
2.3 传统生化检测方法与NMR血脂检测结果的比较
NMR检测sd-LDL-C、LDL-C、HDL-C、TC水平与传统生化检测方法比较,差异均有统计学意义(P=0.000),而TG水平2种检测方法之间差异无统计学意义(P>0.05)。见表1。
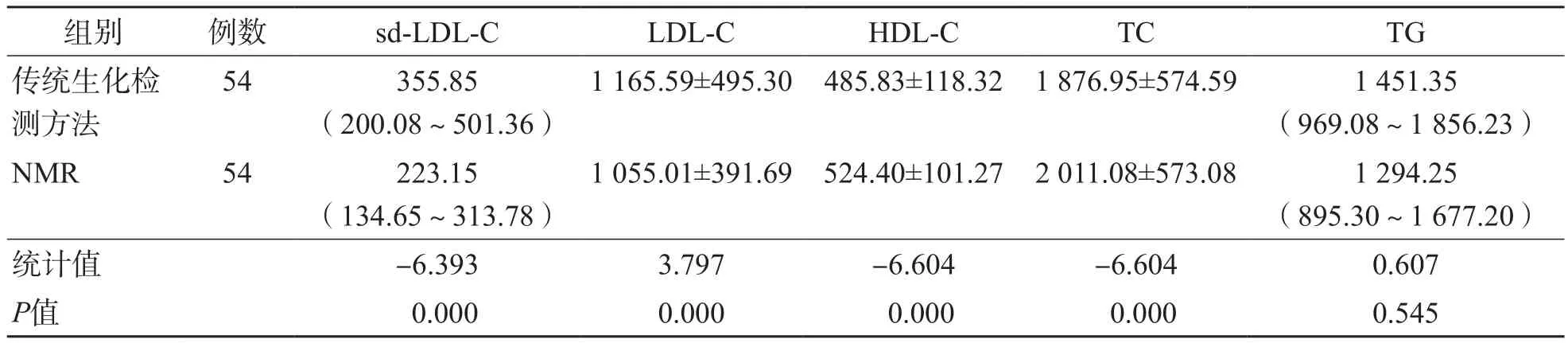
表1 传统生化检测方法与NMR血脂检测结果的比较 mg/L
2.4 LDL-C与LDL-P不一致患者sd-LDL-C水平的比较
根据NMR的LDL-C和LDL-P检测结果分别对54例样本进行排序,并计算其百分位数。将LDL-C百分位数≥LDL-P百分位数的患者列为A组,LDL-C百分位数 表2 LDL-C与LDL-P不一致患者sd-LDL-C水平的比较mg/L 冠心病(coronary heart disease,CHD)的发病与性别、年龄、血压、血糖等因素有关。在诸多危险因素中,胆固醇是CHD的核心致病性危险因素,因此降低胆固醇是CHD的首要治疗靶标。由于LDL的异质性,检测LDL-C无法有效评估致动脉粥样硬化的胆固醇颗粒含量。sd-LDL-C可以有效反映LDL颗粒的异质性,sd-LDL-C浓度越高,致动脉粥样硬化能力越强[3]。美国胆固醇教育计划(the National Cholesterol Education Program,NECP)和美国内分泌协会已将sd-LDL-C纳入主要动脉粥样硬化心血管疾病风险因素中的附加危险因素,证据等级为D[4-5]。 酶法检测sd-LDL-C结果与超速离心法具有良好的相关性[6],重复性较好,适用于大批量检测。酶法可在生化分析仪上检测密度为1.044~1.063 g/mL的sd-LDL-C[7]。NMR支持同时测定包括葡萄糖、氨基酸、苯类、维生素、药物、化妆品在内的多种分析物,为分析一系列生物分子和代谢产物提供了有力的技术支持。NMR的原理是通过分析原子在磁场中共振特征的不同来定量检测分子。目前,NMR被已应用于多种疾病,如阿尔茨海默症、癌症、糖尿病、炎症及冠心病等外周血生物标志物的检测[8]。由于传统的血脂项目与冠状动脉狭窄程度的关系不明确,因此需要通过检测极低密度脂蛋白(verylow-density lipoprotein,VLDL)、中等密度脂蛋白(intermediate-density lipoprotein,IDL)、LDL和高密度脂蛋白(high-density lipoprotein,HDL)的颗粒直径及其亚组分的浓度,更全面地分析血脂与冠状动脉狭窄的关系,而NMR可为相关血脂项目的检测提供有力的支持。以往由于NMR需要特殊的算法,因此校准和验证问题一直是临床关注的焦点。有研究结果显示,当遵循标准化的核磁共振测量协议时,实验室之间的结果具有良好的重现性[9]。由于只有化学位移处于(0.7~0.9)×10-6的脂质区域,并且包含甲基信号的物质才可能对脂蛋白分析产生干扰,因此NMR不受如浊度等常见干扰因素的影响[10]。虽然NMR有很好的临床应用价值,但其检测仪器价格昂贵,目前尚难以在临床推广。 本研究结果显示,传统生化检测方法与NMR检测血脂项目的r2值由高到低依次为TG(0.996)、TC(0.928)、HDL-C(0.875)、LDL-C(0.827)、sd-LDL-C(0.640)。导致r2值不同的原因可能为:传统生化检测方法一般直接采用酶法检测血清TG、TC水平,检测HDL-C、LDL-C和sd-LDL-C时需先除去其他类型的脂质,然后使用酶法检测相应脂蛋白的胆固醇水平;NMR直接通过脂蛋白的共振特征来检测其含量,准确程度较传统生化检测方法高,因此2种检测方法检测不同脂蛋白结果的相关性会出现差异。OTVOS等[11]比对了NMR与传统生化检测方法的血脂检测结果,发现VLDL-TG、LDL-C、HDL-C项目2种方法的r值分别为0.98、0.91、0.93。JEYARAJAH等[12]的研究结果显示,VLDL-TG、HDL-C项目NMR与传统生化检测方法的r值分别为0.978、0.959。本研究结果与文献报道[11-12]基本一致。本研究还分析了LDL亚组分胆固醇水平与酶法检测的sd-LDL-C水平的相关性,结果显示LDL6-C与sd-LDL-C呈正相关(r=0.800,P<0.05),但相关性不高。原因可能为:首先,酶法检测的sd-LDL-C是密度为1.044~1.063 g/m3,粒径为22.0~25.5 nm的LDL[2];NMR检测的LDL6-C对应的是密度为1.044~1.060 g/m3,粒径为18.3~19.1 nm的LDL[1];2种检测方法检测的LDL密度基本一致,但粒径有差异。其次,酶法检测sd-LDL-C需先除去其他脂质,然后再检测相应的胆固醇水平,具有一定的模糊性;NMR直接通过相应脂蛋白的共振特征来检测其水平,准确程度高于酶法。本研究结果显示,传统生化检测方法与NMR检测sd-LDL-C的回归方程为Y=0.457X+5.893(r2=0.640,P=0.000)。脂蛋白颗粒的胆固醇含量在不同个体之间差异很大,并且通常取决于患者的代谢状态[13]。因此,LDL-C水平与NMR检测LDL-P的结果常不一致[14]。本研究根据NMR的LDL-C和LDL-P检测结果分别计算54例患者各指标的百分位数。LDL-C百分位数≥LDL-P百分位数的患者LDL6-C、sd-LDL-C、LDL6-P水平均高于LDL-C百分位数 本研究尚有局限之处。首先,由于NMR对基质中的剧烈变化较为敏感,离子强度和pH值的改变均会对脂质信号的化学位移产生影响。因此,需在采血后4 h内完成检测。若实验室无检测条件,须在规定时间内分离血浆,冷冻保存后送检[19]。本实验室将EDTA-K2抗凝血样本在4 h内离心并分离血浆,-80 ℃保存后统一送检。在血浆样本的保存及运输过程中不能排除样本冻融情况,因此可能会对NMR检测结果的准确性产生一定的影响。其次,本研究为单中心研究,样本量偏小,其结果可能存在一定的偏差,后续还将扩大样本量进一步研究。 综上所述,NMR与传统生化检测方法的血脂检测结果有一定相关性。LDL-P与LDL-C水平不一致患者的sd-LDL-C水平有一定差异。目前,国内外仍将LDL-C作为临床降脂治疗的靶标,但仅测定LDL-C不能很好地预测LDL-P与LDL-C不一致患者的心血管事件风险,此类患者发生心血管事件的风险往往会被低估,而检测LDL-P、sd-LDL-C水平可有效反映此类患者的心血管事件风险,有助于指导临床用药。
3 讨论