芹菜素抑制人良性胆管瘢痕成纤维细胞的增殖迁移并诱导其凋亡和机制*
2021-07-29胡晟张小文
胡晟,张小文
(昆明医科大学第二附属医院肝胆胰外科二病区,昆明 650101)
良性胆管狭窄(benign biliary strictures,BBS)最常发生于术后或长期炎症反应之后,患者可能无症状,或仅出现肝功能异常,或伴有严重黄疸,甚至并发重症胆管炎危及生命[1]。研究表明[2],在胆管重建中成纤维细胞(fibroblast,FB)增殖明显,FB在胆管瘢痕增生和BBS发展中起重要作用。FB可转化为肌成纤维细胞(myofibroblast,MFB),FB所分泌的细胞外基质(extracellular matrix,ECM)成分能够将大量Ⅰ型胶原蛋白(Collagen Ⅰ)、Ⅲ 型胶原蛋白(Collagen Ⅲ)沉积,促进胆管瘢痕组织的形成,具有收缩特性的α-肌动蛋白(alpha smooth muscle actin,α-SMA)进一步促进胆管组织瘢痕性挛缩,进而导致组织不断纤维化,最终导致BBS形成[3]。同时,转化生长因子-β1(transforming growth factor-β1,TGF-β1)信号通路过表达同样在BBS形成过程中起到至关重要的作用[4]。芹菜素(Apigenin)是一种常见的黄酮类化合物,存在于各种水果和蔬菜中,如:欧芹、洋葱、苹果和某些调味料。芹菜素由于其抗炎、抗氧化、镇静、降血压和抑制肿瘤增生作用而受到越来越多的关注[5]。芹菜素被证明可以抑制多种肿瘤细胞的生长,如:前列腺癌、乳腺癌、黑色素瘤和白血病细胞等[6]。目前已经阐明了芹菜素抑制细胞生长的几种机制,包括细胞周期阻滞、细胞相关蛋白表达异常和细胞凋亡的诱导等[7]。然而,笔者尚未见文献报道芹菜素对人良性胆管瘢痕成纤维细胞(human benign bile duct scar fibroblasts,HBBDSF)的影响。笔者研究原代培养HBBDSF并鉴定,使用芹菜素干预细胞,观察细胞内TGF-β1、α-SMA、CollagenⅠ和Collagen Ⅲ蛋白的表达及细胞增殖、迁移和凋亡水平的变化,现报道如下。
1 材料与方法
1.1材料与试剂 人良性胆管瘢痕组织经过患者知情同意,由我院肝胆胰外科二病区提供。人皮肤成纤维细胞(HSF)、人胚肺二倍体细胞(HDM1)购自中国科学院昆明动物研究所细胞库。芹菜素(Apigenin)(上海麦克林生化科技有限公司,批号:A800500,规格:100 mg,含量≥98%);改良杜氏伊格尔培养基(dulbecco's modified eagle medium,DMEM)(Sigma公司,批号:D5796);胎牛血清(fetal bovine serum,FBS)(批号:C0227)、磷酸缓冲盐溶液(phosphate-buffered saline,PBS)(批号:ST447)、胰酶细胞消化液(0.25%胰酶,含酚红)(批号:C0203)、增强型CCK-8试剂盒(批号:C0041)、BeyoClickTMEDU-488细胞增殖检测试剂盒(批号:C0071S)、Annexin V-FITC细胞凋亡检测试剂盒(批号:C1062S)购自上海碧云天生物科技有限公司;兔抗人Vimentin(批号:WL01960)、兔抗人Keratin(批号:WL03015)、兔抗人TGF-β1(批号:WL02998)、兔抗人α-SMA(批号:WLH3879)、兔抗人Collagen I(批号:WL0088)、兔抗人Collagen III(批号:WL03186)、兔抗人β-Actin(批号:WL01372)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(批号:WLA031)购自沈阳万类生物科技有限公司。
1.2方法
1.2.1原代细胞的培养与鉴定 经手术获得的硬化胆管使用无菌PBS溶液清洗5次,无菌精细眼科剪剪为1 mm3大小。将组织分散至T25细胞培养瓶中,加入5 mL含10% FBS的DMEM培养基,置入37 ℃、5%二氧化碳(CO2)的细胞培养箱中培养[8]。分离纯化成纤维细胞,细胞生长至85%时消化、传代。利用细胞免疫荧光技术检测细胞Vimentin及Keratin抗体的表达进行细胞鉴定[9]。阳性对照选用HSF细胞,阴性对照选用HDM1细胞。
1.2.2CCK-8法检测细胞半数抑制率(IC50)及增殖抑制率 将细胞接种至96孔板,细胞数量1×103个·mL-1,预先配制不同浓度梯度的芹菜素溶液(5,10,20,40,80 μmol·L-1)。次日弃去培养液,加入各浓度的芹菜素溶液继续培养24,48,72 h。每孔中加入CCK-8溶液10 μL,1 h后于全波长自动酶联免疫检测仪(型号:SPECTROstar Nano,产地:德国BMG公司)测定450 nm处吸光度(A)值。使用GraphPad Prism 8绘制IC50曲线及计算IC50值;计算人胆管瘢痕成纤维细胞的生长抑制率:抑制率(%)=(对照组A值-实验组A值)÷对照组A值×100%。
1.2.3EDU-488法检测细胞增殖情况 将细胞接种至24孔板,细胞数量5×103个·mL-1。次日,加入IC50浓度以下的芹菜素作为实验组(10,20 μmol·L-1),对照组仅加入同等体积的含有10%FBS的DMEM培养基,继续培养24 h。次日,向每孔中加入2X EDU工作液300 μL,继续培养2 h。之后4%的多聚甲醛室温固定15 min,再用含3%BSA的PBS洗涤3次,后加0.3% Triton X-100的PBS室温培养15 min,洗涤后每孔中加入Click反应液100 μL室温避光培养30 min,接着每孔加入Hoechst33342(1000X)染料500 μL室温避光培养20 min。最后在全自动荧光显微镜(型号:EVOS M7000,产地:赛默飞世尔科技有限公司)下观察并摄像记录。细胞计数后,计算增殖细胞比率(%)=增殖细胞数÷总细胞数×100%。
1.2.4细胞划痕实验检测细胞迁移情况 将细胞接种至6孔板,细胞数量1×104个·mL-1。次日,使用无菌200 μL枪头垂直于昨日所标记的黑线进行划痕,PBS 1X清洗1~2次。加入IC50浓度以下的芹菜素作为实验组(10、20 μmol·L-1),对照组仅加入同等体积的含有10%FBS的DMEM培养基,在倒置显微镜(型号:EVOS XL CORE,产地:Thermo公司)下于0,6,12,24 h分别观察并摄像记录。得到原始图片后使用Image J版软件进行划痕面积的定量计算。
1.2.5高速分析型流式细胞仪(型号:Attune Nxt,产地:赛默飞世尔科技有限公司)检测细胞凋亡情况 将细胞接种至6孔板,细胞数量1×104个·mL-1。次日,加入IC50浓度以下的芹菜素作为实验组(10,20 μmol·L-1)4 h以诱导凋亡,对照组仅加入同等体积的含有10%FBS的DMEM培养基培养。4 h后消化6孔板内细胞,制成细胞悬液转移至流式上样管中,再向流式上样管中依次加入Annexin V-FITC结合液195 μL、Annexin V-FITC溶液5 μL、碘化丙啶染色液10 μL并轻轻混匀室温避光染色15 min,立即上机检测。
1.2.6免疫荧光法检测细胞TGF-β1、α-SMA、CollagenⅠ和Collagen Ⅲ蛋白的表达情况 将细胞接种至96孔板,细胞数量1×103个·mL-1。次日,加入IC50浓度以下的芹菜素作为实验组(10、20 μmol·L-1),对照组仅加入同等体积的含有10%FBS的DMEM培养基继续培养72 h。之后利用免疫荧光法检测细胞TGF-β1、α-SMA、CollagenⅠ和Collagen Ⅲ 蛋白的表达情况,在荧光显微镜下观察并摄像记录。
1.2.7Western blotting检测细胞TGF-β1、α-SMA、CollagenⅠ和Collagen Ⅲ 蛋白的表达情况 提取各组细胞总蛋白,采用BCA法检测并计算蛋白浓度,以SDS聚丙烯酰胺凝胶(SDS-polyacrylamide gel elextrophoresis,SDS-PAGE)凝胶进行电泳。使用聚偏 二氟乙烯膜(polyvinylidene fluoride,PVDF)转膜,再行封闭处理,以1:5000比例稀释一抗,置于4 ℃冰箱过夜,Tris-HCl缓冲盐溶液(TBST)磷酸缓冲液清洗PVDF膜3~5次。以1:5000比例稀释二抗,并室温孵育2 h,TBST磷酸缓冲液再次清洗PVDF 膜3~5次。β-actin作为内参,实验条带的灰度值采用Quantity one软件进行处理分析。
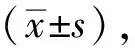
2 结果
2.1HBBDSF的鉴定结果 原代培养的HBBDSF在光镜下呈不规则三角形,随之逐渐转化为梭形的单核细胞,此时形态与成纤维细胞十分近似。原代培养的第5代HBBDSFD的Vimentin、Keratin均为强阳性表达(表现为强烈的绿色荧光),鉴定成纤维细胞主要是根据细胞形态和Vimentin、Keratin抗体的细胞免疫荧光进行。根据细胞光镜下形态及免疫荧光结果可证明此细胞为HDDBSF。阳性对照组(HSF)结果Vimentin阳性而Keratin阴性表达,阴性对照组(HDM1)均表达为阴性。详见图1~3。
2.2CCK-8法检测芹菜抑制细胞IC50值及芹菜素对细胞增殖影响的结果 选取48 h的重复测量5次的吸光度(A)值进行IC50值计算芹菜素IC50=22.75 μmol·L-1,R2=0.797,见图4。本研究后续实验选择的芹菜素药物浓度均在IC50值以下(10,20 μmol·L-1)。20 μmol·L-1组在24,48和72 h时与10 μmol·L-1比较,差异均有统计学意义(P<0.05),说明芹菜素的干预浓度越高则对细胞增殖的抑制率也越高。图4、见表1。
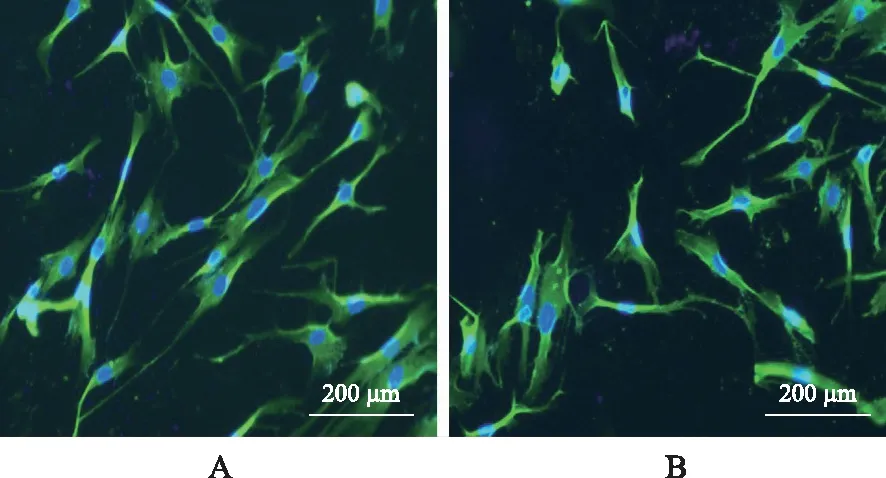
A.Vimentin(+);B.Keratin(+)。
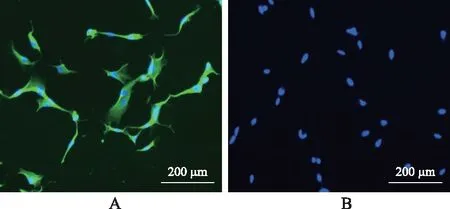
A.Vimentin(+);B.Keratin(-)。
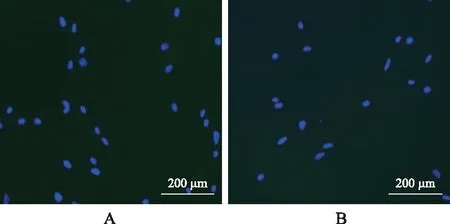
A.Vimentin(-);B.Keratin(-)。
2.3EDU-488法检测芹菜素对细胞增殖影响的结果 被绿色荧光染色的代表增殖细胞,未被绿色荧光染色的为正常细胞。该实验显示,与对照组比较,10,20 μmol·L-1组的细胞增殖百分比均降低(P<0.01);相对于10 μmol·L-1组,20 μmol·L-1组的细胞增殖百分比降低(P<0.05)。见图5,6。
2.4细胞划痕实验检测芹菜素对细胞迁移影响的结果 使用面积表示细胞划痕区域,该实验显示12 h和24 h中,与对照组比较,10,20 μmol·L-1组细胞迁移后剩余面积均升高(P<0.05);相对于10 μmol·L-1组,20 μmol·L-1组的细胞迁移后剩余面积增大(P<0.05)。见图7~10。
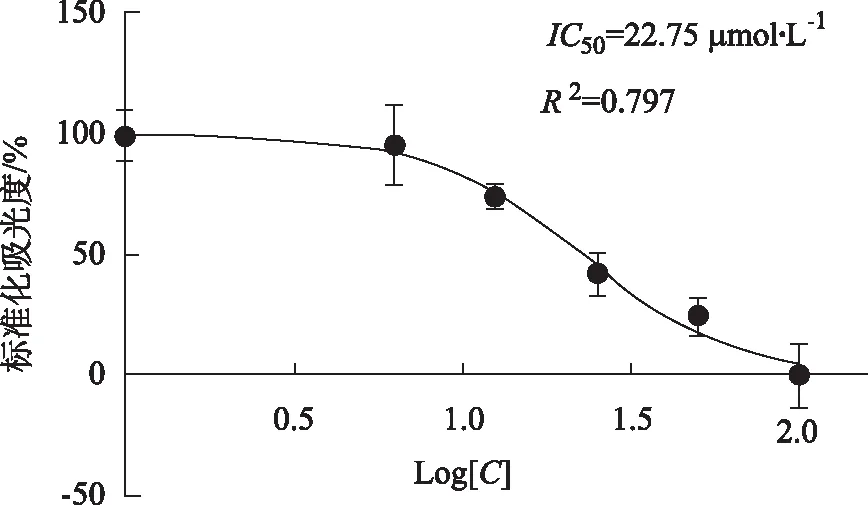
Log[C]代表芹菜素溶液(80,40,20,10,5 μmol·L-1)的对数值。
2.5流式细胞仪检测芹菜素对细胞凋亡影响的结果 利用二、四象限细胞百分比进行单因素方差分析,与对照组比较,10,20 μmol·L-1组的细胞早晚期凋亡百分比均升高(P<0.05);相对于10 μmol·L-1组,20 μmol·L-1组的细胞早晚期凋亡百分比升高(P<0.05)。见图11,12。
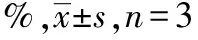
表1 芹菜素对HBBDSF增殖的抑制率
2.6免疫荧光技术检测芹菜素对细胞TGF-β1、α-SMA、Collagen Ⅰ 和Collagen Ⅲ 蛋白的表达情况的结果 免疫荧光实验中绿色荧光代表阳性表达,且绿色荧光越强则表达越强,反之亦然。本例中,对照组细胞对TGF-β1、α-SMA、Collagen I和Collagen Ⅲ 蛋白均表现出强烈的绿色荧光,10,20 μmol·L-1的芹菜素组均表现出较弱的绿色荧光。说明芹菜素作用下,细胞对4种蛋白表达均减弱。见图13。
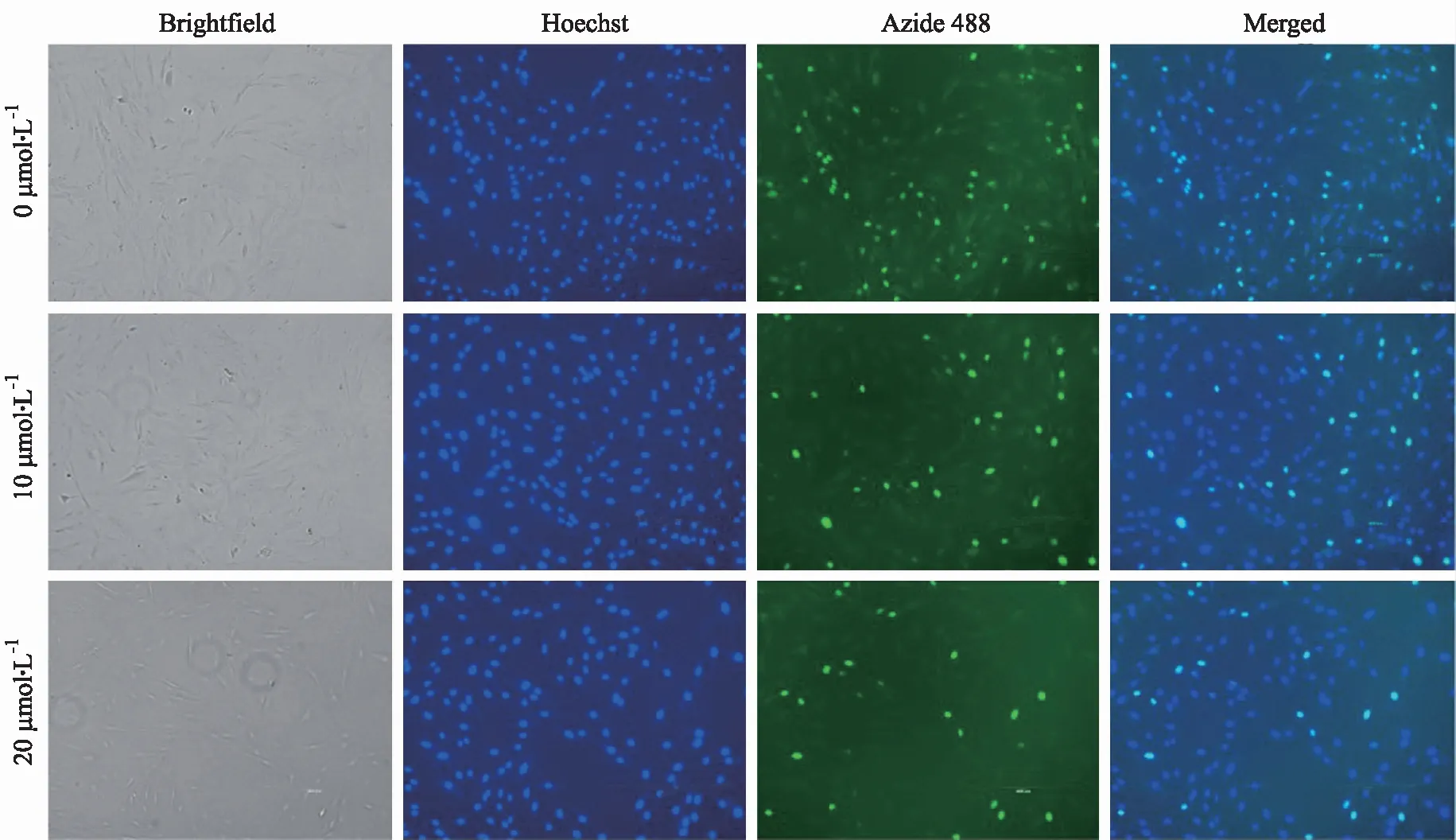
图5 EDU-488法检测芹菜素对细胞增殖抑制的荧光图(×100)
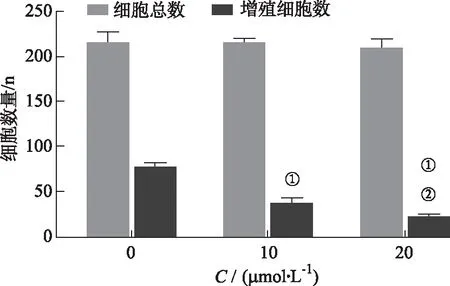
①与对照组比较,t=13.412,16.263,P<0.05;②与芹菜素10 μmol·L-1组比较,t=4.930,P<0.05。
2.7Western blotting检测芹菜素对细胞TGF-β1、α-SMA、Collagen Ⅰ和Collagen Ⅲ 蛋白的表达情况的结果 经过芹菜素72 h刺激后,与对照组比较,10,20 μmol·L-1芹菜素组对TGF-β1、α-SMA、Collagen I和Collagen Ⅲ 蛋白表达水平均降低(P<0.05),进一步两两比较,随着芹菜素浓度增高,抑制细胞4种蛋白表达能力越强(P<0.05),详见图14。
3 讨论
在胆管损伤及修复过程中,增生性瘢痕形成是不可避免的,在肝内外胆管中,增生性瘢痕的形成与BBS的发生发展密切相关[10]。FB在胆管损伤修复中有重要地位,它是由胚胎时期的间充质干细胞分化发育而形成的。组织损伤后,FB扩增并转化成MFB,后者会分泌ECM,不断挛缩并填补组织缺损。一般情况下,只要组织缺损能够表皮化,FB和MFB凋亡的进程就会加快,而且ECM分泌会显著减少,组织修复的过程就趋向终止;另外,如果FB和MFB不断大量增生,同时ECM持续过量积累,则会逐渐形成增生性瘢痕,最终形成BBS[11]。

图7 对照组细胞划痕面积变化示意图(×40)
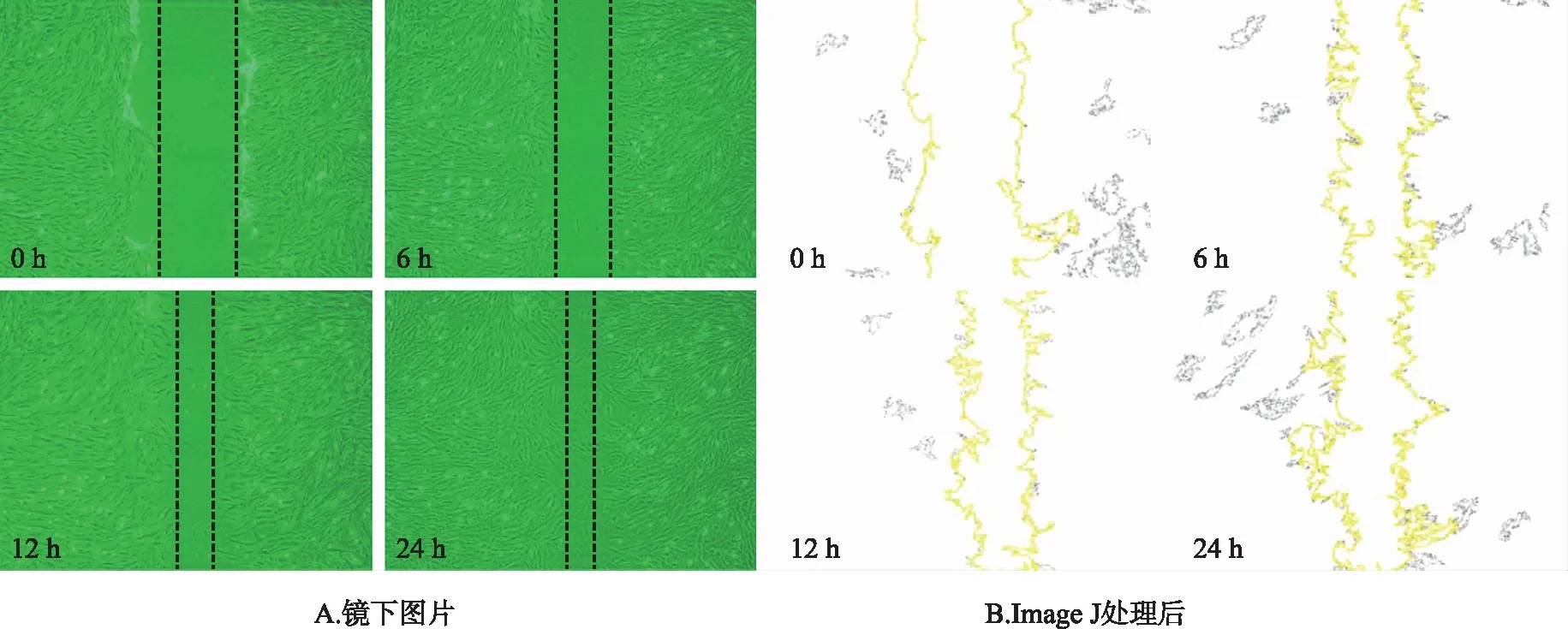
图8 芹菜素10 μmol·L-1组细胞划痕面积变化示意图(×40)
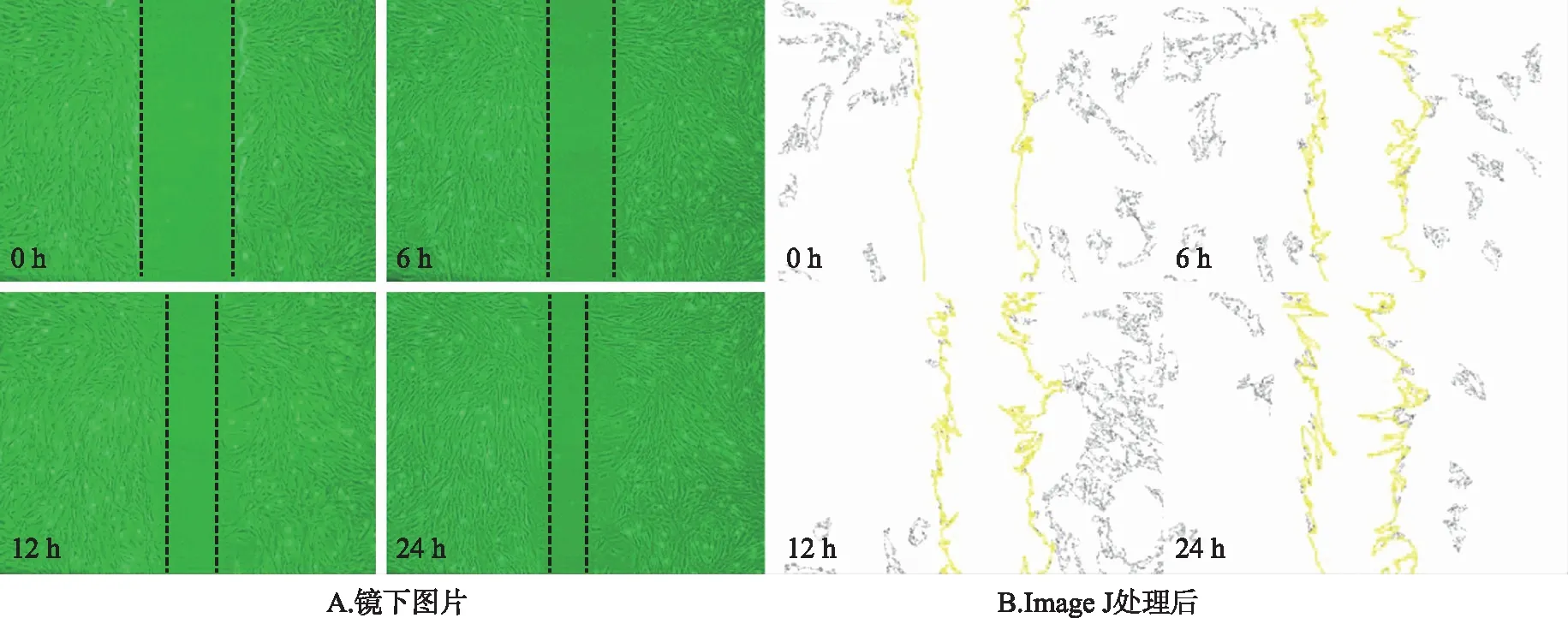
图9 芹菜素20 μmol·L-1组细胞划痕面积变化示意图(×40)
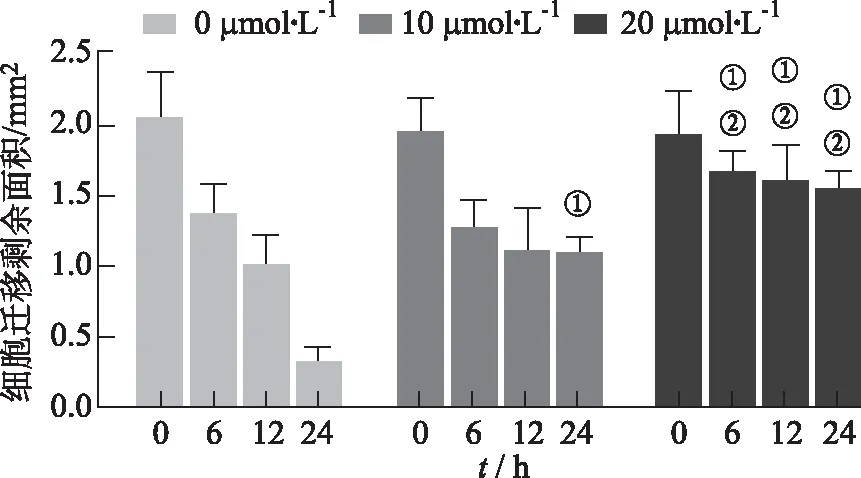
①与对照组比较,t=-158.921,0.770,P<0.05;②与芹菜素10 μmol·L-1组比较,t=-49.676,8.059,P<0.05。
TGF-β1是一种具备多样生物学效能的蛋白分子,是与胆管瘢痕形成最紧密的蛋白,它对于细胞的增生、组织瘢痕形成等病理生理过程起到了重要作用[12]。组织受到损伤后,FB和MFB中TGF-β1蛋白的表达量会显著提高,并且TGF-β1积聚到一定量又能刺激FB大量增生,促使组织损伤后的修复系统激活[13]。TGF-β1重点是靠TGF-β1/Smads信号转导通路继而发挥其作用,抑制瘢痕组织和瘢痕FB中TGF-β1/Smads信号转导通路的表达是目前治疗瘢痕的主要手段之一[14]。
α-SMA表达为阳性为MFB特征性的标识,MFB同时具备FB和平滑肌细胞的特征,它有比较强的伸缩特性,也能分泌多量的ECM和调节ECM相关的基质金属蛋白酶(matrix metalloproteinases,MMPs)和基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TIMPs)[15]。FRANGOGIANNIS[16]发现,在胆管瘢痕组织中ECM特别是其中的CollagenⅠ和Collagen Ⅲ 蛋白过量堆积,正常组织中MMPs和TIMPs可维持ECM的微环境以保持平衡,当组织受到损伤后MMPs和TIMPs的表达会不同于寻常,影响ECM的降解和代谢,导致其过量堆积,继而形成瘢痕。胆管瘢痕FB和MFB中α-SMA的表达情况也受到TGF-β1含量的影响[17]。
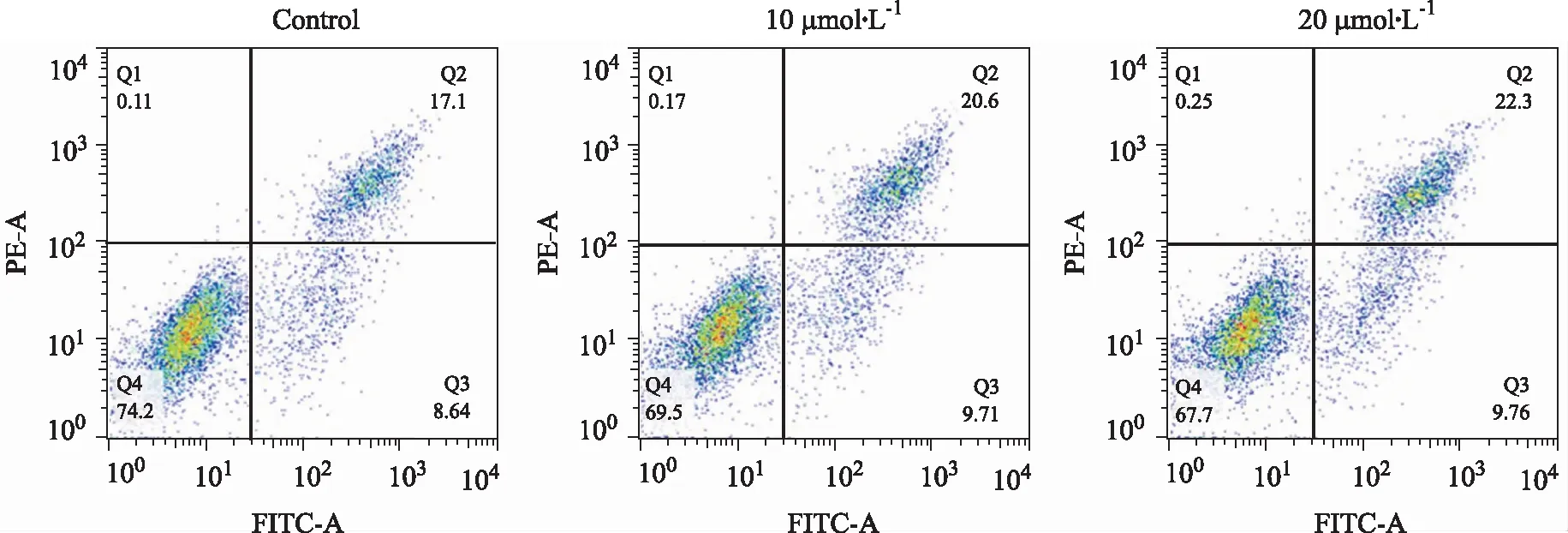
图11 流式细胞仪检测芹菜素对细胞凋亡影响的散点图
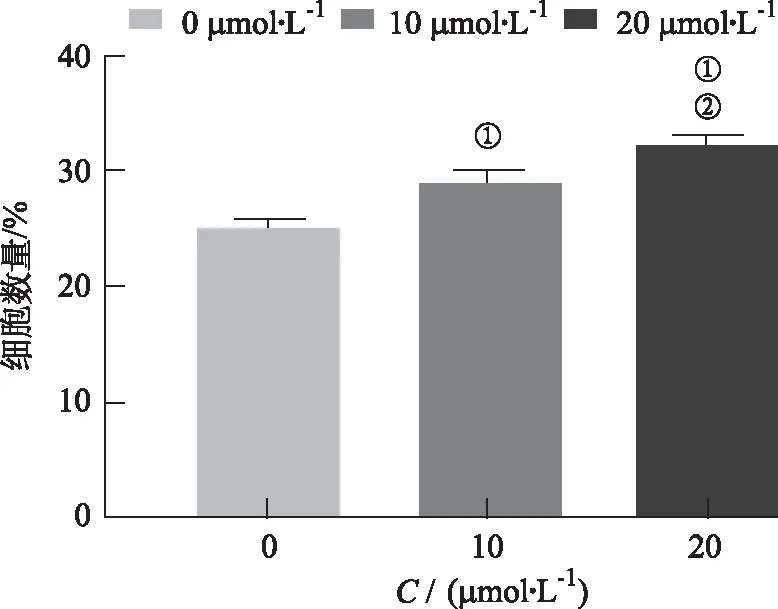
①与对照组比较,t=-13.254,-5.902,P<0.05;②与芹菜素10 μmol·L-1组比较,t=-4.685,P<0.05。

图13 3组对TGF-β1、α-SMA、Collagen I和Collagen Ⅲ 蛋白表达的免疫荧光图(×200)
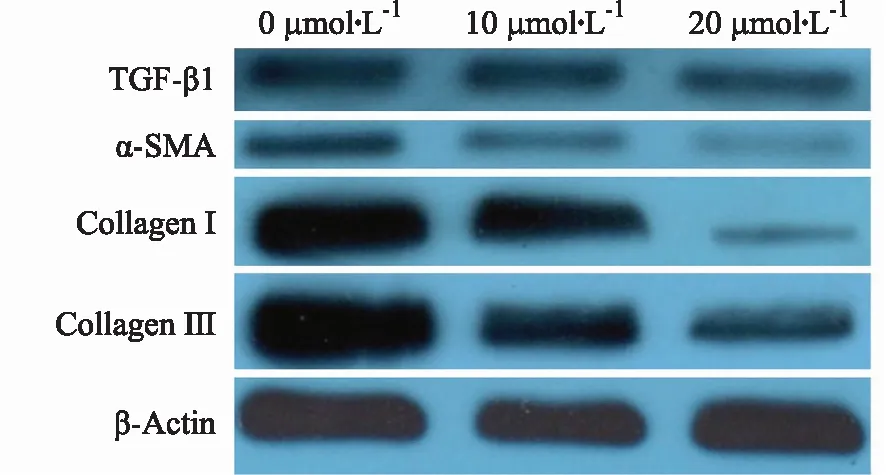
图14 芹菜素对TGF-β1、α-SMA、Collagen I和Collagen Ⅲ 蛋白表达的影响
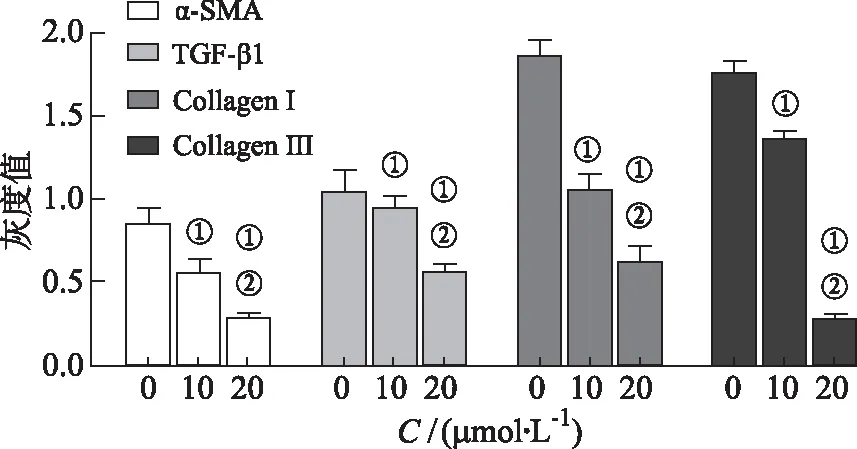
①与对照组比较,t=4.531,35.961,P<0.05;②与芹菜素10 μmol·L-1组比较,t=6.029,30.898,P<0.05。
近年来,中药及其衍生物在治疗组织瘢痕中的应用已得到广泛研究[18]。芹菜素具有抗肿瘤特性,并对一些慢性炎症性疾病具有一定的疗效。体外研究表明[19],芹菜素可通过TGF-β1途径抑制成纤维细胞的迁移,从而发挥治疗哮喘和慢性鼻窦炎的作用。RICUPERO等[20]报道芹菜素通过抑制肺成纤维细胞的Akt途径抑制成肌纤维细胞的增殖、Collagen Ⅰ和α-SMA的表达,并降低TGF-β1诱导的α-SMA的表达。JUN等[21]证明在体外ECM重塑模型中,生理浓度的芹菜素抑制内皮素-1诱导的胶原蛋白凝胶收缩。在博来霉素诱导的系统性硬化小鼠模型中,芹菜素抑制博来霉素诱导的肺纤维化。然而,关于胆管瘢痕的研究很少。笔者首先通过体外实验探讨了芹菜素在胆管瘢痕成纤维细胞中的作用机制。本研究结果首次表明芹菜素可抑制细胞增殖和迁移,并可诱导细胞凋亡。且芹菜素可降低细胞TGF-β1、α-SMA、CollagenⅠ和Collagen Ⅲ 蛋白的表达,芹菜素通过TGF-β1/Smads信号转导通路影响HBBDSF的一系列生物学行为,但具体机制有待进一步研究。
