阿司匹林诱导人结肠癌细胞Caco-2凋亡与Lgr5的关系*
2021-07-29陈小燕吴应强朱蓉赵逵
陈小燕,吴应强,朱蓉,赵逵
(遵义医学院附属医院1.消化内科;2.全科医学科,遵义 563099)
近年来,随着人们生活方式的改变,结肠癌发病率上升位居世界第三的恶性肿瘤[1]。发病年龄日益年轻化,治疗也面临诸多挑战,早期防治结肠癌具有十分重要的意义。虽然放射治疗、化学治疗和生物治疗等方法在结肠癌治疗中显示出显著的疗效,但并不能彻底治愈结肠癌,这一临床问题随着肿瘤干细胞(cancer stem cells,CSCs) 概念[2-3]的提出得到了更好地解释。LENG等[4]研究结果显示,结肠癌中致瘤细胞高度局限于Lgr5阳性亚群,与Lgr5阴性亚群比较,Lgr5阳性亚群表现出更高的集落形成能力、自我更新能力、分化能力、致瘤性以及干细胞基因和间充质基因的高表达能力。Lgr5目前作为结肠肿瘤干细胞标志物的相关研究已成为热点。新近研究显示,Lgr5是Wnt通路的目标基因,Lgr5蛋白在结直肠癌中高表达,与肿瘤的发生、侵润、转移以及患者预后均密切相关[5],进一步表明Lgr5参与了结直肠癌的发生发展,可能作为一个潜在的治疗靶点[6]。流行病学和实验研究显示,阿司匹林能降低腺瘤和结肠癌发生的风险,有效预防结肠癌发生[7],但其作用机制未明确。阿司匹林是如何作用于肿瘤干细胞以及对肿瘤干细胞标志物有何影响,目前尚不清楚。笔者前期研究[8-10]结果显示阿司匹林能够抑制HT-29(COX-2高表达)和SW-480(COX-2阴性表达)人结肠癌细胞株中如Lgr5等多种肿瘤干细胞标记物的表达。对于阿司匹林如何影响人结肠癌细胞株COX-2低表达的Caco-2中Lgr5表达,笔者进行了深入研究,进一步探讨阿司匹林防治结肠癌发生的可能机制。
1 材料与方法
1.1材料 人结肠癌细胞株Caco-2由湖南湘雅大学细胞实验室提供。阿司匹林购自美国Sigma公司,含量>99.0%,批号:16326。胎牛血清(购自美国Hyclone公司)、DMEM高糖培养基(购自美国Hyclone公司)、胰蛋白及MTT(购自美国Sigma公司),AnnexinV-FITC/PI细胞凋亡检测试剂盒(购自南京凯基生物科技发展有限公司),辣根酶标记山羊抗兔IgG、兔抗人Lgr5多克隆抗体(购自北京中杉金桥公司),Lgr5引物、β-actin引物(购自北京江晨宏伟生物科技有限公司),SYBR Premix Ex Taq 、PrimeScriptTM RT Reagent Kit(购自大连宝生物工程有限公司)。
1.2方法
1.2.1细胞的培养 Caco-2细胞置于含10%胎牛血清的杜尔伯克改良基础培养基(DMEM)中,37.0 ℃、50 mL·L-1二氧化碳(CO2)的培养箱中进行培养,待细胞贴壁融合度约为80%~90%时,用胰蛋白酶-EDTA混合消化液消化传代后继续培养。实验时选取对数生长期的细胞。
1.2.2噻唑蓝(MTT)法检测阿司匹林对结肠癌Caco-2细胞存活率的影响 Caco-2细胞消化离心后重悬于培养基中,调整细胞悬液浓度为1×105个·mL-1,接种于96板,每孔100 μL;空白组用培养基代替,置于37 ℃、5%CO2细胞培养箱中过夜;空白组及对照组加入培养基100 μL,实验组加入不同浓度的阿司匹林,浓度分别为1.0,1.5,2.5,5.0,10.0,15.0,20.0,25.0,30.0 mmol·L-1,各100 μL,每组设5个复孔;加药后分别培养24,48和72 h,每孔吸掉上清液100 μL后加入0.5%MTT溶液20 μL,继续培养4 h;吸去孔内培养液,每孔加入二甲亚砜(DMSO)150 μL,置摇床上低速振荡10 min,使结晶物充分溶解震荡10 min,酶标仪(Thermo Fisher公司,型号MULTISKAN SPECTRUM)测定490 nm波长处的吸光度(A值)。细胞的生长抑制率=(1-实验组A值/对照组A值)×100%;计算阿司匹林对结肠癌Caco-2细胞增殖的半数抑制浓度IC50,实验重复3次。
1.2.3流式细胞术检测细胞凋亡 消化传代Caco-2细胞,待细胞贴壁过夜后加入各浓度的阿司匹林(5.0,10.0,15.0 mmol·L-1)作用12 h,以及15.0 mmol·L-1阿司匹林分别作用6,12和24 h后消化,离心2000 r·min-1×5 min,磷酸盐缓冲液(PBS)重悬细胞;PBS洗涤细胞2次(2000 r·min-1×5 min);加入500 μL的结合缓冲液(Binding Buffer)悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL碘化丙啶(Propidium Iodide),混匀;室温、避光、反应15 min;流式细胞仪(Beckman Coulter公司,型号:MOFLO)检测,重复3次。
1.2.4实时-反转录聚合酶链反应(RT-PCR)检测Caco-2细胞中Lgr5 mRNA的表达 实验组加入10 mmol·L-1阿司匹林2 mL,分别作用6,12和24 h,对照组则加入2 mL培养基,消化收集各组细胞悬液,运用Trizol法提取细胞总RNA,全波段酶标仪测定样品中RNA的纯度及浓度,采用反转录酶试剂盒逆转录c DNA;以cDNA 为模板,分别扩增β-actin 和Lgr5 基因,用于RT-PCR的引物对是由大连宝生物工程公司合成,β-actin上游引物序列(5′-3′)为:TGGCACCCAGCACA ATGAA,下游引物序列(5′-3′)为:CTAAGTCATAGTCCGCCTAGAAGCA;Lgr5上游引物序列(5′-3′)为:GCTCATGGTAAAACACATTGCCC,下游引物序列(5′-3′)为:TGGGACTACCACCAGAAGGATA;收集扩增产物进行琼脂糖电泳,参照引物设计要求,每组标本中随机选取一个,取扩增产物用2%的琼脂糖凝胶10 μL,100 V、75 mA电压电泳30~40 min,以进一步印证扩增产物。最后紫外分析仪(北京通用分析仪器公司,型号Tu-1810)上观察结果;利用ΔΔCt 2法,即2-ΔΔCT计算出各时间组样本细胞中Lgr5/β-actin比值;实验重复3次。
1.2.5免疫组化检测不同浓度阿司匹林作用后Caco-2细胞中Lgr5蛋白亚细胞定位变化 采用免疫组化EnVision 二步法。制备细胞爬片,待细胞贴壁后分别加入0,5.0,10.0,15.0 mmol·L-1阿司匹林作用24 h后,取出盖玻片;4%多聚甲醛固定;0.5%TritonX-100处理;先后用3%H2O2及2%牛血清白蛋白100 μL室温孵育;加一抗(1:600,阴性对照组用PBS代替一抗)4 ℃孵育过夜;加二抗37 ℃孵育1 h;二氨基联苯胺(DAB)显色,苏木精复染,双蒸水洗,晾干,封片,显微镜观察摄像。Lgr5蛋白阳性表达为细胞内出现棕黄色或黄色颗粒。具体操作步骤严格按照免疫组织化学染色试剂盒要求进行。
2 结果
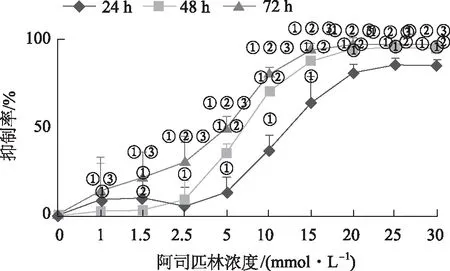
2.1阿司匹林对结肠癌细胞株Caco-2存活的影响 MTT结果显示,随着药物浓度的增加和作用时间的延长,阿司匹林对Caco-2细胞生长的抑制率逐渐增大,呈时间和浓度依赖性,见图1,但浓度超过20.0 mmol·L-1时,抑制率不再明显增大。通过SPSS软件计算得出干预24,48,72 h阿司匹林的IC50分别为13.649,9.090,6.925 mmol·L-1。
2.2流式细胞术检测Caco-2细胞凋亡的结果
2.2.1细胞形态观察 倒置相差显微镜观察细胞形态,空白对照组Caco-2细胞呈梭形,形态均一,贴壁良好,透光性强。5.0,10.0,15.0 mmol·L-1的阿司匹林作用细胞24 h后,细胞贴壁能力明显减弱,细胞变圆变小,大小不一,数量减少,见图2。
①与对照组比较,P<0.05;②与24 h组比较,P<0.05;③与48 h组比较,P<0.05。

图2 不同浓度阿司匹林作用24 h后Caco-2细胞形态学
2.2.2AnnexinⅤ-FITC检测Caco-2细胞凋亡的结果①流式细胞仪检测不同浓度阿司匹林对细胞凋亡的影响 不同浓度阿司匹林作用Caco-2细胞12 h后流式细胞仪检测各组细胞早期凋亡率(AnnexinⅤ+/PI-)和总凋亡率(AnnexinⅤ+),见图3。与对照组比较,5.0,10.0,15.0 mmol·L-1的阿司匹林均可明显提高Caco-2细胞早期凋亡率;除5.0 mmol·L-1组外,其余各组亦可提高Caco-2细胞总凋亡率(n=9,P<0.05),且阿司匹林促凋亡作用成浓度依赖性,见图3。
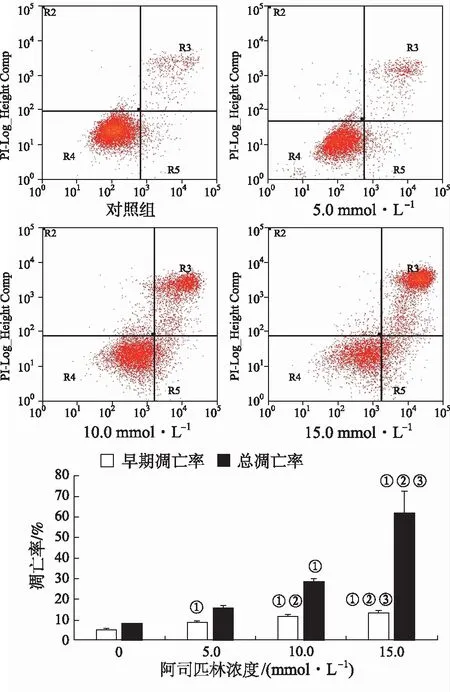
①与对照组比较,P<0.05;②与5.0 mmol·L-1比较,P<0.05;③与10.0 mmol·L-1比较,P<0.05。
②流式细胞术检测阿司匹林作用不同时间对细胞凋亡的影响 15.0 mmol·L-1的阿司匹林分别作用Caco-2细胞0,6,12,24 h后流式检测各组早期凋亡率和总凋亡率,见图4,各时间组早期凋亡率分别为(5.7±1.7)%,(6.5±1.2)%和(13.7±0.65)%,与对照组比较,均可明显提高Caco-2细胞早期凋亡率;总凋亡率分别为(14.7±1.6)%,(37.0±5.4)%,(70.1±7.2)%,除6 h组,其余各组亦可提高Caco-2细胞总凋亡率(n=9,P<0.05),且阿司匹林促凋亡作用呈时间依赖性。
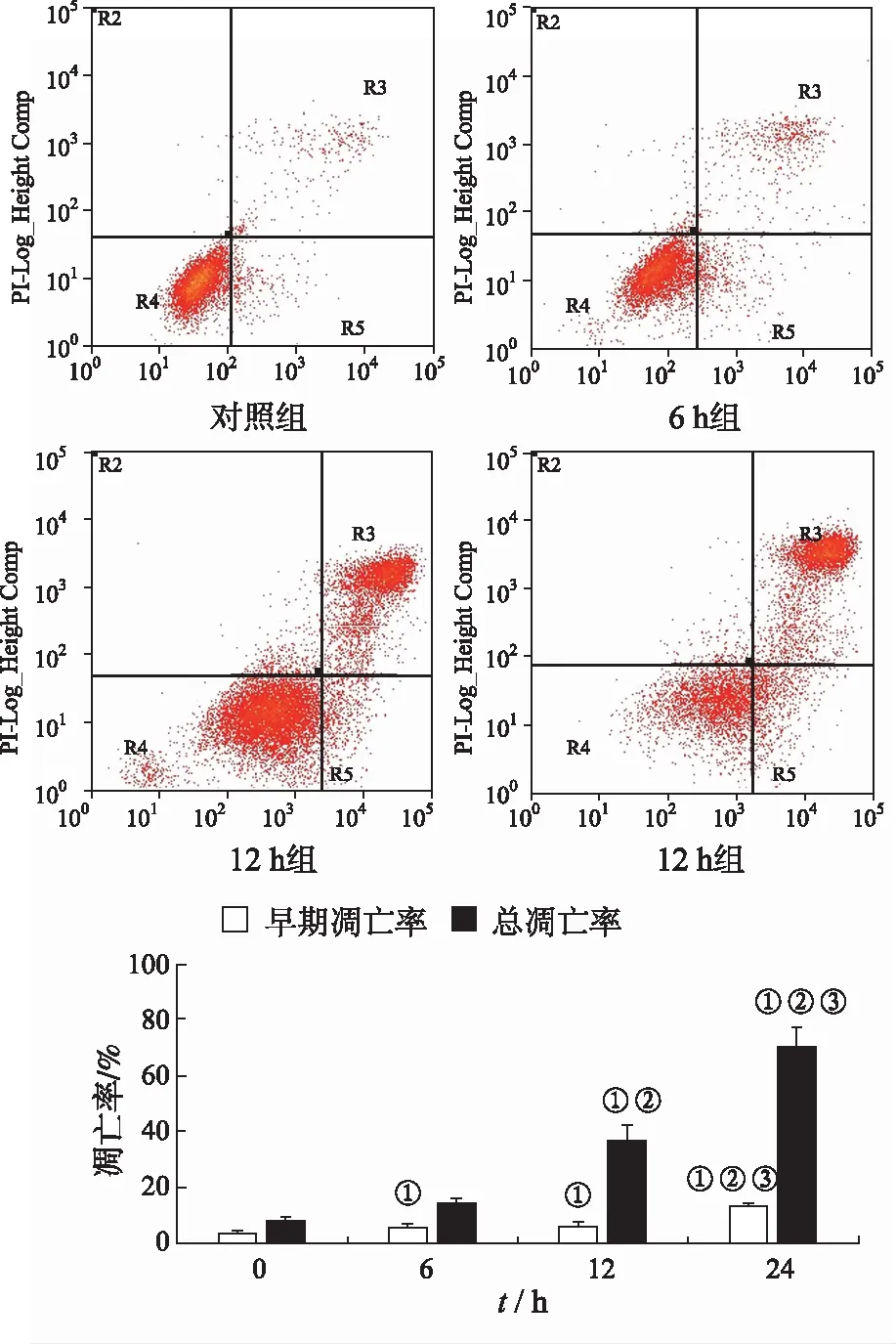
①与对照组比较,P<0.05;②与6 h组比较,P<0.05;③与12 h组比较,P<0.05。
2.3阿司匹林对结肠癌细胞株Caco-2中Lgr5 mRNA表达的影响 10 mmol·L-1阿司匹林分别作用于Caco-2细胞6,12,24 h后进行 RT-PCR分析,以β-actin为内参照,检测各组Lgr5基因表达变化,见表1、表2。扩增产物凝胶电泳成像显示β-actin、Lgr5长度分别为186 bp、146 bp,均在预定位置,进一步印证了扩增产物,见图5。对照组Lgr5 mRNA校正灰度值为65.33±2.52,6 h组、12 h组、24 h组分别为29.00±2.00,36.33±3.06,10.33±1.52。与对照组比较,各实验组Lgr5mRNA的表达均有不同程度下调,其中以12 h组最为明显,均差异有统计学意义(P<0.05),结果说明阿司匹林下调了Lgr5 mRNA的转录。
2.4Lgr5免疫组化结果 Lgr5蛋白免疫组化阳性产物呈棕黄色或黄色颗粒。结果显示Lgr5蛋白在人结肠癌Caco-2细胞中大量表达,主要位于细胞质,少数定位于细胞膜,而细胞核不着色,见图6。5.0 mmol·L-1组中Lgr5蛋白亚细胞定位与对照组相同,也在细胞质和细胞膜表达;10.0 mmol·L-1组和15.0 mmol·L-1组可见Lgr5蛋白亚细胞定位发生了改变,除了细胞膜、细胞质有表达外,细胞核也有明显表达,见图6。
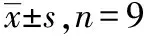
表1 10.0 mmol·L-1 阿司匹林对Caco-2 细胞Lgr5 mRNA 表达的影响
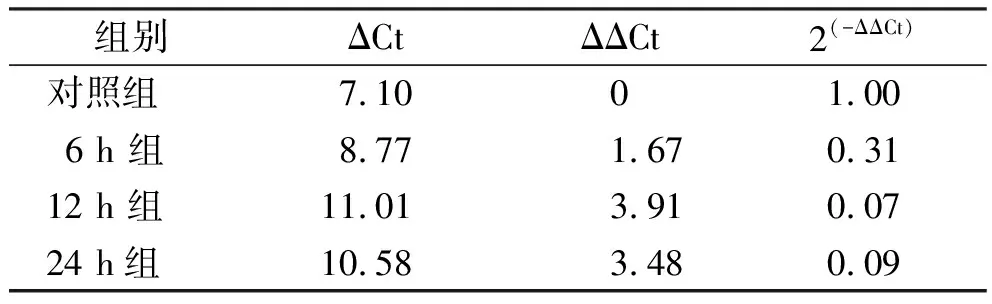
表2 阿司匹林作用不同时间下Lgr5基因改变的倍数
3 讨论
研究显示阿司匹林能够显著抑制结肠癌细胞株Caco-2的生长,并且诱导细胞凋亡[11-13]。阿司匹林对细胞的抑制作用是否与肿瘤干细胞标志物Lgr5有关呢?本实验通过研究阿司匹林对人结肠癌细胞株Caco-2中Lgr5表达的影响,旨在从肿瘤干细胞相关标志物角度探讨其对结直肠癌防治作用,进一步揭示其所涉及的相关机制。
SAIGUSA等[14-15]研究对体外培养且被照射后的结肠癌细胞和术前放化疗的直肠癌患者中Lgr5基因表达水平发现,病理分化程度差及肿瘤复发的患者中Lgr5基因表达量较对照组明显增高,其生存期更短,上述结果表明Lgr5基因过度表达可能与直肠癌对放化疗耐药性有关,导致直肠癌患者的肿瘤复发,促进肿瘤的转移,直肠癌、结肠癌的发病情况类似,因此,Lgr5可以作为一个判断结直肠癌患者预后的理想指标,是一个新的潜在治疗靶点。本实验通过测定阿司匹林作用6,12和24 h后Caco-2细胞中Lgr5mRNA的表达,发现阿司匹林对Lgr5基因表达有明显的抑制作用,呈良好的时间依赖性,其中以12 h组下调最为明显,表明阿司匹林主要是集中在12 h内对Lgr5mRNA的表达有显著抑制作用。由此推测阿司匹林通过抑制结肠癌干细胞Lgr5基因表达而防治结肠癌。那么,阿司匹林抑制Lgr5基因表达涉及的具体机制是什么呢?研究表明阿司匹林等NSAIDs可能通过降低COX的表达[16-17]而抑制Wnt/β-catenin信号通路[18],并减弱β-catenin/TCF下游靶基因Lgr5的转录,以干预肿瘤的发生,这一研究理论印证了本实验结果。笔者前期的实验结果提示阿司匹林可能是通过COX-2途径和非COX-2途径,且主要通过非COX-2途径预防结肠癌发生。本实验中采用的细胞株是COX-2低表达的Caco-2,阿司匹林对Caco-2中Lgr5基因表达抑制呈时间依赖性,这也表明了阿司匹林防治结肠癌的机制可能涉及非COX-2途径。
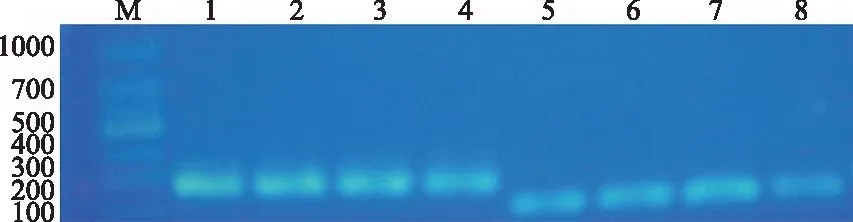
M:Marker,1-4泳道为β-actin mRNA(186 bp)在对照组、6 h组、12 h组和24 h组中的表达;5-8泳道为Lgr5mRNA(146 bp)在对照组、6 h组、12 h组和24 h组中的表达。
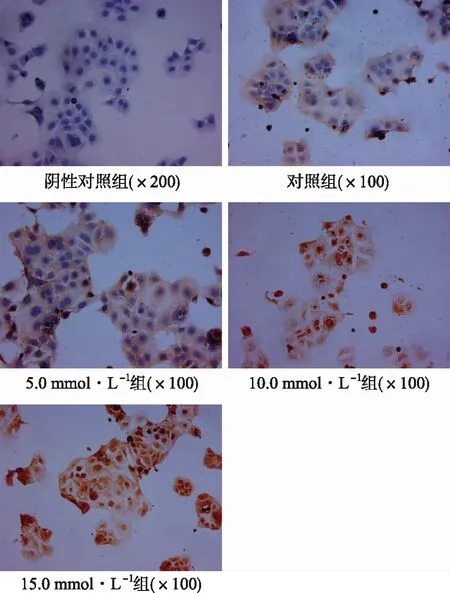
图6 Lgr5蛋白在不同浓度阿司匹林作用后Caco-2细胞中的表达部位
多数研究[19-22]已经证实,Lgr5蛋白在结肠癌、脑胶质瘤、卵巢癌等多种人体实体肿瘤中存在高表达情况。Lgr5蛋白在结肠癌中不仅大量表达,而且还存在着表达分布的差异。通过比较正常结肠、癌前病变、结肠腺瘤以及不同分化的腺瘤、不同分期的腺癌等相关研究表明,Lgr5蛋白的空间分布存在着明显的区别[23-24]。正常结肠组织中,Lgr5在其腔面表达;在癌前病变组织中,Lgr5的表达不再局限于隐窝基底部;而在结肠腺瘤中Lgr5主要在腔面高表达。此外,在分化程度高的腺瘤中,Lgr5主要在隐窝部表达,较少在腔面表达,反之亦然;肿瘤分期晚的腺癌中,Lgr5也主要在腔面表达。这进一步表明,Lgr5的失巢表达预示着肠道干细胞向癌前病变转变,并与肿瘤分化、分期明显相关,其在肿瘤的发生及发展中具有十分重要的作用。因在不同病理状态下,实体组织中的Lgr5蛋白存在着空间分布的差异。那么Lgr5蛋白在结肠癌细胞内的表达部位是否会因为药物等因素干预后而出现平面分布的差异呢?这是不是阿司匹林防治结肠癌的又一种机制呢?本实验中,采用免疫组化检测各浓度阿司匹林作用Caco-2细胞 24 h后Lgr5蛋白在细胞内表达部位变化,结果显示Lgr5蛋白在人结肠癌Caco-2细胞中大量表达,主要位于细胞质,少数定位于细胞膜,而细胞核不着色。柴宁莉等[25]通过研究不同病理状态肠息肉中Lgr5蛋白的表达发现,Lgr5免疫组化阳性产物主要定位于细胞质中,这与本实验结果基本一致。5.0 mmol·L-1组中Lgr5蛋白亚细胞定位与对照组相同,估计是由于作用时间不够长或者药物浓度不高,还不足以导致Lgr5蛋白的表达部位发生变化。随着阿司匹林药物浓度提高,10.0 mmol·L-1组和15.0 mmol·L-1组可见Lgr5蛋白亚细胞定位发生了改变,除了细胞膜、细胞质有表达外,细胞核也有表达。由此,本实验结果表明,阿司匹林能够影响Lgr5蛋白的细胞内表达部位的改变,且与阿司匹林浓度有关。柴宁莉等[25]研究还显示了Lgr5蛋白在正常黏膜细胞核和细胞膜几乎不表达,但在Lgr5蛋白强表达的腺瘤和肠癌中,细胞膜也有一定的表达,表明了Lgr5的细胞中表达部位与肠息肉的病理状态有关,就这一点,该实验结果再次印证了本实验结果。谭晓冬等[26]通过利用免疫细胞化学方法确定PC-1.0和PC-1细胞中Tjp-2的细胞内定位变化的研究,结果表明 Tjp-2蛋白的细胞内定位变化参与调控胰腺癌细胞解离,就此推测阿司匹林可能通过影响肿瘤干细胞标志物Lgr5的细胞内定位变化以达到防治结肠癌的作用。
综上所述,本研究结果表明,阿司匹林能够降低结肠癌细胞株Caco-2中Lgr5基因表达,同时影响Lgr5蛋白的亚细胞定位,从而抑制了肿瘤干细胞增殖,以实现防治结肠癌的作用,表明Lgr5可作为抗结肠癌靶向治疗的潜在新靶点。然而阿司匹林对COX-2不同程度表达的结肠癌细胞株中的Lgr5均有抑制作用,表明了阿司匹林防治结肠癌的进一步机制主要涉及非COX-2途径。关于肿瘤干细胞标志物Lgr5与非COX-2途径的具体关联还尚不明确。此外,阿司匹林通过何种机制影响了Lgr5的细胞内定位变化,这些都需进一步深入研究。
