人类免疫缺陷病毒整合酶链转移抑制新药
——卡波拉韦及其复方长效注射液
2021-07-29陈本川
陈本川
(湖北省医药工业研究院有限公司,武汉 430061)
世界卫生组织在2020年世界艾滋病日的前夕发布公告[1]指出:侵袭人体免疫系统的病原体,导致人类产生获得性免疫缺陷综合征,即俗称艾滋病(AIDS)的病原体:人类免疫缺陷病毒(human immuno-deficiency virus,HIV),自1981年被确认至今,已夺走了近3300万人的生命。HIV是严重危害人类身体健康和生命的病毒性传染病的病原体,也是全球社会主要的公共卫生问题。为应对AIDS的传播,国际社会作出了协调一致的努力,服务范围不断扩大。全世界医药工作者也奋力拼搏,潜心研究,已获得6大类抗HIV新药:HIV核苷、核苷酸类逆转录酶抑制药(NRTI)、非核苷类逆转录酶抑制药(NNRTI)、HIV 蛋白酶抑制药(protease inhibitors,PI)、整合酶链转移抑制药(integrase strand transfer inhibitor,INSTI)、CD4细胞融合酶抑制药和CCR5受体拮抗药;以及由6大类抑制药组合成50多种单方或复方抑制药。有利于开展“高效抗逆转录病毒治疗”( highly active anti-retroviral therapy,HAART),俗称鸡尾酒疗法( cocktail therapy)。此外,在有效预防、诊断、治疗和护理HIV感染及其伴随的机会感染的措施也越来越多,HIV感染及其AIDS已从一种致死性传染病转变为可控、可治的慢性传染性疾病,使HIV携带者能够过上普通人的生活。联合国艾滋病联合规划署(joint united nations programme on HIV/AIDS,UNAIDS)于2015 年9 月,在美国召开的第七十届联合国大会上通过的《2030年可持续发展议程》,提出“2030 年终结HIV感染”。为实现此项愿景,UNAIDS力推“90-90-90” AIDS防治目标。即:到2020年,诊断发现并知晓自身感染状况的感染者和患者比例达到90%以上;符合治疗条件的感染者和患者接受抗逆转录病毒(antiretroviral,ARV)药治疗的比例达到90%以上;接受抗ARV治疗的感染者和患者治疗成功率达到90%以上。UNAIDS希望到2030年,上述“90-90-90”目标分别提高到“95-95-95”,终止AIDS流行的愿景。实现这一宏大愿景,意味着AIDS不再是全球重大社会公共卫生威胁。2019年7月16日UNAIDS发布一份新报告指出,减少HIV新发感染、提升治疗可及性和终结AIDS相关死亡的进展速度正在放缓。有些国家取得了令人瞩目的成果,而另一些国家却面临着HIV新发感染和AIDS相关死亡人数攀升的威胁。急需更多政治领导力来终结AIDS。首先,要有充足的资金投入,充分满足防控药物的可及性。终结AIDS,应关注人,而非疾病本身,要为滞后的人群和地区制定路线图,采取基于人权的方式覆盖到那些受AIDS影响最严重的人们。关键人群及其性伴侣占全球新增HIV感染人数达半数以上,约54%。据WHO报告,截至2019年底,估计全球还有3800万人感染HIV。而新感染病例全球约有170万人。“90-90-90”目标的进展在不同地区和国家差异迥然。再加上2019年末爆发新型冠状病毒肺炎(COVID-19)在全球蔓延,至今尚无终止的迹象,影响2020年“90-90-90”的阶段目标和2030年终止AIDS愿景的实施。UNAIDS呼吁全世界各国领导者、医药科技工作者和各行各业的有识之士为实现此项远大的愿景,各尽所能付出应有的贡献,尽可能募捐基金,提供医疗用品的可及性。对从事新药研发和研究的医药工作者,在前期取得成绩的基础上,应再接再厉,积极研发预防疫苗,开发高效低毒新型的抗ARV药物,着眼于长效、低耐药性和价廉的抗HIV新品种,使广大患者减少用药量,减轻经济负担。在已开发的6大类新药中,HIV整合酶链转移抑制药是最有潜力的品种之一,人体细胞中无相应的整合酶,HIV整合酶抑制药在HIV复制过程中,能阻断催化病毒DNA与宿主染色体DNA的整合,减轻新药研发的干扰,成为抑制HIV的新靶点。截至2020年已批准上市有4个品种;①拉替拉韦钾(raltegravir potassium,RAL)美国默克公司(2007);②唉替拉韦(elvitegravir,EVG),美国Gilead公司(2012);③多替拉韦钠(dolutegravir sodium,DTG),美国Gilead公司(2013);④比克拉韦钠(bictegravir sodium,BIC),美国Gilead公司(2018)。HIV整合酶抑制药单药使用疗效不佳,易产生耐药株,与其他抗ARV联用或组成2~4种药复方制剂,呈现出很强的抗ARV活性[1-2]。
由英国葛兰素史克公司控股,美国辉瑞大药厂和日本盐野义制药公司持股的ViiV医疗保健公司是一家专门从事抗HIV/AIDS新药研发的公司。近期推出了HIV整合酶抑制药(cabotegravir)及与美国强生制药公司的非核苷类逆转录酶抑制药利匹韦林(rilpivirine,RPV)组合成为长效复方制剂。每月或隔月肌内注射CAV和RPV一次悬浮缓释注射液,能达到长效抑制HIV复制的疗效。Cabotegravir暂译名为卡波拉韦,亦译为卡博拉韦、卡博特罗、卡波特格雷韦等。英文化学名为N-((2,4-difluorophenyl) methyl)-6-hydroxy-3-methyl-5,7-dioxo-2,3,5,7,11,11a-hexahydro(1,3)oxazolo[3,2-a]pyrido[1,2-d]pyrazine-8-carboxamide,中文化学名为N-((2,4-二氟苯基)甲基)-6-羟基-3-甲基-5,7-二氧代-2,3,5,7,11,11a-六氢(1,3)噁唑(3,2-a)并吡啶(1,2-d)并吡嗪8-甲酰胺。英文缩称CAV,代号GSK744。卡波拉韦有肌注缓释混悬注射液和片剂2种剂型。片剂的稳定成分是盐酸盐,商品名为Vocabria®,CAV片剂不能单药用于治疗HIV感染,只能作为检测和替补用药,适用于成人HIV感染者,经抗ARV药治疗后,RNA≤50拷贝(c.)·mL-1,且无治疗失败史,对CAV和RPV均无已知或怀疑耐药性,在肌内注射CAV和RPV 之前,用口服片剂评估注射液的耐药性,其次,在CAV和RPV注射治疗期间,错过一次注射给药时,用口服片剂补救。盐酸利匹韦林(rilpivirine hydrochloride)由美国强生制药公司属下的扬森制药公司研制,为非核苷类逆转录酶抑制药,可单用或其与其他抗ARV药联用,组成鸡尾酒疗法。2011年5月20日美国FDA批准上市。商品名edurant®,只有一种含25 mg碱基片的剂型,英文化学名为4-((4-((4-[(E)-2-cyanoethenyl]-2,6-)-2-dimethylphenyl)amino)2-Pyrimidinyl)amino)benzonitrile monohydrochloride,英文缩称RPV。中文化学名为4-((4-((4-[(E)-2-氰乙烯基]-2,6-)-2-[二甲苯基]氨基)2-嘧啶基)氨基)苯甲腈单盐酸盐。美国FDA已批准3种复方制剂:complera®(2011)、odefsey®(2016)和juluca®(2017)。2021年美国和欧盟相继批准上市的CAV悬浮缓释肌内注射液与RPV悬浮缓释肌内注射液共包装联用的长效制剂,属于第4种复方制剂。商品名vocabria®,该复方新制剂预防HIV感染的活性比恩曲他滨(FTC)与替诺福韦二吡呋酯(TDF)的二元复方抑制剂(商品名Truvada®)的有效性高89%,95%CI(68,96)%。2019年7月3日和2019年7月30日ViiV公司分别向美国食品药品管理局(FDA)和欧洲药品管理局(EMA)提出每月注射一次的复方新药上市申请(new drug application,NDA)。2020年1月10日该公司收到FDA长效复方制剂的完整回复函,2020年11月18日获得FDA突破性的治疗指定,给以优先评审的待遇。2020年10月21日欧洲、中东、非洲三地区(EMEA)人用药品委员会(committee for medicinal products for huma,CHMP)对于复方长效制剂给予积极评价,建议批准上市。2021年1月13日和2021年1月21日,首款长效注射治疗HIV感染新药分别被美国和欧盟批准上市。商品名均为Vocabria®。此前,加拿大卫生厅于2020年9月9日首先批准上市。2021年2月24日,ViiV公司向美国FDA提交补充新药申请(sNDA),扩大长效复方制剂的使用范围,允许隔月肌内注射CAV和RPV一次,以稳定的方案治疗病毒学抑制的成年人HIV感染。批准上市日期尚待定[3-7]。
1 非临床药理毒理学[3-7]
1.1致畸、致突变 为期2年对CAV对进行小鼠和大鼠的致癌性实验。按血浆药物浓度-时间曲线下面积(AUC)估算,分别给雄、雌小鼠喂饲推荐人用剂量(recommended human dose,RHD) 8倍和7倍时,未观察到小鼠接触CAV后肿瘤发生率随服药量升高而上升;给大鼠喂饲为推荐约为RHD 的26倍,也未出现与药物相关肿瘤发生率的上升。CAV无基因毒性,体外细菌逆向回复突变实验、小鼠淋巴瘤染色体畸变实验和啮齿动物体内微核试验均为阴性。
1.2对生殖能力的影响 按AUC估算,雄大鼠接触CAV超过RHD的20倍,雌大鼠接触量超过28倍,均未观察到大鼠对生育能力的影响。
2 临床药理毒理学[3-7]
2.1作用机制[3-7]①CAV通过与整合酶活性位点结合,阻断ARV脱氧核糖核酸(DNA)整合链转移步骤,达到抑制HIV整合酶的作用,这是HIV复制周期必需的步骤。用纯化的重组HIV-1整合酶进行链转移试验,CAV抑制整合酶链转移的50%浓度(IC50)均值为3.0 nmol·L-1;②RPV是HIV-1的二芳基嘧啶NNRTI,通过非竞争性抑制HIV-1逆转录酶(RT),抑制HIV-1的复制。RPV不抑制人细胞的DNA聚合酶α、β和γ。
2.2药效学[3-7]
2.2.1细胞培养内抗HIV的活性 ①CAV在人外周血单核细胞系(peripheral blood mononuclear cell,PBMCs)和人肾上皮293细胞系中,对HIV-1实验室病毒株B亚型(n=4)有抗HIV-1活性,抑制50%有效浓度(EC50)均值为0.22~1.7 nmol·L-1。CAV在PBMC细胞系中,对24株临床分离株,包括(HIV-1A、B、C、D、E、F和G亚型及M组各3株,O组3株)也有HIV-1活性,EC50均值为0.19 nmol·L-1(范围:0.02~1.06 nmol·L-1,n=24)。对B亚型临床分离株的EC50为0.05 nmol·L-1(范围为0.02~0.50 nmol·L-1,n=3)。对临床的HIV-2分离株,EC50中位数为0.12 nmol·L-1(范围:0.10~0.14 nmol·L-1,n=4)。
②RPV对原发性广泛的HIV-1分离株,包括M组(a、B、C、D、F、G和H亚型)有抗HIV-1活性,其EC50在0.07~1.01 nmol·L-1(0.03~0.37 ng·mL-1)之间,而且对O组原发性分离株的EC50值在2.88~8.45 nmol·L-1(1.06~3.10 ng·L-1)之间。
2.2.2细胞培养内抗HIV药之间的拮抗作用 ①CAV在细胞培养内,与NNRTI的利匹韦林或NRTI的恩曲他滨(emtricitabine)、拉米夫定(lamivudine)或替诺福韦二吡呋酯(tenofovir disoproxil fumarate)联用无拮抗作用。
②RPV在细胞培养内,与NNRTI的依非韦伦(efavirenz)、依曲韦林(etravirine)或奈韦拉平(nevirapine);NRTIs的去羟肌酐(didanosine)、恩曲他滨(emtricitabine)、阿巴卡韦(abacavir)、拉米夫定(lamivudine)、司他夫定(stavudine,)、替诺福韦二吡呋酯(TFV DP)或齐多夫定(zidovudine);安普那韦(amprenavir)、硫酸阿扎那韦(atazanavir sulfate)、达如那韦(darunavir)、茚地那韦(indinavir)、洛匹那韦(lopinavir)、奈非那韦(nelfinavir)、利托那韦(ritonavir),沙喹那韦(saquinavir)或替拉那韦(tipranavir);CD4细胞融合抑制剂恩夫韦肽(enfuvirtide);CCR5受体拮抗药马拉韦罗(maraviroc);或HIVINSTI拉替拉韦(raltegravir)等都无拮抗作用。
2.2.3在细胞培养内培育抗HIV药病毒的耐药株 ①CAV用人淋巴瘤细胞系(MT-2)使HIV-1ⅢB病毒株连续传代,筛选CAV对HIV整合酶的耐药病毒株,发现整合酶出现氨基酸取代,CAV对HIV的易感性降低,Q146L氨基酸取代,活性降为原来的0.217%~0.769%;S153Y取代,活性降为原来的0.119%~0.357%;I162M取代,活性降为原来的0.357%。HIV整合酶发生单一氨基酸T124A取代,活性降为原来的0.135%~0.909%。若同时发生T124A和S153Y双氨基酸取代,活性降为原来的0.152%~0.278%,T124A和I162M双取代,活性降为原来的活性降为原来的0.357%在细胞培养内,将携带带整合酶替代位点Q148H、Q148K或Q148R的病毒进行传代,获得C56S、V72I、L74M、V75A、T122N、E138K、G140S、G149A和M154I氨基酸取代耐药株,CAV对HIV敏感性从50%下降至24.4%。
②RPV用不同来源、不同亚型的野生型HIV-1和对NNRTI耐药的HIV-1筛选RPV的耐药株。经常出现氨基酸取代,对HIV敏感性降低,包括L100I、K101E、V106I和A、V108I、E138K和G、Q、R、V179F和I、Y181C和I、V189I、G190E、H221Y、F227C,以及M230I和L的RPV表型。
2.2.4临床试验分离耐药株 汇总代号FLAIR和ATLAS的Ⅲ期试验,出现7例(1.2%)患者经CAV联用RPV后,病毒学失败,连续2次检测,HIV-1 RNA≥200 c·mL-1,与抗ARV疗法的结果相似。7个病例中,有6例出现基线后耐药性数据,相关的氨基酸取代为K101E、V108I、E138A、E138K或H221H/L;其中5例对HIV表型敏感性下降低至原来的0.141%~0.417%。此外,6例CAV与RPV联用的患者,有4例(66.7%)病毒学失败,出现与INSTI耐药相关的氨基酸取代,Q148R(n=2),CAV对HIV耐药表型的敏感性分别下降至原来的0.20%和0.11%,G140R取代(n=1),下降至原来的0.143%,N155H取代(n=1),下降至原来的33.3%。
2.2.5交叉耐药性 临床试验研究所已观察到CAV与RPV之间存在交叉耐药性。CAV对重组HIV-1株NL432敏感性下降至<20.0%,重组病毒含有:G118R、Q148K、Q148R、T66K+L74M、E92Q+N155H、E138A+Q148R、E138K+Q148K/R、G140C+Q148R、G140S+Q148H/K/R、Y143H+N155H和Q148R+N155H等氨基酸替代物,范围在1.2%~19.6%之间。氨基酸取代更换为E138K+Q148K和Q148R+N155H,敏感性分别下降至1.2%和10.6%。
2.2.6心脏电生理学 ①CAV 每12 h口服CAV片剂150 mg,为每日推荐口服剂量的10倍,QT间期延长无任何临床意义。每12 h口服卡波拉韦3剂×150 mg,其Cmax几何均值分别约为推荐口服卡波拉韦30 mg在稳态时的2.8倍或每月推荐肌注卡波拉韦缓释混悬液注射400剂量几何均值的5.4倍。
②RPV 每天口服一次RPV25 mg的推荐剂量,QT间期延长无任何临床意义。每天一次服RPV 25 mg,Cmax稳态均值为247 ng·mL-1,比推荐每月肌内注射RPV缓释混悬注射液600 mg,在Cmax稳态的均值高1.7倍。成人健康受试者每天一次口服RPV 75 mg或300 mg。为推荐口服剂量的3倍或12倍,经基线和安慰剂调整后,QTcF间期的延长时间最大均值的95%置信上限差异分别为10.7 ms,95%CI(15.3)% ms,和23.3 ms,95%CI(28.4)%ms。每天一次,口服RPV 75 mg和RPV 300 mg,在稳态Cmax均值约为推荐剂量的4.4倍和11.6倍,也高于每月肌注RPV缓释混悬液600 mg的稳态的Cmax。与推荐的口服RPV剂比较,相应的Cmax比值分别为2.6和6.7倍。
2.3药动学[3-7]
2.3.1治疗开始前为期1个月的药物导入期 ①吸收 CAV:单次口服CAV 30 mg(1片),达到Cmax的中位时间Tmax为7 d,进食高脂餐服药,与空腹比较,AUC(0-inf) 几何均值比与90%置信限为1.14,90%CI(1.02,1.28)%。RPV:为期1个月的药物导入期,单次口服1片RPV 25 mg,达到Cmax的中位时间tmax为3~4 d,进食高脂餐服药,与空腹比较,AUC(0-inf),几何均值比与90%置信限为1.72,90%CI(1.36,2.16)%。
②分布 CAV:>99.8%;血与血浆的比值为0.52;脑脊液与血浆浓度比值的中位数及范围为0.003,范围为(0.002~0.004)。RPV:与人血浆蛋白的结合率为99.7%;血与血浆的比值为0.7;脑脊液与血浆浓度比值的中位数为0.01,范围为低于定量下限(BLQ)~0.02。
③消除 CAV:半衰期(t1/2)均值为5.6~11.5周。RPV:半衰期(t1/2)均值为13~28周。
④代谢 CAV:代谢途径主要为UGT1A1酶,少量为UGT1A9酶。RPV:RPV代谢途径主要为CYP3A酶。
⑤排泄 CAV:主要经代谢排泄,带14C放射性总量的27%从尿液排泄,无原形药;59%从粪便排泄,47%为原型药。RPV:主要经代谢排泄,带14C放射性总量的6%从尿液排泄,原形药<1%;85%从粪便排泄,47%为原型药。
2.3.2药物导入期结束后首次用药及每月治疗的药动学参数 ①CAB 导入期口服CAB 30 mg,每天一次,达到稳态时,AUC0-tau几何均值为145(1125,3748)μg·h·mL-1、Cmax=8.0(5.3,11.9) μg·mL-1和间隔24 hCtau=4.6(2.8,7.5) μg·mL-1;初始注射剂量,皮下注射RPV600 mg,达到稳态时,AUC0-tau几何均值为1591(714,3245) μg·mL-1、Cmax=8.0(5.3,11.9) μg·mL-1和间隔24小时Ctau=1.5(0.65,2.9) μg·mL-1;每月治疗剂量为皮下注射RPV400 mg,每月一次,达到稳态时,AUC0-tau几何均值为2415(1494,3645) μg·h·mL-1、Cmax=4.2(2.5,6.5) μg ·mL-1和间隔24小时Ctau=2.8(1.7,4.6) μg。
②RPV 导入期口服RPV 25 mg,每天一次,达到稳态时,AUC0-tau几何均值为2 083(1 125,3 748) μg·h·mL-1、Cmax=116(48.6,244 ng·mL-1和隔24小时Ctau=78.9(32.2,180) ng·mL-1;初始注射剂量,皮下注射RPV900 mg,达到稳态时,AUC0-tau几何均值为41 069(20 062,76 855) ng·h ·mL-1、Cmax=139(87.6,219) ng·mL-1和隔24小时Ctau=37.2(19.4,69.2);每月治疗剂量为皮下注射RPV600 mg,每月一次,达到稳态时,AUC0-tau几何均值为65 603(37 239,113 092) ng·h ·mL-1、Cmax=116(66.8,199) ng·mL-1和隔24小时Ctau=82.2(47.5,140) ng·mL-1。
3 临床试验
3.1临床试验概况 研发公司计划开展CAV治疗HIV 45批次,有3批数据不全或撤销试验,剩下42批纳入13 301例受试者,其中Ⅰ期临床22批75例;Ⅰ/Ⅱ期临床1批,155例;Ⅱ期临床,8批1109例;Ⅱ/Ⅲ期临床,1批,4570例,Ⅲ期临床8批,7067例,Ⅳ期临床1批325例。其中,CAV与RPV联用,13批,纳入4408例受试者;Ⅰ期临床3批86例;Ⅰ/Ⅱ期临1批,155例;Ⅱ期临3批,650例;Ⅲ期临床6批3517例。在美国FDA和欧盟批准上市之际,只剩下一批售后市场考察的四期临床尚在进行中,其余41批已全部完成临床试验。研发公司已在刊物公开发表七篇临床研究详细数据,受篇幅限制,只列举3篇有代表性的临床研究报告数据[3-7]。
3.1.1临床试验入选标准 ①签署知情同意书时,感染HIV-1,且未接受ARV治疗,年龄≥18岁的男、女患者。②由有经验的医生根据医疗评估,包括病史、体检、实验室检查和心脏监测等确定受试者健康状况。③女性受试者如具有生育潜力,必须同意在服用研究药物最后一剂后至少6个月内使用避孕措施,并了解药物浓度在服用末次剂量后最长1年内是可测量的。④有可能生育的女性患者的男性伴侣受试者必须同意使用方案中规定的避孕方法之一。⑤男性体质量≥50 kg,女性体质量≥45 kg,体质量指数(BMI)在18.5~31.0 kg·(m2)-1范围内。⑥丙氨酸氨基转移酶(ALT)、碱性磷酸酯酶和胆红素≤1.5倍正常上限(ULN),若胆红素分级,直接胆红素<35%,则可接受分离胆红素>1.5倍ULN。⑦用Bazett公式校正的QT间期(QTcB)<450 ms。筛选前12个月中至少两次血浆HIV-1 RNA测量值<50 c·mL-1[3-7]。
3.1.2临床试验排除标准 ①筛查后3个月内或研究前乙型肝炎病毒表面抗原或丙型肝炎病毒抗体呈阳性化。②有慢性肝病史,或已知肝脏或胆道异常(吉尔伯特综合征或无症状胆结石除外)。③研究前违禁药物或乙醇筛查呈阳性。④人体免疫缺陷病毒(HIV)抗体检测呈阳性。⑤研究者认为可能干扰药物吸收、分布、新陈代谢或排泄或使参与者无法接受研究药物的任何状况。⑥充血性心衰、症状性心律不齐、心绞痛、冠状动脉搭桥术或经皮腔内冠状动脉成形术的病史及临床上重要的心血管疾病或重要的心脏病史。⑦在筛选前的6~12个月确认HIV抑制到<50 c·mL-1之后,任何血浆HIV-1 RNA测量值> 200 c·mL-1或2次或更多次血浆HIV-1 RNA测量值≥50 c·mL-1。⑧研究者的判断,有重大自杀风险的受试者[3-7]。
3.1.3临床疗效主要观察指标 用快照算法在48周时出现病毒学失败的受试者(HIV-1RNA≥50 c·mL-1,时限为 48周,病毒学失败的定义为经每4周1次肌内注射长效CAB和RPV的非劣抗病毒治疗方案,持续48周以上,通过随访分析窗口期内,最后进行的治疗中HIV-1 RNA测量。确定使用快照算法,在48周时出现受试者的HIV-1 RNA≥50 c·mL-1[3-7]。
3.1.4临床疗效次要观察指标 ①用快照算法在48周时出现HIV-1RNA <200 c·mL-1的受试者人数,时限为 48周。②确诊的病毒学衰竭(CVF)、HIV-1 RNA的绝对值、与基线值发生变化、CD4 +淋巴细胞计数的绝对值与与基线值变化的受试者人数,时限为第8,12,20,24,32和40周。③疾病进展的受试者人数、患有严重不良事件(Non-SAE)、严重不良事件(SAE)、严重事件受试者的数量、血液学参数的绝对值、血液学参数的绝对值血液学参数从基线的变化的受试者数量,时限为:截至第48周。④第48周在内的一段时间内血液学参数的嗜碱性粒细胞、嗜酸性粒细胞、白细胞、淋巴细胞、嗜中性粒细胞、单核细胞和血小板、红细胞平均微粒体积、红细胞、血红蛋白、血细胞比容、嗜碱性粒细胞、嗜酸性粒细胞、白细胞、淋巴细胞、嗜中性粒细胞、单核细胞、血小板、红细胞平均微粒体积、红细胞、血细胞比容、血红蛋白、ALT、碱性磷酸酶(ALP)、天冬氨酸氨基转移酶(AST)、肌酐激酶(CK)、白蛋白、胆红素、直接胆红素、肌酐、总二氧化碳(CO2)、氯化物、葡萄糖、磷酸盐、钾、钠、尿素、脂肪酶、肌酐清除率的绝对值,时限为基线(第1天)和第4,8,12,16,20,24,28,32,36,40,44和48周。⑤随时间变化的临床化学参数基线,包括第48周:ALT尿液分析ALP,AST,CK,尿液分析参数异常,氢尿酸(pH)值,白蛋白,胆红素,直接胆红素,肌酐,总CO2,氯化物,葡萄糖,磷酸盐,钾,钠,尿素,脂肪酶,肌酐清除率,空腹总胆固醇,HDL胆固醇,LDL胆固醇,甘油三酸酯和尿白蛋白与肌酐比值及尿蛋白与肌酐比值等及总胆固醇,HDL胆固醇,LDL胆固醇和甘油三酸酯。时限为基准第1天及第4,8,12,16,20,24,28,32,36,40,44和48周。⑥CAB和RPV血浆谷浓度,AUC,(Cmax),时限为第4,8,12,16,20,24,28,32,36,40,44,48周的给药前及给药后1周的第5和41周。⑦使用基线第3种药物加强治疗发生ALT、ALP、AST、CK、白蛋白、胆红素、直接胆红素、肌酐、肌酐清除率、脂肪酶、甘油三酸酯、总胆固醇、HDL胆固醇和LDL胆固醇及CO2、氯化物、葡萄糖、磷酸盐、钾、钠和尿素基线参数值,时限为基线(第1天)及第4,8,12,16,20,24,28,32,36,40,44和48周。⑧极度疼痛或可接受的疼痛及局部反应受试者百分比,时限为第5,41和48周。⑨HIVTSQc 12项问卷量表,对受试者调查治疗的满意度,时限为基线和第4,24和44周[3-7]。
3.2临床试验一 临床试验NCT02951052是一项开放标签、随机、多中心,平行组,对经6个月接受标准口服ARV药物治疗,血浆HIV-1 RNA浓度≤50 c·mL-1的受试者比较ARV治疗或改肌注HIV-1INSTI卡波拉韦(CAV)联用RPV非劣效性的Ⅲ期试验。招募705例受试者,经筛查,618例符合入选条件,进入随机分组,其中,2例不参与治疗,616例按(1:1)随机分为A组(n=308)接受长效治疗,包括意向治疗人群;B组(n=308)继续原来ARV治疗,也包括意向治疗人群。疗程52周。A组前4周为治疗导入期,口服CAV联用RPV,后44周为治疗期,肌注CAV和RPV长效混悬颗粒注射液,每隔4周1次。两组在第52周至96周是延伸阶段或向代号ATLAS-2M临床试验过渡,评价疗效[3-5,7-8]。
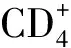
3.2.2临床疗效评价主要观察指标 第48周的疗效结果,可评价病例数:A组(n=308),B组(n=308)。两组HIV-1 RNA水平,差距及95% 置信限和Cochran-Mantel-Haenszel分层分析,调整出生性别及基线时服第三种药物的种类(PI,NNRTI或INSTI)得出两组HIV-1 RNA水平差距及95% 置信限。①意向治疗人群HIV-1 RNA <50 c·mL-1为285例(92.5%)和294例(95.5%),差距为-2.9%,95%CI(-6.7,0.8)%和调整后差距为-3.0%,95%CI(-6.7,0.7)%。A组与B组比较,为非劣性。②按协议治疗人群:HIV-1 RNA水平<50 c·mL-1A组为276/294例(93.9%)和B组为280/292例(95.9)%,差距为-2.0,95%CI(-5.6,1.6)%,调整后差距为-2.0,95%CI(-5.6,1.5)%和≥50 c·mL-1为4/294例(1.4%)和3/292例(1.0%),差距为0.3,95%CI(-1.4,2.1)%,调整后差距为0.3%,95%CI(-1.4,2.1)%[3-5,7-8]。
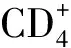
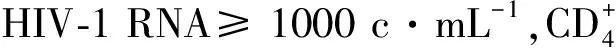
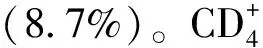
3.3.2临床疗效评价主要观察指标 第48周的疗效结果,可评价病例数:A组(n=283),B组(n=283)。各组受试者的HIV-1 RNA水平参数,两组差距及95%置信限和用Cochran-Mantel-Haenszel分层分析,调整出生性别及诱导治疗前的基线,两组HIV-1 RNA水平差距及95% 置信限。①意向治疗人群HIV-1 RNA ≤50 c·mL-1为265例(93.6%)和264例(93.3%),差距为0.4%,95%CI(-3.7,4.4)%,调整后的差距为0.4%,95%CI(-3.7,4.5)%。A组与B组比较,为非劣性。②按方案治疗的人群,HIV-1 RNA 水平 ≤50 c·mL-1,为260/278例(93.5%)和263/282例(93.3%),差距为0.3%,95%CI(-3.9,4.4)%,调整后的差距为0.3%,95%CI(-3.8,4.4)%;≥50 c·mL-1,为6/278例(2.2%)和7/282例(2.5%),差距为-0.3%,95%CI(-2.8,2.2)%,和调整后的差距为-0.3%,95%CI(-2.8,2.2)%[7,9]。
3.3.3临床疗效评价次要与其他观察指标 可评价病例数:A组(n=283),B组(n=283)。①HIV-1 RNA水平≤50 c·mL-1为5例(1.8%)和3例(1.1%),差距为0.7%,95%CI(-1.1,2.4)%;调整后的差距为0.6%,95%CI(-1.2,2.5)%。HIV-1 RNA水平不低于阈值为2例(0.7%)和2例(0.7%);缺乏疗效停止治疗为4例[1.412(4.2) 12(4.2)]和3例(1.1%);其他原因停止治疗为1例(0.3%)和0%。②无病毒学数据为12例(4.2%)和12例(4.2%);因不良事件退出试验为8例(2.8%)和2例(0.7%);因其他原因退出试验为4例(1.4%)和10例(3.5%)。③HIV-1 RNA水平≥50 c·mL-1的亚组分析:女性为3/63例(4.8%)和1/64例(1.6%),差距为3.2%,95%CI(-4.3,12.0)%;男性为3/220例(1.4%)和6/219例(2.7%),差距为-1.4,95%CI(-4.7,1.6)%。④基线HIV-1 RNA水平<100 000 c·mL-1为4/227例(1.8%)和5/227例(2.2%),差距为-0.4%,95%CI(-3.6,2.5)%;≥100 000 c·mL-1为2/56例(3.6%)和2/56例(3.6%),差距为0%,95%CI(-9.2,9.2)%[7,9]。
3.4临床试验三 代号ATLAS-2M,临床试验编号NCT03299049是一项随机、跨国多中心、开放标签的Ⅲb期临床试验,比较肌内注射CAV联用RPV长效维持治疗的非劣效性研究:招募1149例受试者,经筛查,1049例入选临床试验,所入选的受试者来自两部分,第一组由新招募的未经治疗的受试者组成,需接受口服ARV治疗方案。第二组参与代号ATLAS试验研究,每4周接受CAV和RPV长效肌内注射治疗和标准护理组。所有受试者的血浆HIV-1 RNA≤50 c·mL-1,按1:1随机分组,A组(n=522),B组(n=523)。A组每8周肌内注射1次(CAV 600 mg 加注RPV 900 mg),B组每4周肌内注射1次(CAV 400 mg加注RPV 600 mg),治疗48周,评价主要疗效为非劣效性。延伸治疗至第100周[7,10]。
3.4.2临床疗效评价主要观察指标 第48周的疗效结果,可评价病例数:A组(n=522),B组(n=523)各组受试者的HIV-1 RNA水平参数,两组差距及95%置信限和用Cochran-Mantel-Haenszel分层分析,调整出生性别及诱导治疗前的基线,两组HIV-1 RNA水平差距及95%置信限。①意向治疗人群HIV-1 RNA≤50 c·mL-1,为492例(94.3%)和489例(93.5%),差距为0.8%,95%CI(-2.2,3.7)%,调整后的差距为0.8%,95%CI(-2.1,3.7)%。A组与B组比较,为非劣性。②符合方案治疗的人群,HIV-1 RNA≤50 c·mL-1,为7/516例(1.4%)和5/514例(1.0%),差距为0.4%,95%CI(-0.9,1.7)%,调整后的差距为0.4%,95%CI(-0.9,1.7)%[7,10]。
3.4.3临床疗效评价次要与其他观察指标 可评价病例数:A组(n=522),B组(n=523)。①HIV-1 RNA>50 c·mL-1,总数9例(1.7%)和5例(1.0%),差距0.8%,95%CI(-0.6,2.2)%,调整后差距为0.8%,95%CI(-0.6,2.2)%;窗口期数据不低于阈值,为3例(0.6%)和2例(0.4%);因缺乏疗效而停药6例(1.4% )和2例(0.4%);因其他原因停药,但不低于阈值,为0%和1例(0.2%)。②无病毒学数据,总数为21例(4.2%)和29例(5.5%);因不良事件或死亡而停止试验为9例(1.7%)和13例(2.5%);因其他原因停止试验为12例(2.3%)和16例(3.1%)。③按方案分析:血浆HIV-1 RNA≥50 c·mL-1按方案分析为7/516例(1.4%)和5/514例(1.0%),差距0.4%,95%CI(-0.9,1.7)%,调整后差距0.4%,95%CI(-0.9,1.7)%;血浆HIV-1 RNA<50 c·mL-1,按方案分析为491/516例(95.2%)和484/514例(94.2%),差距1.0%,95%CI(-1.8,3.7)%,调整后差距1.0,95%CI(-1.7,3.7)%。④血浆HIV-1 RNA≥50 c·mL-1分层检验均匀性,之前接触CAV加用RPV的时间:0周为5/327例(1.5%)和5/327例(1.5%),差距0%,95%CI(-2.2,2.2)%;1~24周为3/69例(4.3%)和0/68例,差距4.3%,95%CI(-1.3,12.3)%;>24周为1/126例(0.8%)和0/128例(0%),差距0.8%,95%CI(-2.2,4.4)%。均匀性试验的P=0.35;血浆HIV-1 RNA<50 c·mL-1分层检验均匀性,之前接触CAV加用RPV的时间:0周为306/327例(93.6%)和300/327例(91.7%),差距1.8%,95%CI(-2.3,6.0)%;1~24周为66/69例(95.7%)和65/68(95.6%),差距0.1%,95%CI(-8.3,8.6)%;>24周为120/126例(95.2%)和124/128例(96.9%),差距-1.6(-7.4,3.7)%,均匀性试验的P=0.55[7,10]。
4 不良反应概况
研发公司开展CAV治疗HIV 42批次治疗HIV 感染的临床试验,其中包括与RPV联用临床试验13批次,并在刊物公开发表7份临床试验研究数及试验产生的不良事件,鉴于篇幅限制,临床试验数据及其所发生的不良事件只精选3批次进行介绍[3-5,7-8]。
4.1临床试验一 临床试验NCT02951052是一项开放标签、随机、多中心,平行组,对于血浆HIV-1 RNA浓度≤50 c·mL-1的受试者比较ARV治疗或改用肌内注射HIV-1INSTI CAV联用RPV的非劣效性的Ⅲ期试验。可评价的病例数:A组(n=308)接受长效治疗;B组(n=308)继续原来ARV治疗。疗程52周。不良事件按与试验方案: A组和B组的不良事件及与试验药物相关的A组和B组不良事件顺次列举:①与试验有关的不良事件:任何不良事件为294例(95.5%),220例(71.4%)和255例(82.8%),8例(2.6%)。3级或4级不良事件为35例(11.4%),23例(7.5%)和14例(4.5%),1例(0.3%)。不包括注射部位的3级或4级不良事件为25例(8.1%),23例(7.5%)和4例(1.3%),1例(0.3%)。不良事件导致撤销治疗为14例(4.5%),5例(1.6%)和10例(3.2%),1例(0.3%)。任何严重不良事件为13例(4.2%),14例(4.5%)和0例(0%),1例(0.3%)。致命性严重不良事件 0%,1例(0.3%)和0%,0%。不包括注射部位的任何不良事件为264例(85.7%),220例(71.4%)和88例(28.6%),8例(2.6%)。②注射部位不良事件:注射部位任何反应为250例(81.2%),0%和198例(64.3%),0%。注射部位疼痛为231例(75.0%),0%和186例(60.4%),0%。注射部位疼痛3级为10例(3.2%),0%和8例(2.6%),0%。注射部位疼痛导致撤销治疗为4例(1.3%),0%和4例(1.3%),0%。注射部位结节为37例(12.0%),0%和22例(7.1%),0%。注射部位硬化为30例(9.7%),0%和20(6.5%)。注射部位肿胀为23例(7.5%),0%和19例(6.2%)。③≥5%常见不良事件:鼻咽炎为52例(16.9%),42例(13.6%)和0%,1例(0.3%)。上呼吸道感染为32例(10.4%),25例(8.1%)和0%,0%。头痛为34例(11.0%),17%(5.5%)和11例(3.6%),0%。腹泻为22例(71%),15例(4.9%)和2例(0.6%),0%。背痛21例(7.1%),10例(3.2%)和2例(0.6%),0%。流感样疾病为17例(5.5%),14例(4.5%)和5例(1.3%),0%。咳嗽为16例(5.2%),14例(4.5%)和 0%,0%。发热为21例(6.8%),9例(2.9%)和11例(3.6%),0%。疲乏为22例(7.1%),6例(1.6%)和11例(3.6%),0%。病毒性呼吸道感染为11例(3.6%),17例(5.5%)和0%,0%[3-5,7-8]。
4.2临床试验二 临床试验编号为NCT02938520是一项随机、开标Ⅲ期临床试验,治疗成人HIV-Ⅰ感染者,诱导期服用20周多替拉韦、阿巴卡韦和拉米夫定三联ARV治疗,HIV-1 RNA≤50 c·mL-1,可评价的病例数:A组(n=283),前4周口服CAV加RPV,其后,每月1次,肌内注射CAV及RPV;B组(n=283)服用三联ARV治疗。两组于48周评价疗效。试验所发生的不良事件依次顺序列举:①病例不良反应事件:任何不良反应事件为267例(94.3%)和225例79.5%);除注射部位外任何不良反应事件为246例(86.9%)和225例(79.5%);≥3 级不良反应事件为31例(11.0%)和11例(3.9%);除注射部位外≥3 级不良反应事件为22例(7.8%)和11例(3.9%);不良反应事件导致撤销治疗为9例(3.2%)和4例(1.4%);严重不良反应事件为18例(6.4%)和12例(4.2%);与药物相关任何不良反应事件为236例(83.4%)和28例(9.9%);除注射部位外任何反应为79例(27.9%)和28例(9.9%);≥3级不良反应事件为14(4.9%)和0%;除注射部位外≥3级不良反应事件为4例(1.4%)和0%;注射部位任何疼痛为 227(80.2%)和不适用(not applicable,NA);注射部位疼痛≥3级为11例(3.9%)和NA;② ≥5%常见其他不良反应事件:除注射部位外为56例(19.8%)和48例(17.0%);头痛为39例(13.8%)和21例(7.4%);上呼吸道感染为38例(13.4%)和28例(9.9%);腹泻为32例(11.3%)和25例(8.8%);流感为25例(8.8%)和20例(7.1%);维生素D缺乏症为23例(8.1%)和13例(4.6%);背痛为22例(7.8%)和13例(4.6%);发热为22例(7.8%)和4例(1.4%);痔疮为16例(5.7%)和3例(1.1%);恶心为16例(5.7%)和11例(3.9%);眩晕为15例(5.3%)和3例(1.1%);胃肠炎为15例(5.3%)和11例(3.9%);咽炎为15例(5.3%)和9例(3.2%)[7,9]。
4.3临床试验三 代号ATLAS-2M,临床试验编号NCT03299049是一项随机、跨国多中心、开放标签的Ⅲb期临床试验,比较肌内注射CAV联用RPV长效维持治疗的非劣效性研究。可评价病例数,A组(n=522),B组(n=523)。A组每8周肌内注射1次(CAV 600 mg 加注RPV 900 mg),B组每4周肌内注射1次(CAV 400 mg加注RPV 600 mg),治疗48周。①任何不良事件:任何事件为473例(90.6%)和482例(92.2%);注射部位反应(injection site reaction,ISRs)为403例(77.2%)和441例(84.3%);因不良事件而中断用药,总计为12例(2.3%)和13例(2.5%);不包括ISRs为8例(1.5%)和10例(1.9%);因药物相关不良事件而中断用药,总计为8例(1.5%)和11例(2.1%);不包括ISRs为 5例(1.0%)和8例(1.5%);严重不良反应事件总数为27例(5.2%)和19例(3.6%);不包括ISRs为26例(5.0%)和19例(3%);不良事件分级:1~2级为432例(82.8%)和433例(82.8%);3级为38例(7.3%)和43例(8.2%);4级为2例(0.4%)和6例(1.1%);5级(死亡)为1例(0.2%)和0%。②实验室检测异常3~4级:ALT升高为2例(0.4%)和5例(1.0%);AST升高为3例(0.6%)和6例(1.1%);总胆红素升高为2例(0.4%)和2例(0.4%);三酰甘油升高为4例(0.8%)和4例(0.8%);总胆固醇升高为2例(0.4%)和3例(0.6%);低密度脂蛋白胆固醇升高为9例(1.7%)和4例(0.8%)。③常见≥5%非注射部位不良事件:鼻咽炎为71例(14%)和74例(14%);上呼吸道感染为50例(9.6%)和71例(13.6%);发热为28例(5.4%)和44例(8.4%);头痛为35例(6.7%)和36例(6.9%);腹泻为33例(6.3%)和37例(7.1%);背痛为28例(5.4%)和29例(5.5%);咳嗽为17例(2.6%)和29例(5.5%);疲乏为13例(2.5%)和33例(6.3%);胃肠炎为16例(3.1%)和28例(5.4%);咽炎为16例(3.1%)和28例(5.4%)。④受试者接受≥1次注射研究药物为(n=516)和(n=517):受试者发生ISR事件为392例(76.0%)和390例(75.4%);疼痛强度为轻度或1级为364例(70.5%)和362例(70.0%);中度或2级为140例(27.1%)和143例(27.7%);严重或≥3级为14例(2.7%)和21例(4.1%);严重ISR事件为1例(0.2%)和0%;因注射部位事件中断用药为6例(1.4%)和11例(2.1%)。⑤受试者报告≥5%ISRs事件:疼痛为371例(71.1%)和363例(69.4%);结节为54例(10.3%)和89例(17.0%);硬化为41例(7.9%)和39例(7.5%);不适为36例(6.9%)和41例(7.8%);肿胀为32例(6.1%)和27例(5.2%);瘙痒为27例(5.2%)和25(4.8%)[7,10]。
5 适应证
①CAV片适用于与RPV片联用,用于短期治疗成人HIV-1感染,患者经稳定的ARV治疗方案,病毒学受到抑制,HIV-1 RNA<50 c·mL-1,且无治疗失败史及已知或可疑的耐药性。CAV片辅助治疗作用可作为先导口服用药,评估CAV和RPV缓释注射悬液的耐受性;若计划中的肌内注射CAV联用RPV,错失一次剂量时,可用口服CAV和RPV治疗补纠措施[3-7]。
②CAV与RPV复方制剂Cabenuva®是HIV-1整合酶链转移抑制药(INSTI)卡波拉韦(CAV)和HIV-1非核苷类逆转录酶抑制药(NNRTI)利匹韦林(RPV)这2种药物共包装的产品,是完整的治疗成人HIV-1感染的方案,准备取代目前ARV治疗方案,可达到抑制HIV-1 RNA≤50 c·mL-1,无治疗失败史或并发症,对已知或疑似CAV或RPV无耐药性的稳定ARV治疗方案[3-7]。
6 剂量与服法
6.1剂型与规格[3-7]
6.1.1CAV片 只有一种剂型,为速释薄膜包衣片,每片含有效成分卡波拉韦30 mg,相当于稳定成分卡波拉韦钠31.62 mg。
6.1.2长效复方制剂(Cabenuva®) 是CAV与RPV复方制剂,CAV是注射用缓释混悬液,RPV是可注射缓释液悬浮液的共包装。有2种规格,其一,单剂量小瓶含CAV 400 mg·2 mL-1和单剂量小瓶含RPV 600 mg·2 mL-1;并带有Cabenuva®400 mg 和600 mg工具包:其二,单剂量小瓶含CAV 600 mg·3 mL-1(200 mg·mL-1)和单剂量小瓶含RPV 900 mg(RPV3 mg·mL-1)。带有Cabenuva®600 mg 或900 mg工具包。
6.2推荐剂量与用法[3-7]
6.2.1CAV单药用法 ①CAV片用于口服导入剂量,评估CAV耐受性。在开始肌内注射复方长效注射液前,应查清CAV和RPV缓释注射液处方信息,为确保使用注射液进行治疗的可行性,需要口服导入治疗约1个月(至少28 d),评估CAV耐受性。推荐剂量为口服CAV30 mg,每天一次,与一剂RPV 25 mg同服。末次口服应与开始肌内注射液同一天进行。每天大约在同一进餐时间与CAV和RPV一起同时服用。也应查阅RPV片信息。②口服CAV,取代计划错过的一次CAV和RPV注射,每月最多连续注射2次。每天大约在同一时间服用CAV和RPV片。第一次口服治疗应在最后一次注射复方注射剂约1个月后服用,并持续到重新开始注射的当天。
6.2.2长效复方制剂用法 ①开始肌内注射复方制剂前应引入口服CAV和RPV制剂,约1个月,以评估CAV和RPV的耐受性;②肌内注射复方注射剂仅用于臀肌内注射;③推荐给药计划为:开始注射长效复方注射剂,内含CAV 600 mg和RPV900 mg,其后,开始口服CAV25 mg和RPV 30 mg 为期1个月的导入疗法,在末次口服剂量后,继续肌内注射长效复方注射剂,剂量为CAV 400 mg和RPV600 mg。
7 禁忌证[3-7]
7.1CAV单一用药 既往对CAV过敏者;与尿苷二磷酸-葡萄糖醛酸转移酶诱导药(UDP-UGT-1A1-)同时联用,将使CAV血浆浓度显著降低,导致病毒学酶诱导反应丧失。
7.2长效复方注射用药 既往对CAV或RPV过敏反应者;与CAV显著降低活性的药物合用,和(或)对RPV的血浆浓度可能出现降低的药物联用,会导致病毒学应答丧失。
8 用药注意事项与警示[3-7]
8.1变态反应 服用其他整合酶抑制药曾发生重度或严重的变态反应,也可能会与口服CAV片或肌内注射其长效复方注射液有关。应保持警惕,若怀疑有变态反应,应停止用药。出现变态反应的迹象或症状,包括但不限于严重皮疹或伴有发热、全身不适、疲劳、肌肉或关节疼痛、水疱、口腔水疱、结膜炎、面部水肿、肝炎、嗜酸性粒细胞增多、血管性水肿、呼吸困难等临床状况,及肝转氨酶升高,应加强监测,适当治疗。采用肌内注射长效注射剂之前的口服给药,可帮助确定可能有心脏病风险的患者。
8.2肝毒性 口服CAV片或肌内注射其长效复方注射液,患者的基础肝病或治疗前有潜在肝病或转氨酶明显升高的患者,可能使转氨酶明显升高,增加肝病恶化或疾病发展的风险。建议对肝脏化学成分进行监测,若怀疑有肝毒性,应停止治疗。
8.3注射后反应 在临床试验中,肌内注射后几分钟内,报告出现严重的注射后反应,包括呼吸困难、躁动、腹部痉挛、潮红、出汗、口腔麻木及血压变化。这些事件发生率≤1%。注射后几分钟内发生这些事件可能与疏忽大意有关。准备使用肌内注射时,应遵循使用说明,避免意外静脉给药。注射后如患者出现注射后反应,应进行监测,按临床指示治疗。
8.4抑郁症 口服CAV片或肌内注射其长效复方注射液,患者会出现抑郁症状(包括抑郁、抑郁情绪、情绪改变、情绪波动、烦躁不安、消极想法、有自杀意念或企图自杀念头)。在服用CAV片或肌内注射其长效复方注射液时应评估抑郁症状,确定症状是否与用药有关,以确定继续治疗的风险是否大于益处。
8.5妊娠妇女用药 口服CAV片及肌内注射其长效复方注射药的数据缺乏,无法充分评估药物相关出生缺陷和流产风险。也无足够的数据评估孕期接触CAV导致神经管缺陷(neural tube defects,NTDs)的风险,而NTDs与另一种整合酶抑制药多替拉韦有关。有生育潜力的妇女或怀孕期间曾肌内注射其长效复方注射液,停药≥12个月,体循环中仍可检测到CAV和RPV。应考虑孕期胎儿潜在的药物接触。复方长效注射药含RPV,孕大鼠接触后曾出现出生缺陷。孕大鼠在产前和产后幼崽发育期,观察到喂饲CAV≥28倍的RHD,使分娩延迟,死产和新生幼崽死亡增加。在器官发育期,孕大鼠或孕兔喂饲CAV≥RHD,未观察不良发育结果。
8.6哺乳期妇女用药 目前尚不清楚口服CAV片或注射其长效复方注射液的成分是否存在于母乳的乳汁中,影响母乳分泌,或对母乳喂养婴儿的影响。正在泌乳的大鼠喂饲CAV片或注射其长效复方注射液,乳汁中存在有CAV或RPV。因HIV-1可能传播给HIV-阴性婴儿,HIV-阳性婴儿也可能发展病毒耐药性以及母乳喂养婴儿可能出现不良反应,建议母亲在接受口服CAV片或肌内注射其长效复方注射液治疗期间,不要用母乳喂养婴儿。
8.7老年患者用药 CAV片及其长效复方注射液的临床试验尚未包括足够数量≥65岁受试者,以确定其反应是否不同于较年轻受试者。一般而言,老年患者的肝、肾或心功能下降、伴随疾病或其他药物治疗,应慎用CAV片。
8.8肾损伤患者用药 根据口服CAV片和RPV药动学参数的研究,轻度、中度或严重肾损伤患者,肌酐清除率(Clcr≥15~<90 mL·min-1),无需调整口服CAV片及其长效复方注射液的剂量;终末期肾病患者(Clcr<15 mL·min-1)对CAV和RPV药动学参数的影响尚不清楚。CAV的蛋白结合率>99%,透析不会改变CAV的接触量。
8.9肝损伤患者用药 根据口服CAV和RPV的单独研究,轻度或中度肝损伤患者(Child-Pugh A级或B级)不必调整两者的剂量,严重肝损伤患者(Child-Pugh C级)对CAV或RPV药动学的影响尚未知。
9 知识产权状态与国内外研究进展
FDA给予美国Viiv医疗保健公司CAN片和长效缓释复方肌内混悬注射液排他性保护期至2026年1月21日期满。研发公司申请保护HIV整合酶链转移抑制新药卡波拉韦钠品种的2份美国专利US6838464和US7067522,已获授权,专利期至2021年2月26日期满,相应中国专利CN1416423也已授权,专利期同日期满。该公司申请保护CAN与RPV复方缓释混悬肌内注射液适应证的2份美国专利US7125879和US8080551,已授权,专利期至2025年4月21日期满,相应中国专利CN1541215、和CN101060844已授权,有2份分案申请专利CN102319433和CN104586850尚在实审中。研发公司申请保护HIV整合酶链转移抑制新药制备工艺的7份美国专利US8410103、US7858788、US8129385、US8778943、US9051337、US9273065和US10927129均已授权,专利期至2026年4月28日期满;相应中国专利CN101212903已授权,专利期与美国专利同日期满,分案申请的中国专利CN101346376已被公司撤回。葛兰素史克(中国)投资有限公司于2017年1月20日向国家药品监督管理局提出申请进口卡波拉韦片及复方缓释肌内混悬注射液进口注册证,分别于2020年11月30日和2021年2月25日批准临床验证,尚未在国家药物临床试验登记与信息公示平台报道已开始公示并开始临床试验。
