转人溶菌酶牛乳营养成分及食用安全研究
2021-07-16程静然宋荣荣戴蕴平赵春江
程静然 宋荣荣 戴蕴平 赵春江
摘要 [目的]探究转人溶菌酶牛乳和非转基因牛乳的营养成分差异,以及重组人溶菌酶的食用安全性。[方法]通过测定转基因和非转基因组2种乳样乳常规、氨基酸和脂肪酸的含量,比较其成分差异。通过大鼠、小鼠急性经口毒性试验以及模拟胃肠液消化稳定性试验检测重组人溶菌酶的食用安全性。[结果]营养成分检测结果表明,转人溶菌酶牛乳和非转基因牛乳相比,细菌总数偏高,脂肪含量偏低,其他营养成分无明显的变化;食品安全评估说明重组人溶菌酶属于实际无毒蛋白,且无潜在的致敏性。[结论]该试验验证了转人溶菌酶牛乳的食用安全性。
关键词 转基因牛;重组人溶菌酶;牛乳;营养成分;食用安全性
中图分类号 TS-201 文献标识码 A 文章编号 0517-6611(2021)11-0147-04
doi:10.3969/j.issn.0517-6611.2021.11.041
开放科学(资源服务)标识码(OSID):
Study on Nutritional Components and Edible Safety of Milk of Transgenic Cloned Cows Expressing Human Lysozyme
CHENG Jing-ran1, SONG Rong-rong1, DAI Yun-ping2 et al
( 1.College of Animal Science and Technology, China Agricultural University, Beijing 100193;2. College of Biology, China Agricultural University, Beijing 100193)
Abstract [Objective] To explore the nutritional differences between transgenic and non-transgenic milk and the food safety of recombinant human lysozyme.[Method] By measuring the contents of routine, amino acid and fatty acid of two kinds of milk, the difference in composition was compared. The food safety of recombinant human lysozyme was determined by acute oral toxicity test and simulated gastroenteric fluid digestion stability test in rats and mice.[Result]The results of nutritional component detection showed that compared with milk of non-transgenic cows, the milk of transgenic cows has larger number bacteria and lower fat content, but other nutrients have no significant change.Food safety assessment showed that recombinant human lysozyme was a non-toxic protein and had no potential sensitization. [Conclusion]This experiment verified the edible safety of recombinant human lysozyme.
Key words Transgenic cows;Recombinant human lysozyme;Milk;Nutritional components;Edible safety
人溶菌酶(lysozyme)是一種存在于人体正常体液及组织中的碱性多肽,由130个氨基酸组成,对生物体的自身防御起着重要作用[1]。人乳中溶菌酶的含量高、活性强,也是人乳不易败坏的主要原因。人乳中溶菌酶含量约0.5 mg/mL,比牛、绵羊和山羊乳含量高出1 500~4 000倍,破坏和溶解细菌的能力约为牛乳的300倍,是人乳中的重要抗菌因子,也是动物乳“人乳化”的主要研究对象。人乳中的溶菌酶可破坏大多数革兰氏阳性菌和少量阴性菌的细胞壁[2-3],有利于婴儿肠道正常菌群的建立和提高抗病能力。随着对奶制品消费需求的增加,奶制品的品质也越来越受到人们的关注。利用乳腺生物反应器的方法表达重组人溶菌酶,使生产出的奶含有高抑菌活性的溶菌酶,既有营养功能,又有药用功能[4]。随着对转基因动物的研究越来越广泛,人们越来越重视转基因制品的安全性。笔者以先前成功获得的转人溶菌酶基因奶牛为研究对象,通过与普通奶牛(非转基因牛)对照的方式,探明转基因牛乳与普通牛乳的营养成分及代谢组差异,并对重组人溶菌酶进行了毒理学试验,进一步探究重组人溶菌酶的安全性。
1 材料与方法
1.1 材料
乳样采集自中国农业大学试验基地的1头转人溶菌酶奶牛和3头非转基因奶牛。重组人溶菌酶由转基因奶牛乳中纯化得到。
1.2 方法
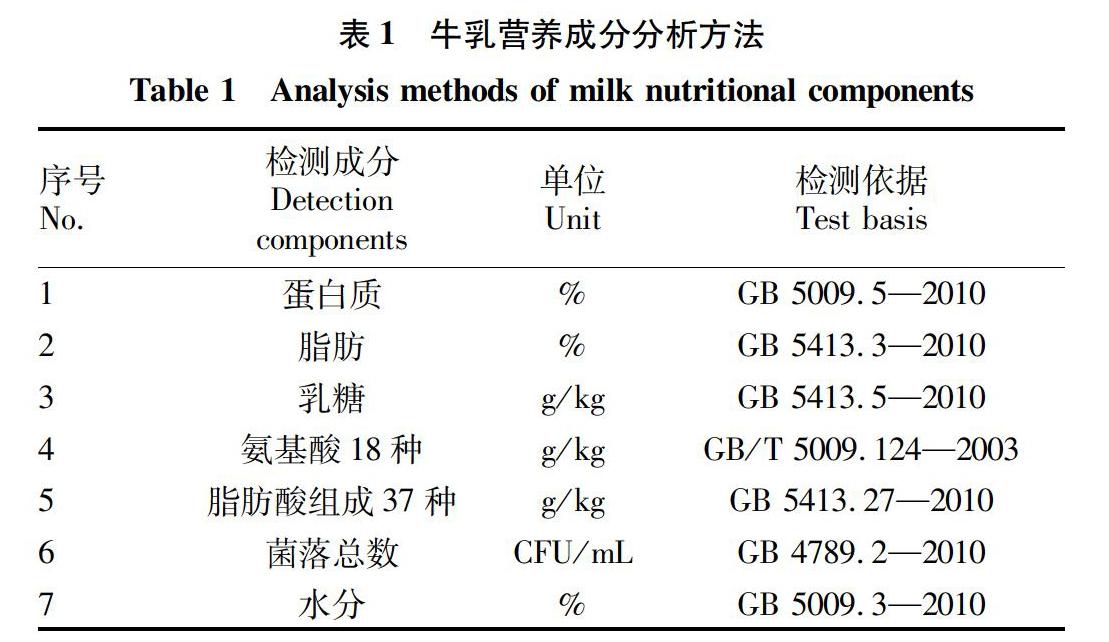
1.2.1 牛乳营养成分分析。牛乳营养成分分析方法见表1。
1.2.2 牛乳代谢组。
乳样离心(4 ℃,3 000 r/min,5 min),弃沉淀。上清液离心(4 ℃,12 000 r/min,15 min),弃沉淀,重复3次。吸取100 μL上清液,加入新的1.5 mL EP管中,并加入350 μL预冷甲醇。加入10 μL核糖醇,漩涡30 s,冰水浴5 min,离心(4 ℃,12 000 r/min,15 min)。将上清液在真空压缩器中干燥,将80 μL氧胺盐试剂加入干燥后的代谢物中,搅拌混匀,在80 ℃烘箱中孵育30 min。加入100 μL BSTFA,70 ℃进行孵育1.5 h,随机顺序上机检测。结合数据库LECO-Fiehn-Rtx5,通过ChromaTOF(v4.3x,LECO)软件对质谱数据进行分析。
1.2.3 重组人溶菌酶急性经口毒性试验。
1.2.3.1 大鼠急性经口毒性试验。
依据《食品安全国家标准急性经口毒性试验》(GB 15193.3—2014)进行重组人溶菌酶的大鼠经口毒性试验。依据预试验的结果并且以霍恩氏法进行试验设计,共设计4个剂量组,剂量分别为2 150、4 640、10 000和21 500 mg/kg。按照体重随机二步法对大鼠进行分组,雌、雌大鼠各2组,每组各10只大鼠。
在灌胃之前,大鼠需要进行16 h禁食,饮水自由。重组溶菌酶灌胃大鼠时,需要分2次进行,间隔时间为4 h,之后再进行3 h禁食,连续进行14 d的观察。重组人溶菌酶灌胃大鼠之后,需要对大鼠的临床情况进行观察和记录(如中毒情况、死亡情况等),观察终点为灌胃后第14天。观察期间,及时对死亡大鼠进行尸体解剖及组织病理学检查。试验终点后,对所有试验大鼠进行脱颈椎处死,并进行全身解剖进行组织病理学检查。
试验结束时统计不同性别大鼠的存活数量、中毒症状的严重程度和可逆性、死亡、存活及解剖检查中各种病变的发生频率。分别计算上述各因素的发生率和灌胃第0、7、14天的平均体重和标准差。
1.2.3.2 小鼠急性经口毒性试验。
依据《食品安全国家标准急性经口毒性试验》(GB 15193.3—2014)进行重组人溶菌酶的小鼠经口毒性试验。依据预试验结果并且以霍恩氏法进行试验设计,共设计4个剂量组,剂量分别为4 640、10 000、21 500和46 400 mg/kg。按照体重随机二步法将小鼠进行分组,雌、雌小鼠各2组,每2组各10只小鼠。在灌胃之前,小鼠需要进行6 h禁食,饮水自由。4 640、10 000、21 500 mg/kg剂量组一次性灌胃小鼠,46 400 mg/kg剂量组分2次灌胃小鼠,间隔时间为4 h,之后再进行1 h禁食,连续进行14 d的观察。
观察、记录和统计方法同“1.2.3.1”。
1.2.4 重组人溶菌酶模拟胃肠液消化稳定性试验。
依据《转基因生物及其产品食用安全性检测模拟胃肠液外源蛋白质消化稳定性试验方法》(农业部869号公告-2-2007)进行试验。
按照 19∶1(V/V)的比例将模拟胃(肠)液与重组溶菌酶样品溶液(对照样品或受试蛋白)进行混合,并且进行快速旋涡振荡混匀,在37 ℃下进行水浴并准确计时。分别在0、15 s和2、30、60 min时,迅速转移200 μL反应液至1.5 mL离心管(含有碳酸氢钠溶液)中。再加蛋白上样缓冲液70 μL,进行5 min沸水浴,在室温下冷却,进行SDS-PAGE电泳,将电泳后的凝胶进行考马斯蓝染色,脱色,待条带变清晰,取出凝胶并对图像进行保存。分别用模拟的胃、肠液对样品进行消化,消化后的蛋白进行电泳,然后进行蛋白印迹,并保存图像。
2 结果与分析
2.1 牛乳营养成分分析
转人溶菌酶牛乳营养成分测定主要包括乳常规、16种氨基酸、25种脂肪酸的测定。
2.1.1 乳常规。
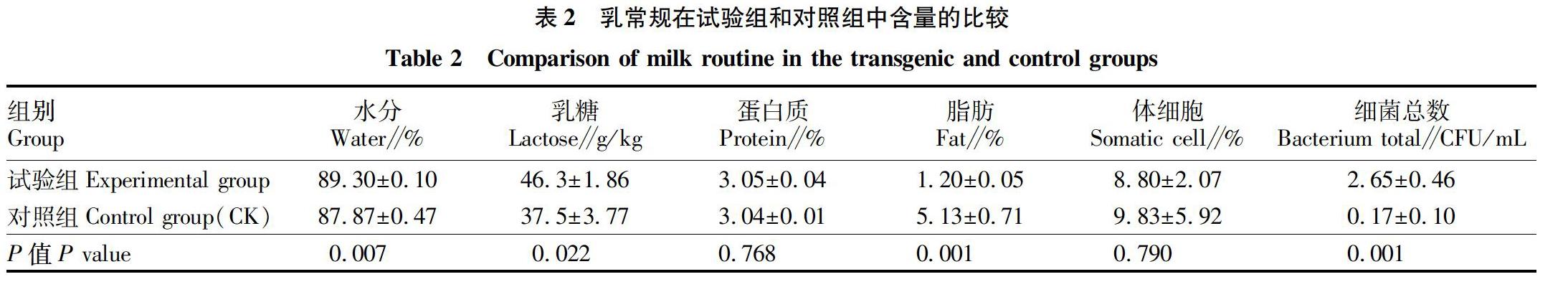
乳常规的测定包括乳中水分、乳糖、蛋白质总量以及体细胞和细菌总数。比较转人溶菌酶牛乳(试验组)和非转基因牛乳(CK)的乳常规测定值,由表2可知,这2组的水分、乳糖、蛋白质含量以及体细胞的数量均无明显变化,而试验组的脂肪含量低于CK(P>0.05),其细菌总数则高于CK(P>0.05)。
2.1.2 乳中氨基酸。
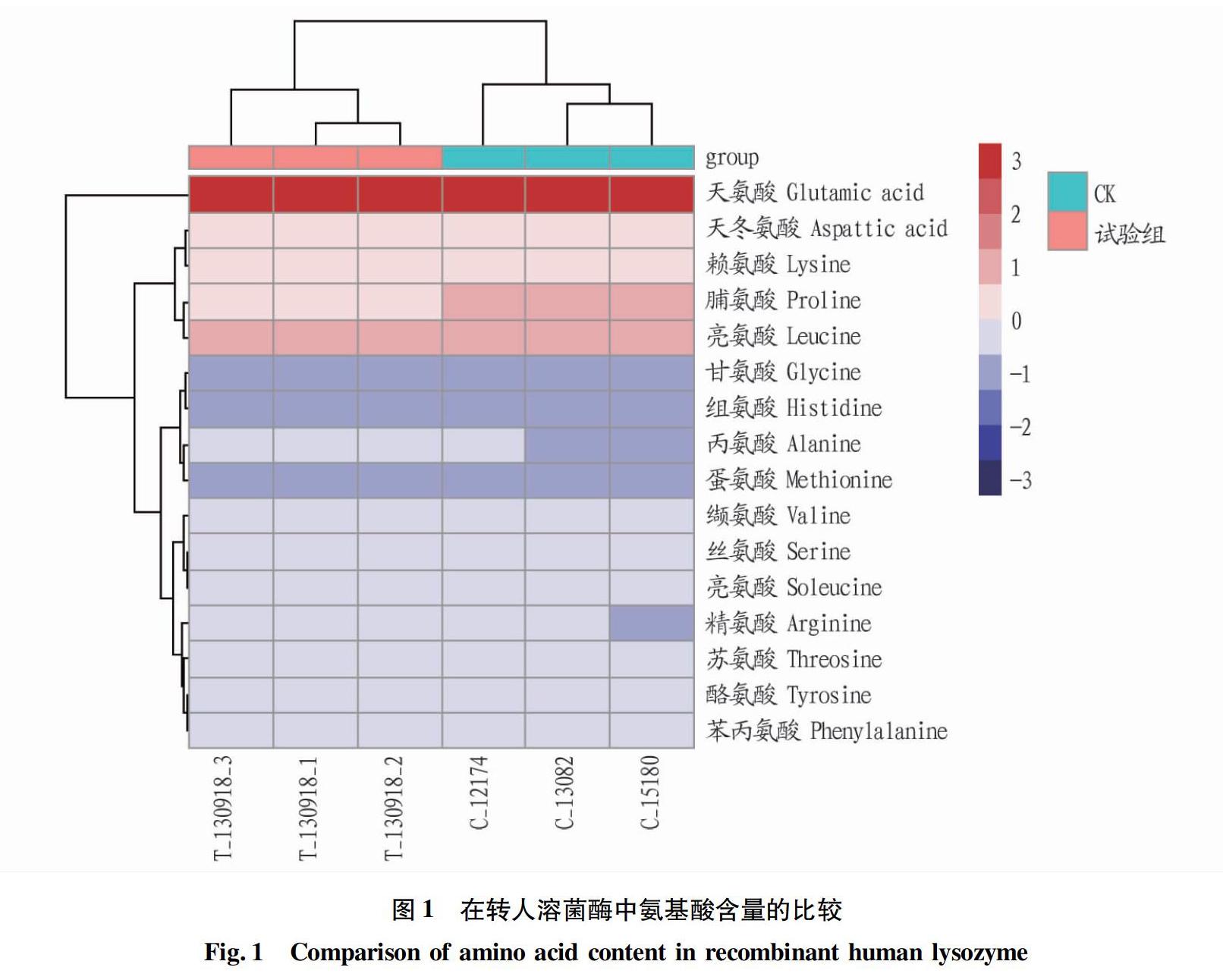
对转人溶菌酶牛乳(试验组)和非转基因牛乳(CK)的16种氨基酸进行测定,结果见图1。从图1可见,这16种氨基酸除了脯氨酸(Proline)、丙氨酸(Alanine)含量略有差异外,其他氨基酸含量接近或者相同,這16种氨基酸含量在2组间总体上差异不显著(P>0.05)。
2.1.3 乳中脂肪酸。
对转人溶菌酶牛乳(试验组)和非转基因牛乳(CK)的牛乳中饱和脂肪酸和不饱和脂肪酸共25种脂肪酸进行测定,结果见图2。从图2可以看出,除了饱和脂肪酸C14∶0、C16∶0、C18∶0以及不饱和脂肪酸C18∶ln9c在2组之间存在差异,其他脂肪酸则在2组之间则无明显变化,说明脂肪酸含量在2组间总体上差异不显著(P>0.05)。
2.2 转人溶菌酶牛乳代谢组结果与分析
基于GC-TOF-MS平台在转人溶菌酶牛乳与非转基因牛乳组(CK)总共检测出472种代谢物,对所有的代谢组进行主成分分析,从图3发现,试验组和CK并没有明显的聚类现象,且2组之间没有显著差异(P>0.05)。
2.3 重组人溶菌酶急性经口毒性试验
2.3.1 大鼠急性经口毒性试验。
给予大鼠重组人溶菌酶处理后,2 150 mg/kg组和4 640 mg/kg组大鼠均未见明显中毒症状,试验结束时未见有死亡的大鼠。在10 000 mg/kg剂量组,大鼠在最后一次灌胃后出现活动减少和精神不适症状。共死亡6只大鼠,其中雌、雄各3只。在观察终点,存活4只大鼠,其中雌、雄各2只。21 500 mg/kg剂量组大鼠在第1次灌胃后出现活动减少、精神萎靡的症状,末次灌胃后1 h开始有死亡大鼠,24 h内全部死亡。观察期间,对死亡大鼠进行大体解剖,主要观察到胃发生肿胀,其他主要脏器未发现明显异常。试验结束时,对处死的大鼠进行解剖,未发生明显的毒理学变化。
观察期内动物体重呈增长相。至观察终点时,10 000 mg/kg剂量组雌、雄性大鼠死亡率均为60%;21 500 mg/kg剂量组大鼠全部死亡,死亡率100%。经统计,重组人溶菌酶的大鼠急性经口毒性试验的雌雄LD50均为9 260 mg/kg,95% MNDG可信区间为6 360~13 500 mg/kg[5]。
2.3.2 小鼠急性经口毒性试验。
给予小鼠重组人溶菌酶处理后,4 640 mg/kg剂量组未发现明显中毒症状及死亡的小鼠;10 000 mg/kg剂量组小鼠出现活动减少、精神萎靡等症状,24 h内雌、雄小鼠各有1只死亡,试验结束时,雌、雄小鼠各有4只存活。21 500 mg/kg剂量组,小鼠出现活动减少、精神萎靡等症状,1 h后出现死亡,在24 h内所有受试小鼠出现死亡。46 400 mg/kg剂量组,小鼠首次灌胃重组人溶菌酶后出现活动减少、精神萎靡等症状,1 h后出现死亡,4 h后最后一次灌胃重组人溶菌酶,在24 h内所有受试小鼠死亡。观察期间,小鼠尸体解剖观察到胃肿胀,其他主要器官未发现明显异常。试验结束时,小鼠死亡后的尸体解剖未发现明显的毒理学变化。
观察期内动物体重呈增长相。至观察终点时,10 000 mg/kg剂量组,雌、雄小鼠各有1只死亡,死亡率均为20%;21 500 mg/kg剂量组,小鼠全部死亡,死亡率100%;至观察终点时46 400 mg/kg 剂量组,小鼠全部死亡,死亡率100%。经过统计计算,重组人溶菌酶的小鼠急性经口毒性雌雄LD50为12 600 mg/kg,95%可信区间为9 260~17 100 mg/kg。
2.4 模拟胃肠液消化稳定性
2.4.1 模拟胃肠液试验。SDS-PAGE 显示(图4),在模拟的胃液中重组人溶菌酶及其可见降解片段在2~30 min 内全部消化(3~7 孔道)。蛋白免疫印迹结果(图5)显示,重组人溶菌酶及其可见降解片段在模拟胃液(4~8 孔道)中 2~30 min 内全部消化。
2.4.2 重组人溶菌酶模拟肠液消化试验 。
SDS-PAGE 结果显示(图4),在模拟肠液中重组人溶菌酶及其可见降解片段在0~15 s内全部消化(11~15 孔道)。蛋白免疫印迹结果显示(图6),重组人溶菌酶及其可见降解片段在模拟肠液(4~8 孔道)中0~15 s内全部消化。
3 结论与讨论
在乳常规方面,转基因牛乳的水分、乳糖、蛋白质含量和体细胞数等与非转基因组无明显变化,但脂肪含量试验组低于CK,菌落总数高于对照组;转基因牛乳中所测的16种氨基酸及25种脂肪酸含量在2组之间无明显差异。在牛乳代谢组方面,转人溶菌酶牛乳和非转基因牛乳无明显差异。
Laible等[6]研究表明,牛乳的乳成分容易发生变化。杨鹏华等[7]关于人乳铁蛋白基因对牛乳成分影响的研究结果表明,转基因牛乳与常乳在乳脂、总蛋白、乳糖和干物质的含量上无明显变化,且外源蛋白的表达水平稳定。
毒理学研究决定是否能够将新药应用于临床,并提供有关药物的毒性剂量和治疗指数的信息。同时科学、道德和法
规要求在将任何潜在的新药供人类使用之前,必须在动物中研究其安全性以定义安全的人类剂量[8]。溶菌酶在医药、食品行业以及畜牧领域都有着比较广泛的应用[9],而转基因得到的重组人溶菌酶在投入应用之前,则需要进行毒理学方面的试验,为今后的应用提供试验支持。食品安全是指符合人体的营养需求,且不会对人体健康造成急性、亚慢性和慢性危害[10]。该研究通过大鼠和小鼠急性经口毒性试验,结果表明,重组人溶菌酶属于实际无毒蛋白;重组人溶菌酶模拟胃肠液消化稳定性试验表明,重组人溶菌酶在胃肠液中都可消化。
周興华[11]对转双反义分支酶基因大米的急性毒性试验研究表明,转基因大米的LD50>21.50 g/kg,试验期间,动物状态良好,无死亡和异常现象。因此,转双反义分支酶基因大米属无毒级别。
根据《食品安全国家标准急性经口毒性试验》(GB 15193.3—2014)急性毒性(LD50)分级标准,大鼠和小鼠急性经口毒性试验表明,重组人溶菌酶是一种实际无毒蛋白。模拟胃肠液消化稳定性试验结果表明,重组人溶菌酶在模拟的胃液中可消化,在模拟的肠液中极易消化,初步说明重组人溶菌酶无潜在的致敏性。
参考文献
[1] 王佃亮.重组人溶菌酶研究进展[J].中国生物工程杂志,2003,23(9):59-63.
[2] ITO Y,YAMADA H,IMOTO T.Colorimetric assay for lysozyme using Micrococcus luteus labeled with a blue dye,Remazol brilliant blue R,as a substrate[J].Chemical & pharmaceutical bulletin,1992,40(6):1523-1526.
[3] WANG C S,KLOER H U.Purification of human lysozyme from milk and pancreatic juice[J].Analytical biochemistry,1984,139(1):224-227.
[4] TAKAI I,ODA O,SHINZATO T,et al.Effective method for purification of lysozyme from human urine[J].Journal of chromatography B:Biomedical applications,1996,685(1):21-25.
[5]李亭,黄诗淇.急性经口毒性试验方法研究进展[J].吉林化工学院学报,2019,36(1):11-14.
[6] LAIBLE G,BROPHY B,KNIGHTON D,et al.Compositional analysis of dairy products derived from clones and cloned transgenic cattle[J].Theriogenology,2007,67(1):166-177.
[7] 杨鹏华,倪凤娥,李宁.利用转基因牛生产重组人乳铁蛋白研究[J].安徽农业科学,2008,36(35):15507-15509.
[8] AL-AFIFI N A,ALABSI A M,BAKRI M M,et al.Acute and sub-acute oral toxicity of Dracaena cinnabari resin methanol extract in rats[J].BMC complementary & alternative medicine,2018,18:1-14.
[9] 宋娟.溶菌酶的分离方法及进展[J].河南化工,2017,34(7):16-18.
[10] 李州霞.我国食品安全检测主要应用技术的研究及现状[J].食品界,2019(4):24-25.
[11] 周兴华.两种转基因大米食用安全性的毒理学研究[D].镇江:江苏大学,2012.
