鼻咽癌放疗后突发性聋患者的临床特征及预后*
2021-07-13王刚邓国庆梁俊涛赵质彬
王刚 邓国庆 梁俊涛 赵质彬
突发性聋(突聋)是耳鼻喉科常见疾病之一,近年来发病率有上升的趋势[1]。突聋的病因及发病机制尚未明确,既往大多数研究者推测其可能的病因包括病毒感染、微循环障碍、自身免疫性疾病、外伤、肿瘤、遗传等因素[2,3]。国外有研究者基于流行病学调查发现,鼻咽癌(nasopharyngeal carcinoma,NPC)人群中突聋的发病风险明显高于正常人群[4]。在临床突聋诊治过程中通过详细询问患者既往史,发现少数突聋患者有NPC放疗史。然而,既往较少有研究对NPC放疗后突聋予以探讨,临床医生对该类患者的临床特征及预后了解不足。因此本研究收集海南省人民医院住院治疗的426例突聋患者的临床资料,根据是否伴有NPC分为两组,对比分析两组患者的临床特征和听力预后,报告如下。
1 资料与方法
1.1临床资料 选取2010年1月到2019年12月在海南省人民医院住院治疗的25例NPC放疗后单侧突聋患者(NPC组)作为研究对象,收集性别、年龄、耳侧、突聋耳和非突聋耳的初诊听阈值、突聋病程、耳鸣和眩晕伴发率、高血压及糖尿病合并率、听阈曲线类型、听力预后、NPC治疗措施及其放疗完成与突聋发病间隔时间。所有患者均符合以下纳入标准:①符合2015年版的突聋的诊断标准[1];②有完整的听力学检查及随访资料;③年龄大于18岁;④通过询问病史、耳鼻喉专科检查及影像学检查排除外伤、药物性聋、梅尼埃病、中耳病变及蜗后占位性病变等明确病因所致的听力下降。在NPC组中,所有患者均通过影像学检查排除鼻咽癌的复发和转移,所有患者均接受规范的放射治疗且所有放疗完成与突聋发病间隔>6个月。以同时期年龄和性别匹配的不伴NPC的突聋患者401为对照组(非NPC组)。两组患者的临床资料见表1。

表1 两组突聋患者的临床资料比较(例, %)
1.2治疗方法 所有患者入院后完善三大常规、凝血功能及血生化等检查无明显异常,给予地塞米松注射液10 mg+生理盐水100 ml静滴,每日1次,每3天减1/4量,共计9~12天,或泼尼松片晨起顿服,1 mg/kg,最大剂量60 mg,每日1次,连用5日后剂量逐日减半,共计10天;银杏叶提取物注射液87.5 mg+生理盐水250 ml静滴,每日1次,共计10天;前列地尔注射液10 μg+100 ml生理盐水静滴,每日1次,共计10天;甲钴胺片80 mg口服,每日2次,共计10天。根据患者的体重及个体情况调整用药,对伴有高血压或糖尿病的患者请相关的科室会诊协助治疗,并在用药期间监测血压、血糖,如患者血糖或血压波动较大,则立即停止口服激素,改用激素鼓室注药治疗。所有患者常规治疗3天后复查纯音测听,若患者听力痊愈则停止所有治疗。
1.3疗效评价 患者于出院时及治疗结束3个月后复查纯音听阈,以治疗结束3个月后听力检测结果作为疗效评估依据。疗效评价标准参照2015年突聋诊疗指南[1]分为:痊愈(听力恢复正常或达患病前水平)、显效(受损频率听力提高达30 dB以上)、有效(受损频率听力提高达15~30 dB)及无效(受损频率听力提高低于15 dB)。
1.4统计学方法 所有数据的统计学分析均采用SPSS 22.0软件进行。计量资料以均数±标准差表示,当数据满足正态分布时,组间比较采用两独立样本t检验,若不满足正态分布时,采用Mann-Whitiney U检验;计数资料以%表示,组间比较采用卡方检验,对于样本量较少时采用Fisher精确检验。对于疗效等级变量的组间比较,采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1两组患者的临床资料对比 由表1可见,两组患者的性别、年龄、患耳侧别、突聋病程、耳鸣及眩晕伴发率、高血压和糖尿病合并率、低频下降型、高频下降型听阈曲线比例的差异均无统计学意义(P>0.05)。NPC组患者的突聋耳初诊听阈值、非突聋耳初诊听阈值和全聋型听阈曲线比例均高于非NPC组,差异有统计学意义(P<0.05)。
2.2两组患者的疗效比较 治疗结束3个月后,NPC组和非NPC组患者的痊愈率、显效率、有效率、无效率及总有效率见表2,组间比较差异有统计学意义(P=0.002)。NPC组中突聋耳治疗后平均听阈值为58.40±11.74 dB HL,高于非NPC组(33.42±9.04 dB HL),听阈改善值低于非NPC组,差异具有统计学意义(P<0.05);两组间非突聋耳听阈改善值无统计学差异(P>0.05)。此外,两组患者的非突聋耳听阈改善值均低于突聋耳听阈改善值,差异有统计学意义(P<0.05)(表2、3)。

表2 两组患者听力疗效比较(例, %)
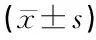
表3 两组治疗后听阈及听阈改善值比较
3 讨论
NPC是一种原发于鼻咽部粘膜上皮细胞的恶性肿瘤,是头颈部最常见的肿瘤之一[4]。近年来,随着放疗技术的发展,NPC的5年生存率逐渐上升,但放射线在杀死肿瘤细胞的同时难免会损伤周围的邻近组织,导致相应的并发症,如慢性听力下降、放射线脑病、颞骨坏死、张口受限等[5]。当放疗损伤内耳或内耳供血动脉时,有可能导致突聋的发生,但目前尚无研究比较全面地分析该类突聋患者的临床特征及听力预后,导致临床医生对该类特殊突聋认识不足。本研究通过对比分析NPC放疗后突聋与非NPC突聋患者的临床资料,以期能促进临床医生对该类疾病深入了解与认识。
上世纪末Young等[6]发现NPC放疗后患者罹患突聋的风险明显增加,并首次提出“放疗后突聋”的概念,认为该类突聋是NPC放疗后的晚期并发症的一种。然而放疗后突聋发病的病因及病理生理机制尚不明确,有研究者推测可能与放射线的照射损伤、微循环障碍和EB病毒感染等因素有关[7]。既往国内有研究者报道了14例NPC放疗后的突聋,发现这些患者听阈预后较差,并推测这类患者的发病可能与后循环缺血有关[8];在另一项研究中,研究者分析了15例放疗后突聋患者的临床资料,发现其中14例患者听力损失严重,仅9例患者听力得到了提高[5]。NPC患者在接受放疗时,放射线在杀伤肿瘤细胞的同时,部分放射线也难免会对内耳造成慢性损伤[4];此外,当放射线伤及内耳供血动脉时,可引发动脉血管内皮细胞的无菌性炎症,造成血管内皮胶原蛋白丢失、血管平滑肌肿胀及功能障碍,动脉管壁长时间的慢性炎症损伤,将导致闭塞性动脉内膜炎,造成动脉血管硬化及管腔狭窄,最终发展为微血管病变,血栓栓塞或血栓形成的风险显著增加[7, 9]。一旦迷路动脉血管事件发生,其血流灌注将急剧减少,甚至终止,而对缺血缺氧极度敏感的内耳毛细胞将发生大面积损伤,造成严重的听力损伤,患者听阈曲线表现为全聋型。此外,放射线照射内耳,会降低耳蜗组织内谷胱甘肽等物质的含量,使其抗氧化能力降低,缺血导致内耳毛细胞的氧化应激损伤加剧,加重患者的听力损伤[10]。NPC放疗后,放射线对内耳的毛细胞或微血管的损伤难以逆转,且狭窄甚至闭塞的迷路动脉无法有效地将治疗药物运送至内耳发挥治疗作用,因此这类患者的听力预后较差。本研究结果显示,NPC放疗后突聋患者的听力损失严重,平均初诊听阈值高达71.60±15.34 dB HL,且听阈曲线中全聋型占比较大(56.00%),治疗后听阈改善值及总有效率均低于非NPC组。
前期有大量文献报道称NPC患者放化疗后常并发慢性感音神经性听力损失,因而有部分学者对“放疗后突聋”表示质疑,他们认为这类突聋其实就是放疗或化疗导致的慢性听力损伤的远期表现[10]。据既往研究报道,放疗或化疗药物导致的慢性听力损伤是一种进展性的、双侧对称性的高频感音神经性聋[5]。本研究纳入的25例NPC放疗后突聋患者均符合突聋的诊断标准,即短期内突发的急性听力损伤,且均为单侧发病,与既往文献报道的放疗或化疗导致的慢性听力损伤存在明显的差异。此外,本研究分析后发现,NPC组非突聋耳的初诊听阈值明显高于对照组,说明NPC组中部分患者在罹患突聋前便存在慢性听力损伤。另外,NPC放疗后突聋患者的非突聋耳治疗后的听阈值与入院时初诊听阈值差异较小,即听阈改善值较小;而突聋耳治疗后平均听阈值变化较大,且明显高于非突聋耳的听阈改善值,说明NPC放疗后突聋通过治疗能够改善听力,也间接说明该类突聋与放化疗导致的慢性听力损伤明显不同,提醒耳鼻喉科医生要注意鉴别诊断放疗后突聋和放疗后慢性感音神经聋,避免这类突聋患者的漏诊或误诊。
综上所述,鼻咽癌放疗后突聋与放化疗导致的慢性听力损伤不同,患者听力损失较重,听阈曲线以全聋型为主,治疗效果差。定期对NPC放疗后的患者复查纯音听阈,有助于避免这类人群中突聋的漏诊或误诊。
