黄芪甲苷对变应性鼻炎模型小鼠改善作用的机制初探
2021-07-11陈旭青马华安周龙云严道南刘书芬吴继勇
陈旭青 马华安 周龙云 严道南 刘书芬 吴继勇
中圖分类号 R765.2;R285.5 文献标志码 A 文章编号 1001-0408(2021)10-1187-09
DOI 10.6039/j.issn.1001-0408.2021.10.06
摘 要 目的:初步研究黄芪甲苷对变应性鼻炎(AR)模型小鼠改善作用的可能机制。方法:将C57/BL6小鼠随机分为空白组、模型组和黄芪甲苷组,每组10只。除空白组外,其余大鼠均于第0、7、14、21~27天以卵清蛋白为致敏源进行攻击以复制AR模型。于造模第15~27天,黄芪甲苷组小鼠按0.02 mL/g腹腔注射黄芪甲苷40 mg/kg(第21~27天均于攻击致敏前1 h给药),空白组和模型组小鼠腹腔注射等体积生理盐水,每天1次。末次攻击致敏24 h后,观察各组小鼠鼻黏膜组织中炎症细胞的浸润情况,检测其鼻腔灌洗液中白细胞介素4(IL-4)、IL-5、干扰素γ(IFN-γ)含量,鼻黏膜和脾脏组织中活性氧簇(ROS)水平和磷酸化Janus激酶2(p-JAK2)、磷酸化信号转导及转录激活蛋白6(p-STAT6)阳性细胞计数,以及脾脏组织中JAK2、STAT6蛋白的磷酸化水平(即p-JAK2/JAK2比值、p-STAT6/STAT6比值)。结果:与空白组比较,模型组小鼠鼻黏膜组织中炎症细胞(嗜酸粒细胞和肥大细胞)计数,鼻腔灌洗液中IL-4、IL-5含量,鼻黏膜和脾脏组织中ROS水平和p-JAK2、p-STAT6阳性细胞计数,脾脏组织中p-JAK2/JAK2比值、p-STAT6/STAT6比值均显著升高(P<0.05),鼻腔灌洗液中INF-γ含量显著降低(P<0.05)。与模型组比较,黄芪甲苷组小鼠鼻黏膜组织中炎症细胞计数,鼻腔灌洗液中IL-4、IL-5含量,鼻黏膜和脾脏组织中ROS水平和p-JAK2、p-STAT6阳性细胞数量,脾脏组织中p-JAK2/JAK2比值、p-STAT6/STAT6比值均显著降低(P<0.05),鼻腔灌洗液中INF-γ含量显著增加(P<0.05)。结论:黄芪甲苷能够有效改善AR模型小鼠变应性炎症反应,其机制可能与下调JAK2/STAT6信号通路及ROS水平有关。
关键词 变应性鼻炎;黄芪甲苷;活性氧簇;Janus激酶2/信号转导及转录激活蛋白6信号通路;小鼠
Preliminary Study on the Improvement Effects of Astragaloside Ⅳ on Allergic Rhinitis Model Mice
CHEN Xuqing1,MA Huaan1,ZHOU Longyun2,YAN Daonan1,LIU Shufen3,WU Jiyong1(1. Dept. of Otorhinolaryngology, the Affiliated Hospital of Nanjing University of TCM, Nanjing 210029, China; 2. Dept. of Rehabilitation, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China; 3. Faculty of Basic Medicine, Longhua Hospital Affiliated to Shanghai University of TCM, Shanghai 210032, China)
ABSTRACT OBJECTIVE: To preliminarily study the potential mechanism of astragaloside Ⅳ on allergic rhinitis (AR) model mice. METHODS: C57/BL6 mice were randomly divided into blank group, model group and astragaloside Ⅳ group, with 10 mice in each group. Except for blank group, AR model was prepared by sensitization and challenge with ovalbumin on day 0, 7, 14 and 21-27. Astragaloside Ⅳ group was given astragaloside Ⅳ 40 mg/kg intraperitoneally at the dose of 0.02 mL/g on the 15th to 27th day of modeling (given the drug 1 h before challenge sensitization on the 21st to 27th day). Blank group and model group were given constant volume of normal saline intraperitoneally, once a day. Twenty-four hours after sensitization from the last challenge, the infiltration of inflammatory cells in the nasal mucosa of each group was observed, and the contents of interleukin 4 (IL-4), IL-5 and interferon gamma (IFN-γ) in the nasal lavage fluid were measured. The levels of reactive oxygen species (ROS), and the count of phosphorylated Janus kinase 2 (p-JAK2) and phosphorylation signal transduction and activation of transcription protein 6 (p-STAT6) positive cells in the nasal mucosa and spleen as well as the phosphorylation levels of JAK2 and STAT6 proteins in spleen tissue (i.e. p-JAK2/JAK2 ratio, p-STAT6/STAT6 ratio) were also determined. RESULTS: Compared with blank group, the number of inflammatory cells in the nasal mucosa (eosinophils and mast cells) in the model group, the contents of IL-4 and IL-5 in the nasal lavage fluid, and the levels of ROS in the nasal mucosa and spleen tissues in the model group, the count of p-JAK2 and p-STAT6 positive cells increased significantly, the p-JAK2/JAK2 ratio, p-STAT6/STAT6 ratio in the spleen tissue were significantly increased (P<0.05), and the content of INF-γ in the nasal lavage fluid was significantly decreased (P<0.05). Compared with model group, the count of inflammatory cells infiltrated in the nasal mucosa, the contents of IL-4 and IL-5 in the nasal cavity lavage fluid, the level of ROS and the number of p-JAK2 and p-STAT6 positive cellsin the nasal mucosa and spleen tissue as well as the p-JAK2/JAK2 ratio and p-STAT6/STAT6 ratio in spleen tissue were decreased significantly (P<0.05), and the content of INF-γ in nasal lavage fluid was significantly increased (P<0.05). CONCLUSIONS: Astragaloside Ⅳ can effectively improve the inflammatory response in AR model mice, the mechanism of which may be related to down-regulation of JAK2/STAT6 signaling pathway and ROS level.
KEYWORDS Allergic rhinitis; Astragaloside Ⅳ; ROS;JAK2/STAT6 signaling pathway; Mice
变应性鼻炎(AR)为耳鼻咽喉头颈外科最常见的疾病之一[1-3]。据统计,世界范围内约有10.0%~40.4%的人口具有AR的临床表现[4-6]。研究表明,内源性活性氧簇(ROS)水平升高以及Janus激酶2(JAK2)、信号转导及转录激活蛋白6(STAT6)信号分子活化是变应性炎症发生发展的重要病理机制,而选择性降低ROS水平,抑制JAK2、STAT6信号分子活化,则能显著改善AR等变应性炎症[7-10]。黄芪甲苷是AR治疗经验方——益气温阳方中君药黄芪的重要成分[11-13]。研究显示,该成分能有效改善变应性炎症,但其作用机制尚不明确[14-15]。基于此,本研究拟从ROS以及JAK2/STAT6信号通路角度出发,初步研究黄芪甲苷对AR模型小鼠改善作用的可能机制,旨在为AR的中医药治疗提供科学依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括BX51型正置荧光显微镜和SZ51型体视显微镜(日本Olympus公司)、ChemiDoc XRS型化学发光检测仪(美国 Bio-Rad 公司)、CM3050 S型冰冻切片机(德国Leica公司)等。
1.2 主要药品与试剂
黄芪甲苷对照品(批号b10462,纯度≥98%)购自上海士锋生物科技有限公司;卵清蛋白(OVA,批号O1641,纯度≥98%)购自美国Sigma公司;ROS检测荧光探针-二氢乙啶(DHE)试剂盒(批号KGAF019)购自南京凯基生物科技发展有限公司;甲苯胺蓝染料(批号D034-1-1)购自南京建成生物工程研究所;苏木精-伊红(HE)染色试剂盒、TritonX-100试剂、十二烷基硫酸钠(SDS)、牛血清白蛋白(BSA)、ECL化学发光试剂盒、BCA蛋白定量试剂盒、辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白G(IgG)二抗(批号分别为C0105S、ST795、ST626、ST025、P0018AS、P0012、A0208)均购自上海碧云天生物技术有限公司;冰冻切片包埋剂(批号4583)购自美国Sakura公司;含4′,6-二脒基-2-苯基吲哚(DAPI)的抗荧光淬灭封片液(批号H-1200)购自美国Vector Laboratories公司;聚偏二氟乙烯(PVDF)膜(批号IPVH00010)购自美国Millipore公司;白细胞介素4(IL-4)、IL-5、干扰素γ(IFN-γ)酶联免疫吸附测定(ELISA)试剂盒(批号分别为70-EK204HS-96、70-EK205HS-96、70-EK280HS-96)均購自杭州联科生物技术股份有限公司;兔磷酸化JAK2(p-JAK2)单克隆抗体、兔JAK2单克隆抗体、兔磷酸化STAT6(p-STAT6)多克隆抗体、兔STAT6单克隆抗体、兔β-肌动蛋白(β-actin)兔多克隆抗体(批号分别为ab32101、ab108596、ab28829、ab32520、ab8227)均购自英国Abcam公司;CoraLite 594标记的驴抗兔IgG二抗(批号SA00013-8)购自美国Proteintech公司;其余试剂均为分析纯或实验室常用规格,水为纯化水或超纯水。
1.3 动物
SPF级C57/BL6小鼠30只,雌雄各半,6~8周龄,体质量(20±2)g,由南京中医药大学动物实验中心提供,动物使用许可证号为SYXK(苏)2018-0049。所有动物按每笼5只饲养于南京中医药大学动物实验中心,室温为22~24 ℃,相对湿度为50%~60%,光照时间为每天12 h;自由摄食饮水,每3天更换1次垫料。本研究实验方案获得南京中医药大学动物伦理委员会的批准。
2 方法
2.1 造模、分组与给药
将30只C57/BL6小鼠按随机数字表法分为空白组、模型组、黄芪甲苷组,每组10只。采用基础致敏联合攻击致敏以复制AR模型。于造模第0、7、14天进行基础致敏:模型组和黄芪甲苷组小鼠于上述时间点分别单次腹腔注射OVA-氢氧化铝混悬液(以OVA 25 μg、氢氧化铝1 mg加入至生理盐水300 μL中,制得);空白组小鼠于相同时间点单次腹腔注射同体积生理盐水。于造模第21~27天连续进行攻击致敏:模型组和黄芪甲苷组小鼠双侧鼻腔滴入OVA混悬液(以OVA 500 μg加入至生理盐水20 μL中,制得),每侧10 μL,每天1次;空白组小鼠于相同时间点同法滴入等体积生理盐水。于造模第15~27天,黄芪甲苷组小鼠腹腔注射黄芪甲苷40 mg/kg(以生理盐水为溶剂,第21~27天于攻击致敏前1 h给药)[15-18],按0.02 mL/g给药,每天1次;空白组和模型组小鼠同法注射等体积生理盐水。若小鼠出现频繁挠鼻、喷嚏,则视为造模成功[19-20]。AR建模及给药流程见图1。
2.2 小鼠样本的收集与制备
2.2.1 鼻腔灌洗液 于末次OVA鼻腔攻击致敏24 h后,以戊巴比妥钠进行麻醉,并将小鼠固定于超净工作台内甲板上,以75%乙醇消毒后剖开颈部,分离气管,于气管内注入生理盐水1 mL,收集小鼠鼻腔流出的液体,于4 ℃下以1 000×g离心10 min,吸取上清液,分装保存于-80 ℃冰箱中,备用。
2.2.2 不经固定的组织切片 收集鼻腔灌洗液后处死小鼠,每组取3只小鼠,分离其新鲜鼻黏膜及脾脏组织,以冰冻切片包埋剂包埋后切片,制得厚约7 μm的新鲜冰冻组织切片,用于DHE染色;每组另取3只小鼠,分离其新鲜脾脏,经锡纸包裹后放入试剂管中,液氮速冻后,移至-80 ℃冰箱中,备用。
2.2.3 经固定的组织切片 每组另取4只小鼠,断头后将头部置于4%多聚甲醛溶液中固定1~3天,再置于10%乙二胺四乙酸溶液中脱钙5天,分离自鼻尖往后10 mm的鼻腔结构组织,样本依次经20%、30%蔗糖溶液脱水后,用冰冻切片包埋剂包埋后切片,制得厚约7 μm的鼻黏膜冰冻组织切片,保存于-80 ℃冰箱中,备用。取剩余脾脏组织置于4%多聚甲醛溶液中固定1~3天,用冰冻切片包埋剂包埋后切片,制得厚度约7 μm的脾脏冰冻组织切片,保存于-80 ℃冰箱中,备用。
2.3 小鼠鼻腔灌洗液中IL-4、IL-5、INF-γ含量检测
取“2.2.1”项下各组6只小鼠的鼻腔灌洗液样本,按ELISA试剂盒说明书进行操作,使用酶标仪检测其鼻腔灌洗液中IL-4、IL-5、INF-γ含量。
2.4 小鼠鼻黏膜组织中炎症细胞浸润情况观察
取“2.2.3”项下各组小鼠经固定的鼻黏膜冰冻组织切片,经HE或甲苯胺蓝染色后封片,于正置显微镜下观察其鼻黏膜组织中炎症细胞(嗜酸粒细胞和肥大细胞)的浸润情况并计数。
2.5 小鼠鼻黏膜和脾脏组织中p-JAK2、p-STAT6阳性细胞计数检测
采用免疫荧光化学法进行检测。在室温下复温“2.2.3”项下各组小鼠经固定的各组小鼠鼻黏膜和脾脏冰冻组织切片,以pH 7.4的磷酸盐缓冲液(PBS)洗涤3次;用含0.3%TritonX-100、5%BSA的PBS室温孵育1 h后,分别滴加以含0.3%TritonX-100、5%BSA的PBS稀释的兔p-JAK2、p-STAT6抗体(稀释比例为1 ∶ 200),4 ℃孵育过夜;以PBS洗涤3次后,滴加以含0.3%TritonX-100、5%BSA的PBS稀释的CoraLite594标记的驴抗兔IgG二抗(稀释比例为1 ∶ 2 500),室温避光孵育2 h。以PBS洗涤3次后,滴加含DAPI的抗荧光淬灭封片液,于正置荧光显微镜下观察各组小鼠鼻黏膜和脾脏组织中p-JAK2、p-STAT6的阳性细胞并计数。实验重复3次。
2.6 小鼠鼻黏膜和脾脏组织中ROS水平检测
取“2.2.2”项下各组小鼠的新鲜鼻黏膜和脾脏冰冻组织切片,以PBS洗涤,加5 μmol/L DHE染液100 μL,于37 ℃孵育30 min;以PBS洗涤后,于正置荧光显微镜下观察其鼻黏膜和脾脏组织中ROS水平。以空白组为参照,以各组与空白组结果的比值进行定量。实验重复3次。
2.7 小鼠脾脏组织中p-JAK2、JAK2、p-STAT6、STAT6蛋白表达的检测
采用Western bolt法进行测定。取“2.2.2”项下各组小鼠新鲜脾脏组织,经裂解、匀浆、静置后,以13 000×g离心15 min,获取上清液。采用BCA法测定蛋白浓度后,于100 ℃下变性5 min。取变性后的蛋白样品经SDS-聚丙烯酰胺凝胶电泳分离并转移至PVDF膜上,以含5%BSA的TBST溶液室温封闭2 h后,分别加入以含1%BSA的PBS稀释的p-JAK2、JAK2、p-STAT6、STAT6、β-actin一抗(稀释比例均为1 ∶ 2 000),4 ℃孵育过夜;TBST溶液洗涤3次,加入以含1%BSA的PBS稀释的HRP标记的山羊抗兔IgG二抗(稀释比例为1 ∶ 2 000),室温下孵育1.5 h;以TBST溶液洗滌后,滴加ECL曝光液,于化学发光检测仪下显影。使用Image J V 1.8.0.112软件进行分析,以目标蛋白与内参(β-actin)的灰度值比值表示目标蛋白的表达水平,并以p-JAK2/JAK2比值、p-STAT6/STAT6比值分别表示JAK2、STAT6蛋白的磷酸化水平。以空白组为参照,以各组与空白组结果的比值进行定量。试验重复3次。
2.8 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
3 结果
3.1 黄芪甲苷对AR模型小鼠鼻腔灌洗液中IL-4、IL-5、INF-γ含量的影响
与空白组比较,模型组小鼠鼻腔灌洗液中IL-4、IL-5含量均显著升高,INF-γ含量显著降低(P<0.05)。与模型组比较,黄芪甲苷组小鼠鼻腔灌洗液中IL-4、IL-5含量显著降低,INF-γ含量均显著升高(P<0.05),详见表1。
3.2 黄芪甲苷对AR模型小鼠鼻黏膜组织中炎症细胞浸润的影响
空白组小鼠下鼻甲黏膜和鼻底部黏膜组织中均未见明显的嗜酸性粒细胞和肥大细胞浸润。模型组小鼠下鼻甲黏膜和鼻底部黏膜组织中均可见大量的嗜酸性粒细胞,鼻底部黏膜附近可见大量肥大细胞浸润,嗜酸性粒细胞和肥大细胞数量均较空白组显著增加(P<0.05)。黄芪甲苷组小鼠下鼻甲黏膜和鼻底部黏膜组织中均可见少量嗜酸性粒细胞,鼻底部黏膜附近可见少量肥大细胞浸润,嗜酸性粒细胞和肥大细胞数量均较模型组显著减少(P<0.05),详见图2(图中,嗜酸粒细胞被染成红色)、图3(图中,肥大细胞被染成紫蓝色,白边方框为黑边方框区域的放大图)、表2。
3.3 黄芪甲苷对AR模型小鼠鼻黏膜和脾脏组织中p-JAK2、p-STAT6阳性细胞计数的影响
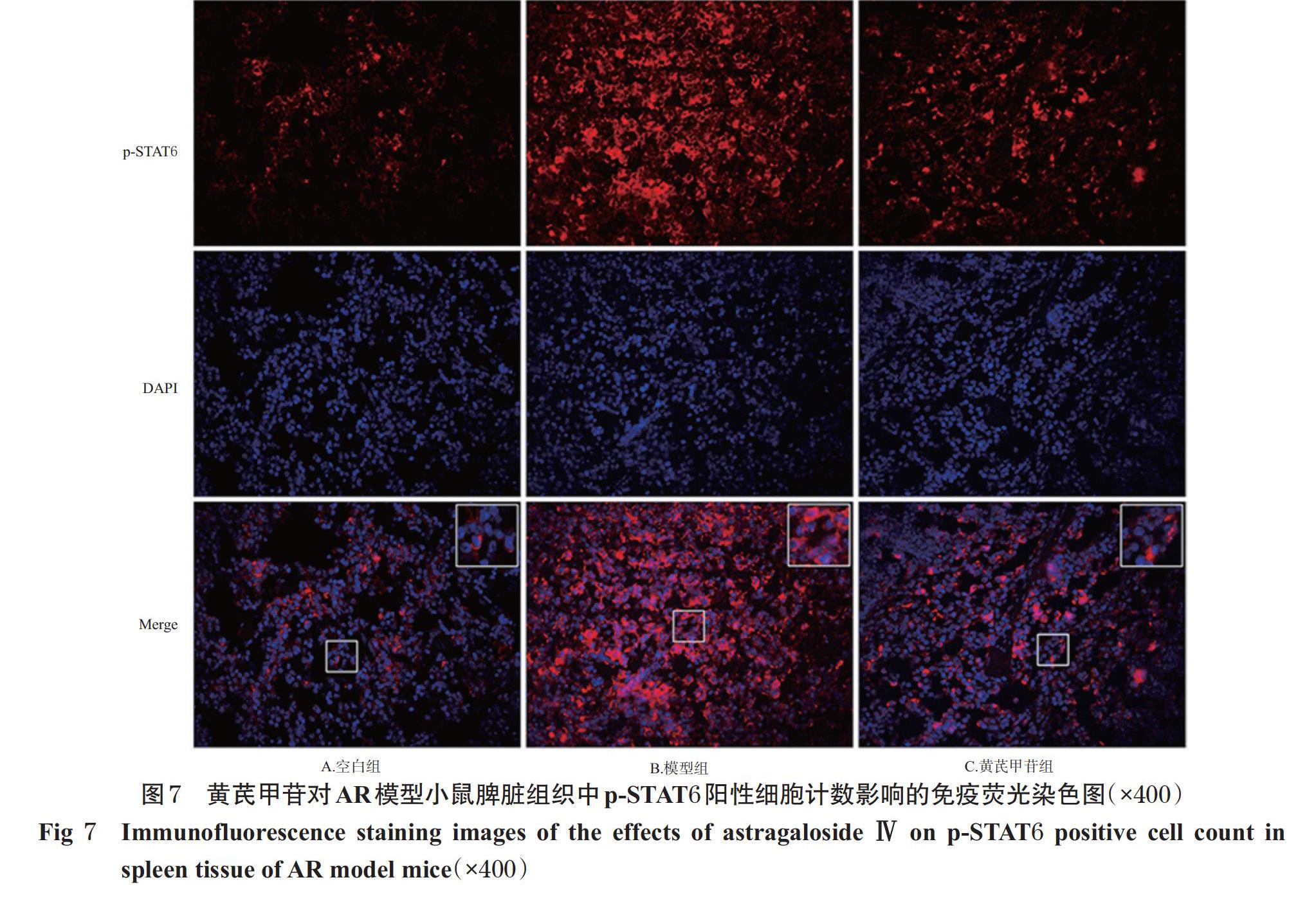
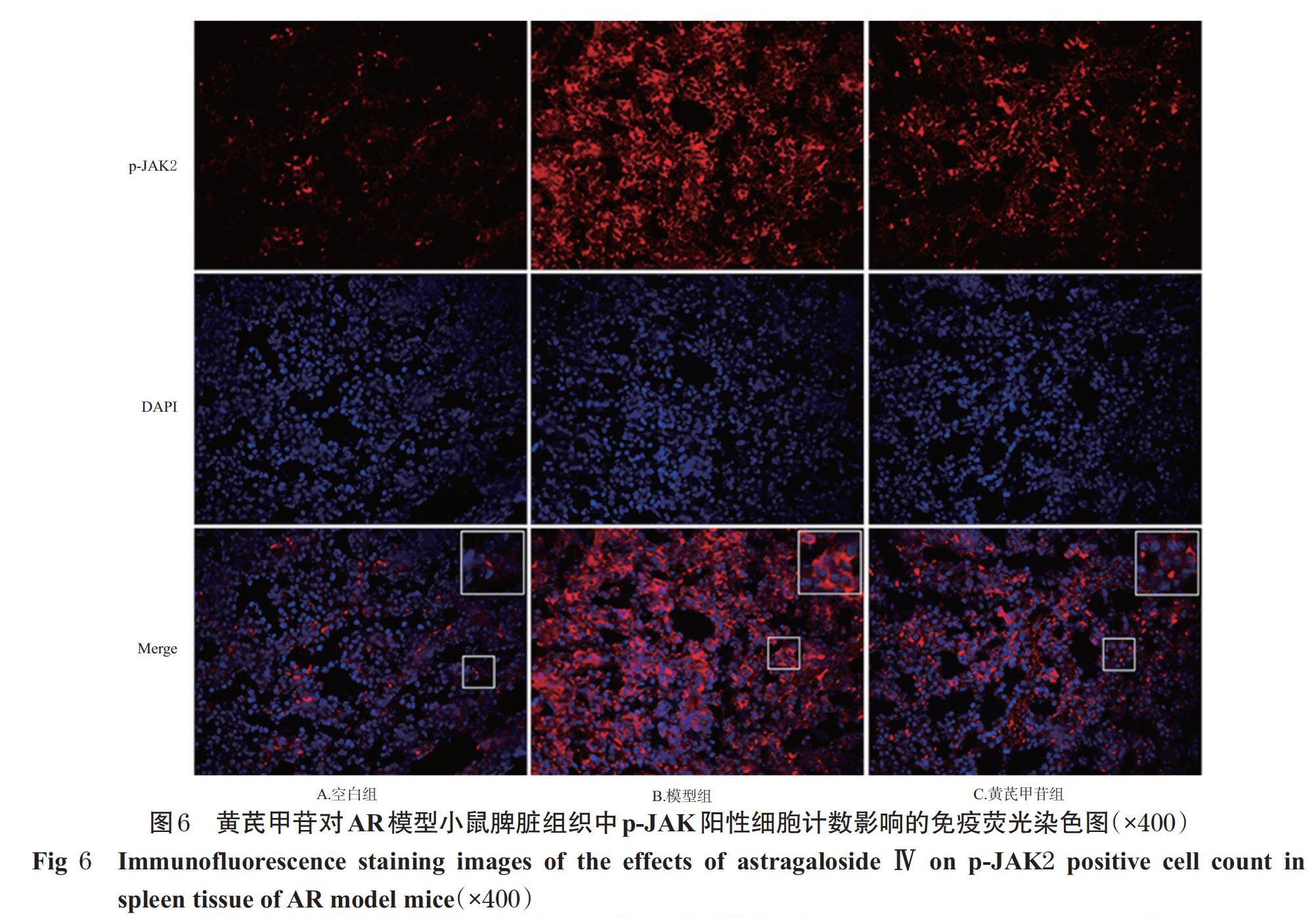
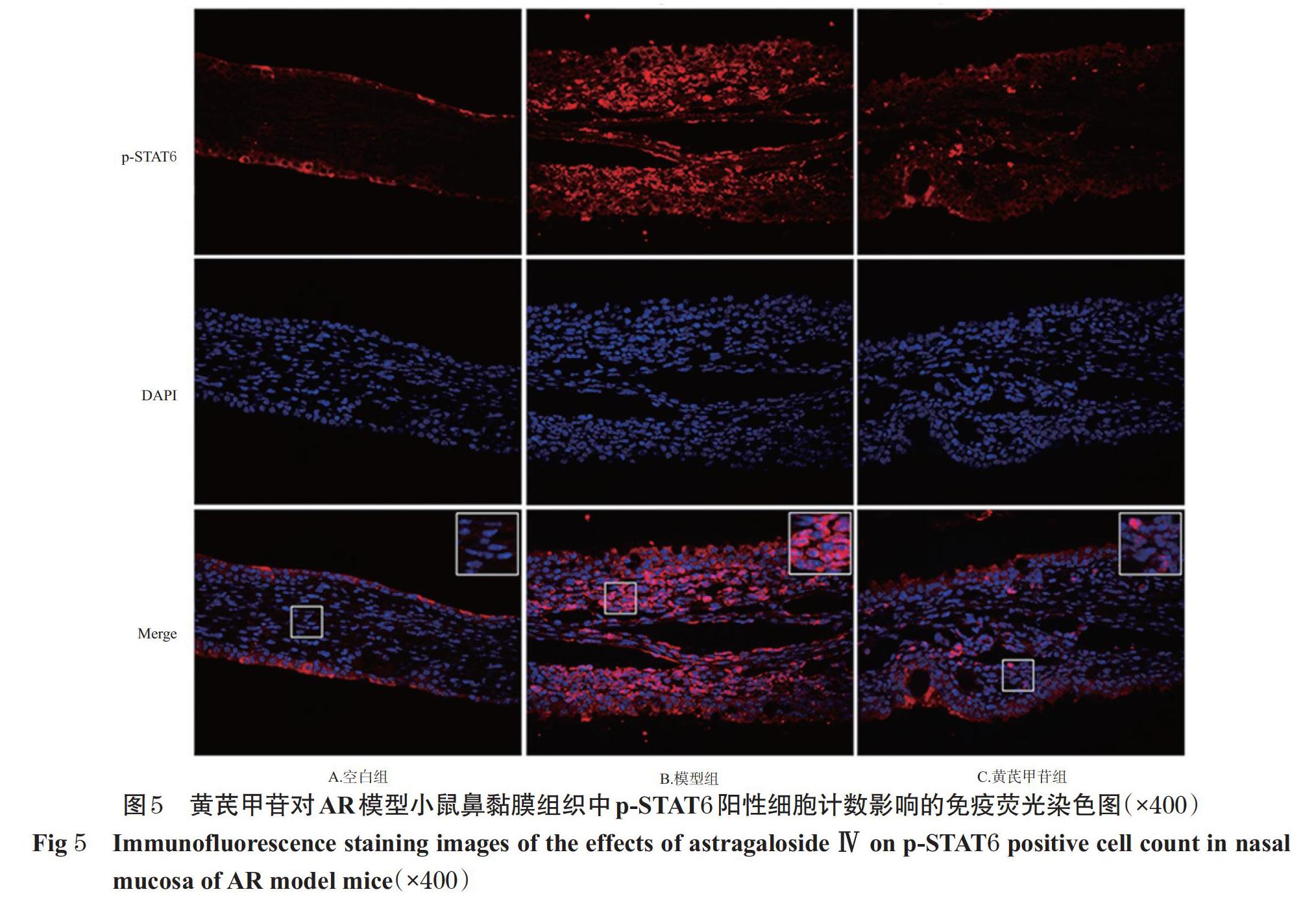
与空白组比较,模型组小鼠鼻黏膜和脾脏组织中p-JAK2、p-STAT6阳性细胞计数均显著增加(P<0.05);与模型组比较,黄芪甲苷组小鼠鼻黏膜和脾脏组织中p-JAK2、p-STAT6阳性细胞计数显著降低(P<0.05),详见图4~图7(图中,红色荧光表示p-JAK2、p-STAT6蛋白的阳性染色,蓝色荧光表示细胞核,Merge为二者合并,大白边方框为小白边方框区域的放大图)、表3。
3.4 黄芪甲苷对AR模型小鼠鼻黏膜和脾脏组织中ROS水平的影响
与空白组比较,模型组小鼠鼻黏膜和脾脏组织中ROS水平均显著升高(P<0.05);与模型组比较,黄芪甲苷组小鼠鼻黏膜和脾脏组织中ROS水平均显著降低(P<0.05),详见图8(图中,红色荧光表示ROS阳性染色)、表4。
3.5 黄芪甲苷对AR模型小鼠脾脏组织中p-JAK2/JAK2、p-STAT6/STAT6比值的影响
与空白组比较,模型组小鼠脾脏组织中p-JAK2/JAK2比值、p-STAT6/STAT6比值均显著升高(P<0.05);与模型组比较,黄芪甲苷组小鼠脾脏组织中p-JAK2/JAK2比值、p-STAT6/STAT6比值均显著降低(P<0.05),详见图9、表5。
4 讨论
黄芪味甘,性微温,入脾、肺二经,以健脾补肺、益气升阳、固表之功见长,正与AR中医“肺脾虚寒”之机相合,故临床常用之治疗AR一症[21-22]。黄芪甲苷是中药黄芪的主要成分[11-13]。研究显示,该成分对变应性炎症的抑制具有良好的作用,但其内在机制尚不明确[14-15]。基于此,本研究拟从ROS以及JAK2/STAT6信号通路的角度出发,探讨黄芪甲苷对小鼠AR的潜在效应机制,为AR中医药治疗提供一定内在依据。
鼻黏膜中嗜酸性粒细胞、肥大细胞等浸润,以及局部IL-4、IL-5等细胞因子含量升高,均是AR变应性炎症的病理基础,亦为评价变应性炎症的重要指标[23-25]。本研究结果显示,OVA诱导的模型组小鼠鼻黏膜组织中可见大量的嗜酸性粒细胞、肥大细胞浸润。经黄芪甲苷干预后,小鼠鼻黏膜组织中局部嗜酸性粒细胞、肥大细胞计数显著减少,提示黄芪甲苷对AR模型小鼠的局部免疫应答具有一定的调节作用。同时ELISA结果显示,与模型组小鼠比较,黄芪甲苷组小鼠鼻腔灌洗液中辅助型T细胞2型(Th2)细胞因子IL-4、IL-5含量有所下调,而辅助型T细胞1型(Th1)细胞因子INF-γ含量则显著升高。上述结果表明,黄芪甲苷对Th1/Th2细胞平衡和AR变应性炎症具有较好的改善作用。
JAK2、STAT6广泛参与细胞的增殖、分化、胶原合成和免疫调节等过程,具有介导多种细胞因子和生长因子分泌的生物学作用,其活化参与变应性炎症的进展,与AR、哮喘、特异性皮炎等疾病的发生发展密切相关[26-27]。大量研究表明,变应性炎症局部JAK2、STAT6信号分子磷酸化水平显著升高,而抑制JAK2、STAT6信号分子活化则能有效调节Th1/Th2细胞平衡,从而改善AR等变应性炎症反应[9,26-28]。ROS是JAK2/STAT6信号通路的上游信号分子,为AR等变应性炎症发展过程中的重要因子[9,29-30]。研究显示,其水平升高,能调节核因子κB、JAK2、STAT6等信号分子,诱导Th2型细胞活化以及B细胞释放IgE,从而促进变应性炎症的进展[7,10,31-33]。更有研究表明,选择性降低ROS水平能显著降低JAK2、STAT6等信号分子活性,进而改善AR等变应性炎症反应[10,29,34]。本研究结果显示,AR模型小鼠鼻黏膜和脾脏组织中p-JAK2、p-STAT6阳性细胞计数和ROS水平均显著升高,脾脏组织中p-JAK2/JAK2、p-STAT6/STAT6比值均显著升高;经黄芪甲苷干预后,小鼠鼻黏膜和脾脏组织中JAK2、STAT6阳性细胞数量和ROS水平以及脾脏组织中p-JAK2/JAK2、p-STAT6/STAT6比值均较模型组显著降低。基于上述结果,笔者认为黄芪甲苷有效抑制AR变应性炎症的效应可能与下调ROS水平及抑制JAK2/STAT6信号通路相关。
但本研究存在一些不足:(1)本次研究主要涉及体内实验,后续将开展体外实验,以进一步明确药物结合的蛋白及靶点;(2)鉴于鼻黏膜样本量较少,本研究虽提取了相关样本,但未能对全部样本开展有效的聚合酶链式反应、Western blot检测分析;(3)由于涉及ROS、JAK2/STAT6信号通路机制的常规阳性药物缺乏,故未设置阳性对照组,本课题组下一步将筛选具有对比意义的阳性药物,开展更全面、深层次的研究,为黄芪甲苷治疗AR提供更丰富的临床前证据。
综上,中药黄芪有效成分黄芪甲苷能够有效改善AR模型小鼠的变应性炎症反应,其内在机制可能与调控JAK2/STAT6信号通路及ROS水平相关,即下调JAK2/STAT6信号通路及ROS水平可能是AR精准治疗的潜在靶点之一。
参考文献
[ 1 ] KLIMEK L,SPERL A,BECKER S,et al. Current therapeutical strategies for allergic rhinitis[J]. Expert Opin Pharmacother,2019,20(1):83-89.
[ 2 ] BOUSQUET J,KHALTAEV N,CRUZ A A,et al. Allergic rhinitis and its impact on asthma(ARIA)2008 update[J].Allergy,2008,63(Suppl 86):8-160.
[ 3 ] 白尚杰,梁莎,鲁晓军.玉屏风颗粒对变应性鼻炎合并支气管哮喘患兒免疫功能及相关指标的影响[J].中国药房,2018,29(4):530-533.
[ 4 ] CHONG S N,CHEW F T. Epidemiology of allergic rhinitis and associated risk factors in Asia[J]. World Allergy Organ J,2018,11(1):17.
[ 5 ] BOZEK A,SCIERSKI W,IGNASIAK B,et al. The prevalence and characteristics of local allergic rhinitis in Poland
[J]. Rhinology,2019,57(3):213-218.
[ 6 ] WANG X Y,MA T T,WANG X Y,et al. Prevalence of pollen-induced allergic rhinitis with high pollen exposure in grasslands of northern China[J]. Allergy,2018,73(6):1232-1243.
[ 7 ] SHI Q,LEI Z,CHENG G,et al. Mitochondrial ROS activate interleukin-1β expression in allergic rhinitis[J]. Oncol Lett,2018,16(3):3193-3200.
[ 8 ] SEBAG S C,KOVAL O M,PASCHKE J D,et al. Mitochondrial CaMKⅡ inhibition in airway epithelium protects against allergic asthma[J]. JCI Insight,2017,2(3):e88297.
[ 9 ] DING F,LIU B,ZOU W,et al. LPS exposure in early life protects against mucus hypersecretion in ovalbumin-induced asthma by down-regulation of the IL-13 and JAK-STAT6 pathways[J]. Cell Physiol Biochem,2018,46(3):1263-1274.
[10] NAGARAJ C,HAITCHI H M,HEINEMANN A,et al. Increased expression of p22phox mediates airway hyperresponsiveness in an experimental model of asthma[J]. Antioxid Redox Sign,2017,27(18):1460-1472.
[11] 严道南,马华安,郭小红,等.益气温阳方对变应性鼻炎肺脾虚寒证的临床疗效[J].南京中医药大学学报,2011,27(1):19-21.
[12] 王曼,严道南,陈旭青,等.益气温阳汤联合舌下免疫治疗中重度持续性变应性鼻炎的疗效分析[J].辽宁中医杂志,2017,44(6):1190-1193.
[13] 陈旭青,马群,周龙云,等.益气温阳方对变应性鼻炎小鼠鼻黏膜NK细胞浸润影响的实验研究[J].中華耳鼻咽喉头颈外科杂志,2017,52(12):921-926.
[14] JIN H,WANG L,LI B,et al. Astragaloside Ⅳ ameliorates airway inflammation in an established murine model of asthma by inhibiting the mTORC1 signaling pathway[J].Evid Based Complement Alternat Med,2017,2017:4037086.
[15] HUANG X,TANG L,WANG F,et al. Astragaloside Ⅳ attenuates allergic inflammation by regulation Th1/Th2 cytokine and enhancement CD4+CD25+ Foxp3 T cells in oval- bumin-induced asthma[J]. Immunobiology,2014,219(7):565-571.
[16] DU Q,CHEN Z,ZHOU L,et al. Inhibitory effects of astra- galoside Ⅳ on ovalbumin-induced chronic experimental asthma[J]. Can J Physiol Pharm,2008,86(7):449-457.
[17] LI K,CHEN Y,JIANG R,et al. Protective effects of astra- galoside Ⅳ against ovalbumin-induced allergic rhinitis are mediated by T-box protein expressed in T cells/GATA-3 and forkhead box protein 3/retinoic acid-related orphan nuclear receptor γt[J]. Mol Med Rep,2017,16(2):1207-1215.
[18] HEMMATI S,RAHIMI N,DABIRI S,et al. Inhibition of ovalbumin-induced allergic rhinitis by sumatriptan through the nitric oxide pathway in mice[J]. Life Sci,2019,236:116901.
[19] 苗明三,项丽玲,苗艳艳.变应性鼻炎动物模型制备规范:草案[J].中草药,2018,49(1):50-57.
[20] 栾兆磊,王雨农,王洪田.变应性鼻炎动物模型的研究进展[J].临床耳鼻咽喉头颈外科杂志,2016,30(13):1090- 1094.
[21] 许江涛,张丽娟,霍宇航,等.黄芪多糖对肺气虚型变应性鼻炎大鼠TSLP、OX40L mRNA表达的影响[J].广州中医药大学学报,2020,37(9):1747-1752.
[22] 胡思茂.黄芪桂枝五物汤合苍耳子散治疗过敏性鼻炎临床疗效及对免疫功能的影响[D].福州:福建中医药大学,2018.
[23] EIFAN A O,DURHAM S R. Pathogenesis of rhinitis[J].Clin Exp Allergy,2016,46(9):1139-1151.
[24] KIM E H,KIM J H,SAMIVEL R,et al. Intralymphatic treatment of flagellin-ovalbumin mixture reduced allergic inflammation in murine model of allergic rhinitis[J]. Allergy,2016,71(5):629-639.
[25] BUI T T,PIAO C H,HYEON E,et al. Preventive effect of bupleurum chinense on nasal inflammation via suppressing T helper type 2,eosinophil and mast cell activation[J]. Am J Chin Med,2019,47(2):405-421.
[26] ALMEIDA-OLIVEIRA A R,AQUINO-JUNIOR J,ABBASI A,et al. Effects of aerobic exercise on molecular aspects of asthma:involvement of SOCS-JAK-STAT[J]. Exerc Immunol Rev,2019,25:50-62.
[27] WANG J,SHEN Y,LI C,et al. IL-37 attenuates allergic process via STAT6/STAT3 pathways in murine allergic rhinitis[J]. Int Immunopharmacol,2019,69:27-33.
[28] WANG T,CHEN D,WANG P,et al. MiR-375 prevents nasal mucosa cells from apoptosis and ameliorates allergic rhinitis via inhibiting JAK2/STAT3 pathway[J]. Biomed Pharmacother,2018,103:621-627.
[29] XU Z,WU H,ZHANG H,et al. Interleukins 6/8 and cyclooxygenase-2 release and expressions are regulated by oxidative stress-JAK2/STAT3 signaling pathway in human bronchial epithelial cells exposed to particulate matter ≤2.5 μm[J]. J Appl Toxicol,2020,40(9):1210-1218.
[30] KWON B I,KIM T W,SHIN K,et al. Enhanced Th2 cell differentiation and function in the absence of Nox2[J]. Allergy,2017,72(2):252-265.
[31] KIM H J,LIM J,JANG Y,et al. Exogenous hydrogen pe- roxide induces lipid raft-mediated STAT-6 activation in T cells[J]. Cell Physiol Biochem,2017,42(6):2467-2480.
[32] GILLJAM K M,HOLM K L,ZAHOOR M,et al. Dif- ferential effects of reactive oxygen species on IgG versus IgM levels in TLR-stimulated B cells[J]. J Immunol,2020,204(8):2133-2142.
[33] RAMIREZ-MORENO I G,IBARRA-SANCHEZ A,CASTILLO-ARELLANO J I,et al. Mast cells localize in hypoxic zones of tumors and secrete CCL-2 under hypoxia through activation of L-type calcium channels[J]. J Immunol,2020,204(4):1056-1068.
[34] YU S,ZHAO C,CHE N,et al. Hydrogen-rich saline at- tenuates eosinophil activation in a guinea pig model of allergic rhinitis via reducing oxidative stress[J]. J Inflamm,2017,14(1):1.
(收稿日期:2020-12-26 修回日期:2021-03-25)
(編辑:邹丽娟)
