小鼠睾丸、附睾和前列腺组织细胞外囊泡蛋白质组分的鉴定及功能分析
2021-07-06袁业锋李海雁冯雅琴
孙 欣,袁业锋,李海雁,冯雅琴
(1山西医科大学 组织胚胎学教研室,山西 太原 030001;2首都医科大学 附属北京儿童医院, 北京 100045)
细胞外囊泡(extracellular vesicles,EVs)是动物体内外几乎所有细胞均可释放的膜性小泡,携带有多种蛋白质、核酸和脂质等分子,可以靶向运输给受体细胞,改变受体细胞的功能[1-2]。目前认为EVs主要包括外泌体(exosomes)和微泡(microvesicles,MVs)。外泌体是由细胞内多泡体与细胞膜融合后,将多泡体腔内小泡释放至细胞外而形成的,直径在40~150 nm;微泡是细胞以出芽方式脱落至细胞外的小泡,直径在50~1 000 nm。外泌体和微泡虽然发生方式不同,但其大小、形态及内容物相近,目前富集囊泡的方法很难将二者严格分开[3]。EVs广泛存在于多种体液中,因容易获得且能携带来源细胞的特异分子,所以在疾病的发病机制研究及诊断治疗方面有重要的价值[2-3]。
近几年,有关精液EVs在精子发育成熟方面的作用研究越来越多。精子在睾丸中生成,离开睾丸后功能进一步成熟。精子形成后基本失去蛋白合成功能,所以精子与精子外蛋白分子之间的相互作用就显得非常重要,而精液EVs是精子外蛋白分子的重要提供者[2,4-5]。精液EVs主要来源于睾丸、附睾、前列腺等器官[6]。目前对睾丸组织EVs的研究报道较少。附睾组织EVs又称附睾小体(epididymosomes),主要由附睾上皮细胞通过顶浆分泌释放到附睾腔中[4]。 精子在附睾中贮存时间较长,期间获得向前运动能力和受精潜能,所以精子通过与附睾小体之间的相互作用获得成熟所需的分子显得尤为重要,相关研究报道也较多[5,7]。 前列腺组织EVs又称前列腺小体(prostasomes),主要来源于腺上皮细胞中的多泡体,在调节精子活力、防止过早或自发的顶体反应、免疫调节及抗氧化等方面发挥着重要作用[5,8]。在体外培养的微酸性环境中,精子与前列腺小体融合,可使精子细胞膜的流动性下降[7-9]。因此,前列腺组织EVs功能破坏可能会导致生育能力下降。
目前,有关精液EVs的研究多集中在牛、羊等动物和人类上[10-13],而对于小鼠这种模式生物的报道相对较少。因此,本试验以小鼠为研究对象,分别富集其睾丸、附睾和前列腺组织的EVs,用液相色谱串联质谱法(LC-MS/MS)分析3种EVs的蛋白质组分,并进行GO(gene ontology)富集分析,旨在了解睾丸、附睾和前列腺组织EVs的蛋白成分及其可能的功能,为通过精液总的EVs分析来推断EVs来源器官的功能是否正常及体外精子保存提供试验基础。
1 材料与方法
1.1 材 料
健康成年雄性C57BL/6J小鼠,由中国科学院遗传与发育生物学研究所动物中心饲养(合格证号:KYD2005-006)。Total Exosome Isolation(from other body fluids),为invitrogen公司产品;牛血清白蛋白(bovine serum albumin,BSA),为Biotopped公司产品;蛋白酶抑制剂(protease inhibitor cocktail,PI),为Sigma-Aldrich公司产品;兔Calnexin抗体,为abcam公司产品;小鼠CD63抗体,为BD公司产品;兔TSG101抗体,为ABclonal公司产品;各种HRP标记的二抗,均为中杉金桥生物技术有限公司产品;乙酸双氧铀,为上海吉至生化科技有限公司产品。透射电子显微镜(日本JEOL公司,JEM-1400),由中国科学院遗传与发育生物学研究所分子发育生物学国家重点实验室细胞生物学平台提供;动态光散射粒径分析仪(英国马尔文公司,Nano ZS90),由中国科学院高能物理研究所提供;质谱检测所用试剂、仪器,均由北京博奥晶典生物技术有限公司提供。
1.2 EVs的分离与纯化
本研究中所有试验方案均经中国科学院遗传与发育生物学研究所动物伦理委员会批准。采用总外泌体分离试剂盒(total exosome isolation,TEI)分离小鼠睾丸、附睾和前列腺组织EVs。取成年(3~4月龄)健康雄性C57BL/6J小鼠,用CO2麻醉后迅速取睾丸、附睾和前列腺组织,在4 ℃预冷的PBS中漂洗以减少血液污染,睾丸去掉白膜。更换新鲜PBS,用眼科剪将每种组织剪成2~6块,使用巴氏吸管轻柔地将组织吹散开。收集组织悬液,4 ℃下2 000g离心30 min,将上清移到新的EP管中,4 ℃下10 000g离心30 min,再将所得上清移到新的EP管中,加入0.2倍上清体积的TEI分离试剂,室温静置30 min,4 ℃下10 000g离心1 h,弃上清,沉淀即为EVs,重悬备用。单次试验收集睾丸组织EVs需1只雄鼠,附睾组织EVs需3只雄鼠,前列腺组织EVs需7只雄鼠,试验重复3次。
1.3 EVs的鉴定
分化抗原63(cluster differentiation antigen 63,CD63)是一种4次跨膜的蛋白,是外泌体的一种常用标记蛋白;肿瘤易感基因101(tumor susceptibility gene 101,TSG101)也是外泌体的一种常见标记蛋白,也可作为arrestin结构域蛋白1(arrestin domain-containing protein 1,ARRDC1)介导的微泡的一种标记物[14]。钙联结蛋白(calnexin)则是内质网的一种标记蛋白,经常作为外泌体纯化的阴性对照。
用免疫印迹对分离的EVs进行鉴定。向睾丸、附睾、前列腺组织及其EVs中分别加入RIPA裂解液(50 mmol/L Tris-HCl,pH 7.4,150 mmol/L NaCl,10 g/L NP-40,5 g/L脱氧胆酸钠,1 g/L SDS),RIPA裂解液使用前加体积分数1%的PI(成分为AEBSF、抑肽酶、乌苯美司、E-64、亮抑酶肽和抑肽素A),组织用超声研磨仪研磨1 min,直至无肉眼可见的组织碎块,4 ℃下12 000 r/min离心15 min,取上清;EVs与裂解液混匀冰上静置20 min。测蛋白浓度,加入6×loading,97 ℃变性20 min,备用。对上述组织和EVs样品进行12% SDS-PAGE电泳,组织蛋白上样量10 μg,EVs蛋白上样量30 μg。电泳结束后95 V转膜2 h,30 g/L BSA封闭2 h,4 ℃下用一抗(Calnexin、CD63和TSG101抗体,其稀释倍数均为1∶1 000)孵育过夜,室温下用二抗(1∶5 000稀释)孵育1.5 h,ECL发光,曝光观察。试验重复3次。
1.4 EVs的透射电镜观察
将8 μL EVs的PBS悬液(睾丸和附睾组织EVs用140 μL PBS重悬,前列腺组织EVs用70 μL PBS重悬)滴在经辉光放电仪处理过的铜网上,吸附20 min,滤纸吸走多余液体。再用超纯水滴漂洗1~3次。10 g/L乙酸双氧铀染色1 min,用滤纸吸去多余染液,自然晾干,在80 kV、JEM-1400透射电子显微镜下观察。
1.5 EVs的直径分析
采用动态光散射粒径分析法(dynamic light scattering,DLS)测定EVs的直径。将纯化得到的EVs用1 mL PBS重悬,分别添加到比色杯中,平衡2 min后测量。重复测量3次,使用仪器自带软件将DLS信号强度转换为EVs直径。
1.6 EVs蛋白质组分分析
用适量PBS重悬EVs,裂解后进行聚丙烯酰胺凝胶电泳、考马斯亮蓝染色,取凝胶条带进行脱色、还原、碘乙酰化和胰酶酶切,酶切后的蛋白多肽真空浓缩抽干。将肽段溶解后上样到柱子中。移动相组成A(体积分数0.1%甲酸水溶液)和B(体积分数0.1%甲酸乙腈溶液),洗脱程序:体积分数(下同) 97%~92% A,3%~8% B,4 min;92%~80% A,8%~20% B,33.5 min;80%~75% A,20%~25% B,8.5 min;75%~70% A,25%~30% B,2 min;70%~20% A,30%~80% B,1 min;20% A,80% B,5 min;20%~97% A,80%~3% B,0.5 min;97% A,3% B,10.5 min;流速300 nL/min。质谱全扫描范围350~1 600 m/z。离子强度TOP25的母离子碎裂进行二级质谱序列测定,生成质谱检测原始文件。质谱检测原始文件使用Proteome Discoverer软件与NCBI小鼠蛋白质组数据库进行搜库计算分析,生成软件计算结果文件。软件计算结果保留结果可靠的多肽和蛋白,生成质谱鉴定结果文件。质谱鉴定结果中选择≥2条不同的unique肽段的蛋白进行后续分析。用DAVID 6.8在线软件对所得蛋白进行GO富集分析时,以count值为2、EASE 0.05为阈值。
2 结果与分析
2.1 睾丸、附睾和前列腺组织EVs的纯化与鉴定
由图1可知,采用TEI法分离纯化的睾丸、附睾和前列腺组织EVs均可检测到CD63和TSG101标记蛋白,表明EVs分离成功。
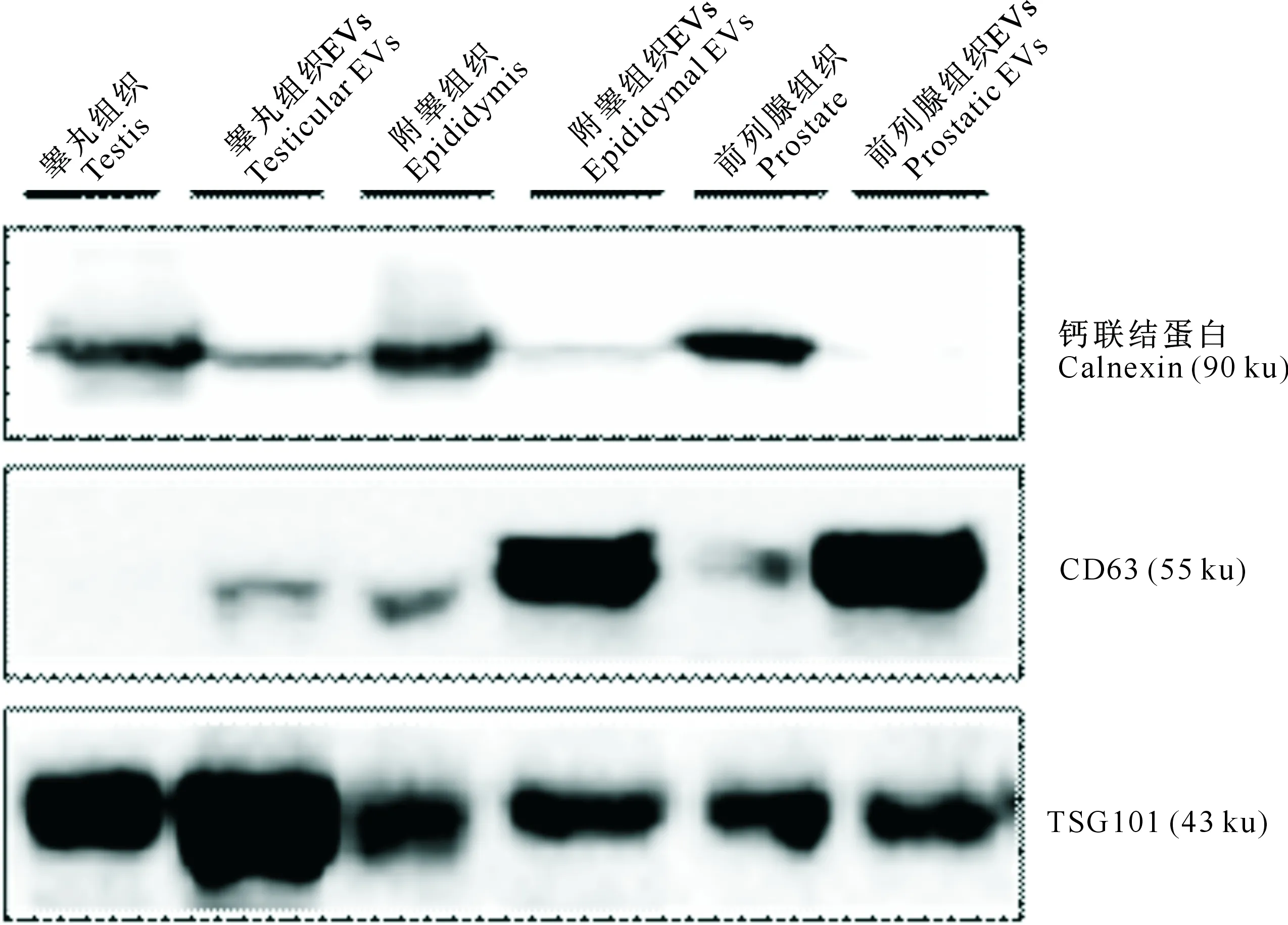
图1 小鼠睾丸、附睾和前列腺组织EVs标记蛋白的免疫印迹分析Fig.1 Immunoblot analysis of EV markers in mouse testicular,epididymal and prostatic EVs
2.2 睾丸、附睾和前列腺组织EVs的电镜观察与直径分布
透射电镜观察结果(图2)显示,小鼠睾丸、附睾和前列腺组织的EVs多呈凹杯状,睾丸和附睾标本中大小EVs均可见到,前列腺标本中则以小EVs多见。
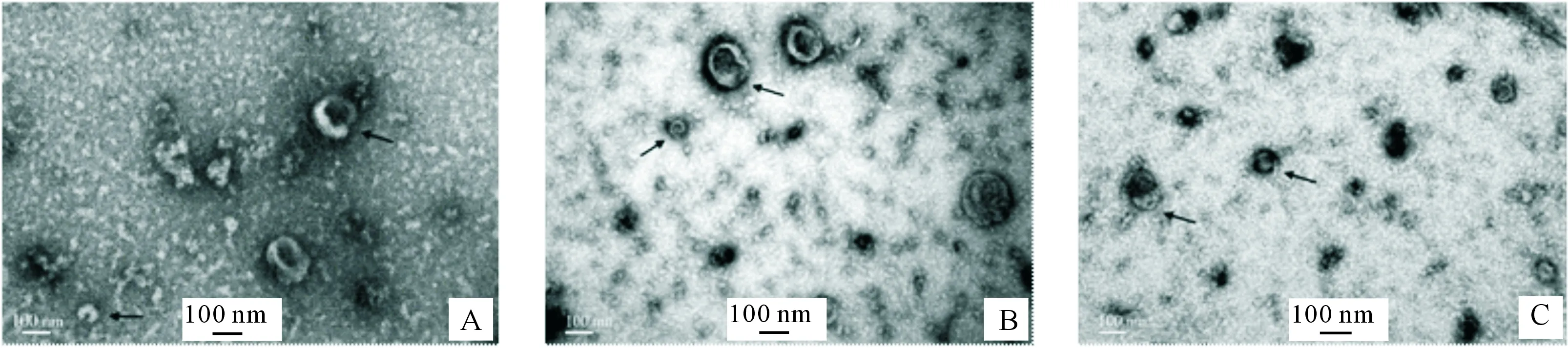
A.睾丸组织EVs;B.附睾组织EVs;C.前列腺组织EVs。箭头标示EVs,标尺示100 nmA.Testicular EVs;B.Epididymal EVs;C.Prostatic EVs.Arrows indicate the EVs.Scale bar=100 nm
为了进一步明确睾丸、附睾和前列腺组织的EVs直径分布,用DLS对睾丸、附睾和前列腺组织EVs样品进行测量,结果(图3)显示,睾丸组织EVs的直径分布于13~458 nm,其中以直径30~140 nm的EVs数量居多;附睾组织EVs直径分布于13~255 nm,其中以直径30~165 nm的EVs数量居多,峰值在105 nm左右;前列腺组织EVs直径分布于7~220 nm,其中以直径40~120 nm的EVs数量居多,在50和90 nm左右各有一个峰值,在7~28 nm处还集中分布有一群小EVs。 EVs的DLS直径分布结果与电镜观察到的结果基本一致,表明睾丸、附睾和前列腺组织EVs的大小分布有一定的差异。
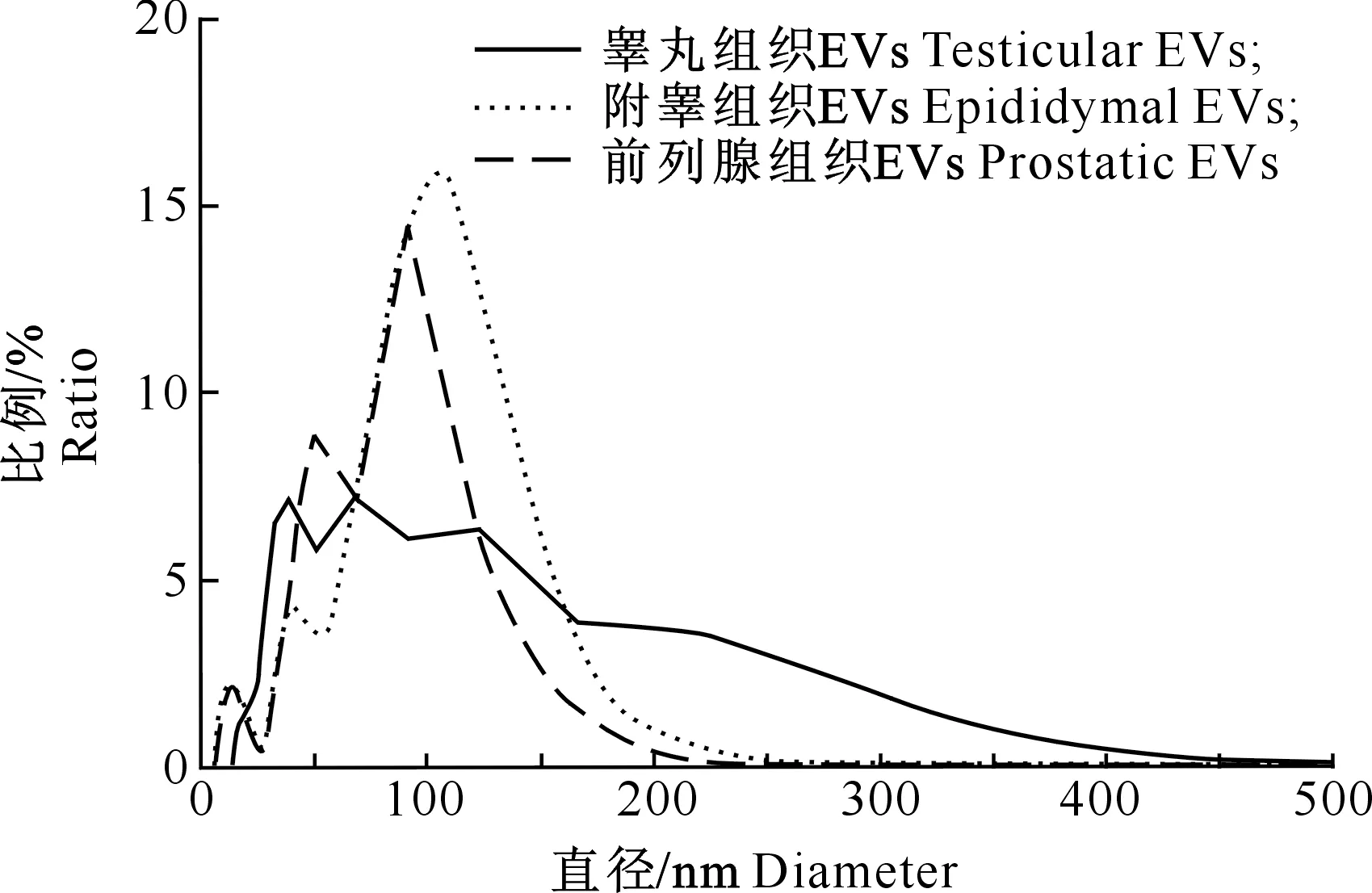
图3 小鼠睾丸、附睾和前列腺组织EVs的直径分布Fig.3 Diameter distribution of mouse testicular,epididymal and prostatic EVs
2.3 睾丸、附睾和前列腺组织EVs的蛋白质组分鉴定
睾丸、附睾和前列腺组织EVs蛋白质组分分析结果显示,睾丸组织EVs中有1 148种蛋白,其中特有蛋白667种;附睾组织EVs中有902种蛋白,其中特有蛋白311种;前列腺组织EVs中有651种蛋白,其中特有蛋白142种。这些蛋白中睾丸与附睾组织EVs共有的蛋白有143种,附睾与前列腺组织EVs共有的蛋白有171种,睾丸与前列腺组织EVs共有的蛋白有61种,睾丸、附睾和前列腺组织EVs共有的蛋白有277种。将本研究质谱结果与外泌体数据库ExoCarta比对,结果发现睾丸组织EVs蛋白中有334种属于已报道的小鼠外泌体蛋白,占蛋白总数的29%(334/1 148);附睾组织EVs蛋白中有334种属于已报道的小鼠外泌体蛋白,占蛋白总数的37%(334/902);前列腺组织EVs蛋白中有285种属于已报道的小鼠外泌体蛋白,占蛋白总数的44%(285/651)。用DAVID 6.8在线软件对所得EVs 蛋白进行GO细胞组分富集分析,结果(图4)发现,睾丸组织EVs蛋白有359种分布在外泌体中,占蛋白总数的31% (359/1 148);附睾组织EVs蛋白有434种分布在外泌体中,占蛋白总数的48%(434/902);前列腺组织EVs蛋白有336种分布在外泌体中,占蛋白总数的52% (336/651)。DAVID 6.8在线软件分析结果与使用ExoCarta数据库分析的结果基本一致。

A.睾丸组织EVs;B.附睾组织EVs;C.前列腺组织EVs A.Testicular EVs;B.Epididymal EVs;C.Prostatic EVs图4 小鼠睾丸、附睾和前列腺组织EVs蛋白细胞组分的GO分析(count值排列前4项的结果)Fig.4 GO analysis of mouse testicular,epididymal and prostatic EVs proteins (top 4)
2.4 睾丸、附睾和前列腺组织EVs共有蛋白的分子功能、生物学过程和细胞组分分析
用DAVID 6.8在线分析软件对睾丸、附睾和前列腺组织三者共有的277种蛋白进行GO分子功能、生物学过程和细胞组分富集分析,结果见表1~3。
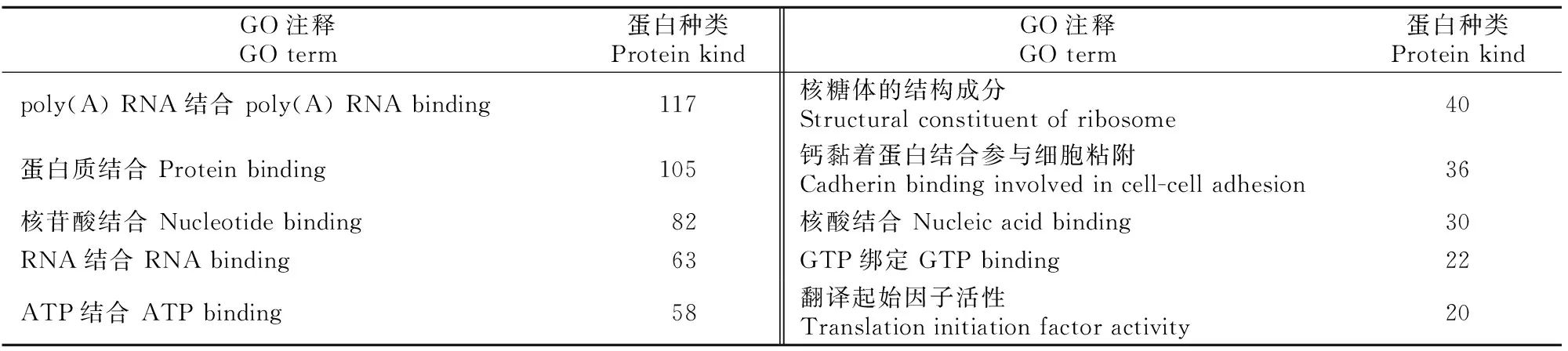
表1 小鼠睾丸、附睾和前列腺组织EVs共有蛋白的分子功能分析Table 1 Molecular function of mouse testicular,epididymal and prostatic EVs common proteins
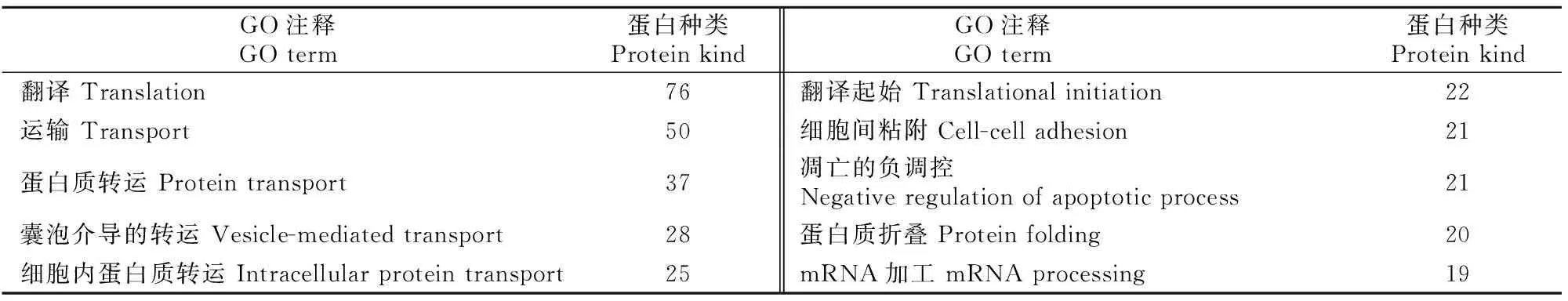
表2 小鼠睾丸、附睾和前列腺组织EVs共有蛋白的生物学过程分析Table 2 Biological process of mouse testicular,epididymal and prostatic EVs common proteins
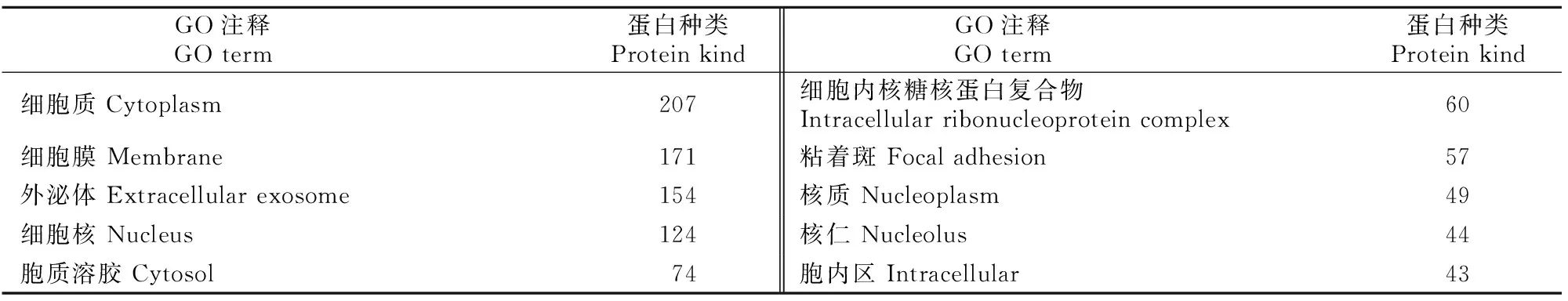
表3 小鼠睾丸、附睾和前列腺组织EVs共有蛋白的细胞组分分析Table 3 Cellular component of mouse testicular,epididymal and prostatic EVs common proteins
分子功能分析结果(表1)显示,3种组织EVs共有蛋白主要发挥poly(A) RNA结合、蛋白质结合、核苷酸结合、RNA结合、ATP结合等分子功能。生物学过程分析结果(表2)显示,3种组织EVs共有蛋白主要参与翻译、广义的运输、蛋白质转运等生物学过程。细胞组分分析结果(表3)显示,有207种蛋白来自细胞质,171种蛋白来自细胞膜,154种蛋白来自外泌体,124种来自细胞核,来自其他细胞组分的蛋白种类相对较少。
2.5 睾丸组织EVs特有蛋白的细胞组分、分子功能和生物学过程分析
使用DAVID 6.8在线分析软件对睾丸组织EVs特有的667种蛋白进行GO细胞组分、分子功能和生物学过程富集分析,结果见表4。
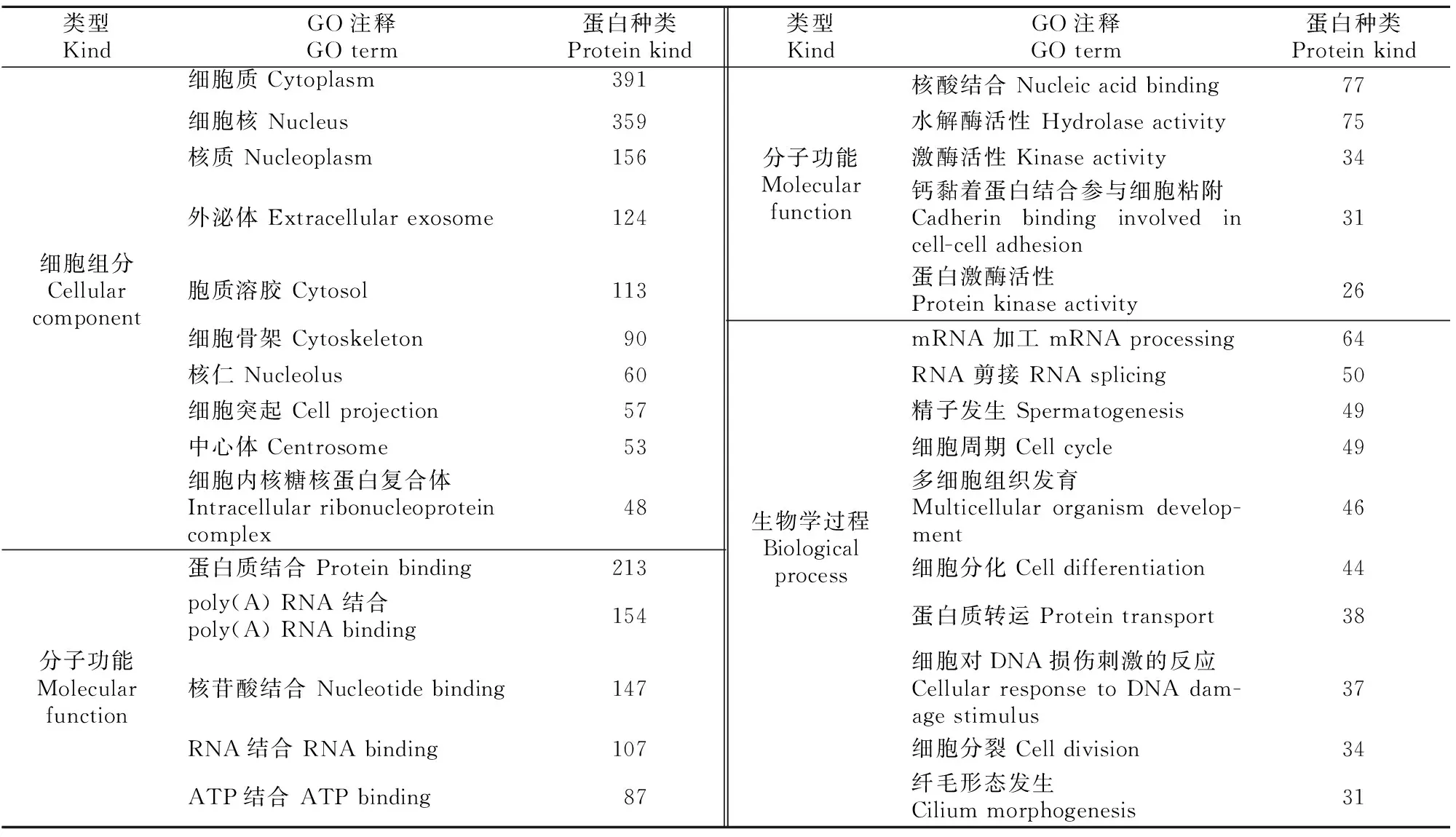
表4 小鼠睾丸组织EVs特有蛋白GO分析(count值排列前10项的结果)Table 4 GO analysis of mouse testicular EVs specific proteins (top 10)
表4显示,睾丸组织EVs特有蛋白有391种来自细胞质,359种来自细胞核,124种来自外泌体;主要发挥蛋白质结合、RNA结合、核苷酸结合、ATP结合、核酸结合等分子功能;主要参与mRNA加工(64种)、RNA剪接(50种)、精子发生(49种)、细胞周期(49种)和细胞对DNA损伤刺激的反应(37种)等生物学过程。
2.6 附睾组织EVs特有蛋白的细胞组分、分子功能和生物学过程分析
使用DAVID 6.8在线分析软件对附睾组织EVs特有的311种蛋白进行GO细胞组分、分子功能和生物学过程富集分析,结果(表5)显示,附睾组织EVs所携带的特有蛋白中,157种来自细胞膜,153种来自细胞质,118种来自在外泌体;主要发挥蛋白质结合、核苷酸结合、水解酶活性、转移酶活性、ATP结合等分子功能;主要参与运输(62种)、蛋白质转运(34种)、代谢(26种)、脂质代谢(23种)、氧化还原(22种)、蛋白水解(19种)和免疫过程(13种)等生物学过程。
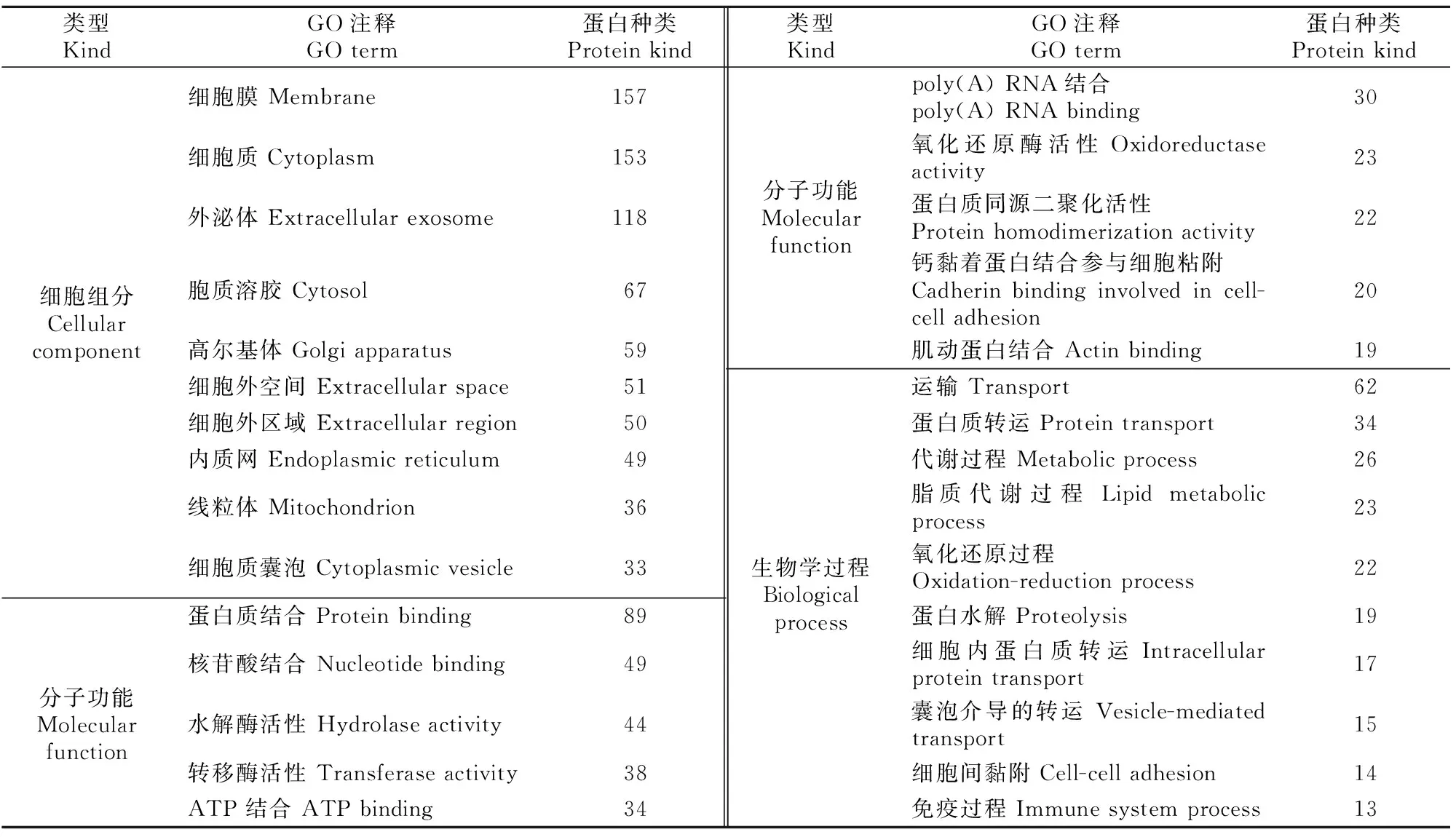
表5 小鼠附睾组织EVs特有蛋白GO分析(count值排列前10项的结果)Table 5 GO analysis of mouse epididymal EVs specific proteins (top 10)
2.7 前列腺组织EVs特有蛋白的细胞组分、分子功能和生物学过程分析
使用DAVID 6.8在线分析软件对前列腺组织EVs特有的142种蛋白进行GO细胞组分、分子功能和生物学过程富集分析,结果(表6)显示,前列腺组织EVs有71种分布在细胞质,59种分布在外泌体,26种分布在线粒体等处;主要发挥核苷酸结合、水解酶活性、poly(A) RNA结合、ATP结合等分子功能;主要参与代谢过程(20种)、氧化还原过程(15种)、细胞间粘附(10种)等生物学过程。
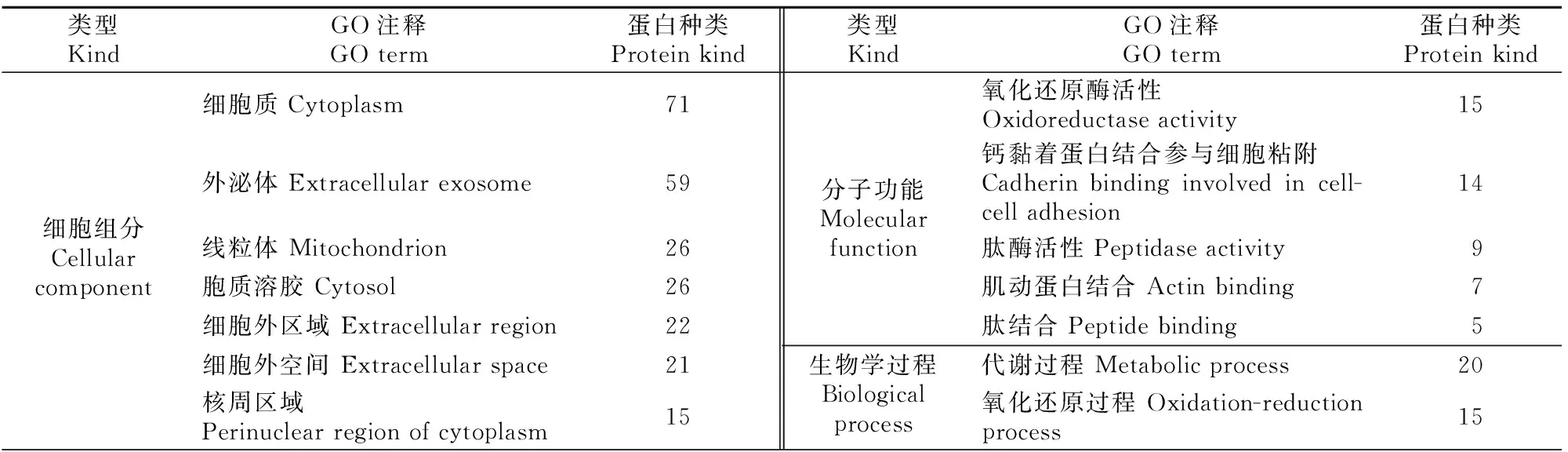
表6 小鼠前列腺组织EVs特有蛋白GO分析(count值排列前10项的结果)Table 6 GO analysis of mouse prostatic EVs specific proteins (top 10)

表6(续) Continued Table 6
3 讨 论
3.1 睾丸、附睾和前列腺组织EVs的形态和大小
本试验电镜和DLS结果均显示,来自小鼠睾丸、附睾和前列腺组织的EVs大小分布有差异。睾丸组织中以30~140 nm的囊泡数量居多;附睾组织EVs直径分布于13~255 nm,以直径105 nm左右的EVs数量最多。目前有关睾丸组织EVs的研究报道较少。有研究发现,牛附睾小体存在异质性,CD9+的附睾小体直径为20~150 nm,与活的精子结合;CD9-附睾小体的直径较大[15]。Ronquist[16]发现,人前列腺小体的大小分布在30~200 nm。本试验发现,小鼠前列腺组织EVs直径分布于7~220 nm,在50和90 nm左右各有一个峰值,在7~28 nm处还集中分布有一群小EVs。Aalberts等[17]根据囊泡大小将人的前列腺小体分为2个亚群:小的前列腺小体,直径为(56±13) nm,含己糖神经酰胺多;大的前列腺小体,直径为(105±25) nm,含鞘磷脂多。可见不同组织器官来源的EVs大小不同,同一组织来源的EVs大小也呈异质性表现,而且不同大小的EVs所携带的内容物可能存在差异,发挥的作用也可能不同。
3.2 睾丸、附睾和前列腺组织EVs的功能分析
精子在睾丸中发生,经历精原细胞的分裂增殖、精母细胞的减数分裂和精子细胞的形态改变等阶段。在本研究结果中,睾丸组织EVs特有蛋白富集最多的10个生物学过程中,有5个涉及到精子发生、细胞周期、细胞分裂和分化生物学过程。生殖细胞发育过程中RNA结合蛋白可以调节转录后基因的表达。YBX蛋白(Y-box protein)是一类多功能RNA结合蛋白,可参与mRNA的转录、剪接和稳定性的维持。有研究发现,YBX1突变会导致胚胎死亡;YBX2、YBX3突变可导致精母细胞和精子细胞凋亡数增加、精子细胞变形时细胞核浓缩失败、精子分化缺陷及精子数量减少[18-19]。YBX1与RNA结合,协助某些RNA分子到外泌体中[20]。本研究在睾丸组织EVs质谱分析中发现了YBX1、YBX2和YBX3,这提示睾丸组织EVs可能在精子发生过程中发挥一定作用。
精子形成后很少进行转录翻译,其功能进一步成熟所需的蛋白质主要依赖生殖管道的微环境供给[21]。附睾有较强的蛋白质合成及分泌功能[22],可以通过附睾小体携带一些蛋白质转运给精子,对其腔内精子的成熟及活性保持具有重要作用。本研究在附睾EVs中筛选到5型谷胱甘肽过氧化物酶(GPX5),其是附睾EVs特有的一种蛋白,由附睾头部分泌,被附睾小体转移到精子表面,可能防止精子过早发生顶体反应[23]。GPX5在保持精子DNA完整性、防止活性氧损伤精子中也发挥着一定作用[5]。乳脂球表皮生长因子(MFGE8)是一种细胞外囊泡标记物,同时也存在于附睾小体中,用抗MFGE8的抗体孵育附睾小体后,可减少附睾小体与精子之间的蛋白质转运[21]。MFGE8可介导精子与卵子的初始粘附[24-25]。这提示附睾组织EVs蛋白在精子活力保持及受精能力的获得中发挥着一定的作用。
本试验中前列腺组织EVs蛋白分子功能富集分析结果显示,这些蛋白具有水解酶、氧化还原酶和肽酶等多种酶活性。有研究报道蛋白质二硫键异构酶(PDI)家族可催化细胞中二硫键的形成、还原和重排,在调节硫醇-二硫键交换中较为重要,精子表面有蛋白二硫键异构酶家族A3(PDIA3)的表达[26]。PDIA3可使免疫球蛋白超家族精卵融合蛋白1(Izumo1)、分化抗原9(CD9)或富含半胱氨酸分泌蛋白(CRISPs)的构象发生变化,从而诱导精子膜与卵子膜融合[27]。本研究在前列腺组织EVs中也检测到PDIA3,这提示前列腺小体可能转运PDIA3到精子表面,从而调节精子的受精能力。
3.3 小样本组织中EVs的分离纯化
为明确各器官来源的EVs的成分,需要直接从器官组织中分离纯化EVs。最近有从脑组织[28]和附睾组织[21]中纯化EVs的报道。目前常用分离囊泡的方法有差速离心、免疫磁珠、超滤、TEI等,前三者尽管所得囊泡的纯度较高,但样品需求量大,得率低。TEI法简单快速,可以从小样本中获取足量囊泡,但其获得的囊泡纯度不高[1,29]。本研究曾尝试使用经典的差速离心法分离纯化EVs,但发现该法对于前列腺组织很难得到试验所需的EVs量。因不同的分离方法得到的囊泡大小及种类不尽相同,为了便于比较3种组织来源的EVs蛋白,最终选择了得率较高的TEI法进行试验,结果证实通过此法较易从组织中获得EVs,电镜和DLS结果提示所得囊泡直径变化范围较大,这与文献[30]的报道一致。所以对于某些繁殖力较低的突变小鼠,用TEI法可解决小样本收集足量EVs的问题。在EVs分离过程中,很难避免因少量细胞破裂而释放一些胞内蛋白成分,这是直接从组织中分离囊泡面临的一个共同问题,因此操作时手法应尽量轻柔,并且后续对感兴趣的蛋白应进行验证性试验。
总之,本试验获得的数据不仅丰富了人们对小鼠睾丸、附睾和前列腺组织EVs蛋白质的认识,更重要的是通过对各自特有蛋白质的分析,为研究精子发育成熟的机制提供了参考。当然,鉴于本试验方法和技术手段的限制,所获得的蛋白信息仍需进一步的试验来验证。
