免疫细胞在牦牛附睾和输精管的分布规律
2022-07-07余四九何俊峰潘阳阳
张 倩,崔 燕,余四九,何俊峰,潘阳阳,王 萌
(甘肃农业大学动物医学院,兰州 730070)
附睾是促进精子发育、成熟以及贮藏精子的器官,包含附睾头、附睾体和附睾尾,输精管是运输精子的管道。附睾管和输精管均由假复层上皮构成,管道之间是间质,富含免疫细胞、血管和淋巴管等。哺乳动物附睾易受细菌、病毒和真菌等病原体感染,如附睾受大肠杆菌和衣原体感染后,引起附睾炎和输精管阻塞,局部免疫稳态被打破,可能会影响精子成熟和运动,导致生殖障碍,降低雄性生育力。牦牛()是青藏高原典型的土著动物之一,也是当地牧民获取奶、肉、皮等畜产品的重要来源。低氧和寒冷是高原地区最重要的胁迫因素,此外,牦牛的繁殖性能较低,为2年1胎或3年2胎。因此,了解健康雄性牦牛生殖组织的局部免疫状态, 对预防其感染和防治具有重要意义。
免疫细胞不仅能够维持雄性生殖道精子耐受,而且能够参与生殖系统抗感染免疫。T淋巴细胞是介导细胞免疫的主要效应细胞,B淋巴细胞能够分化为浆细胞,产生抗体并介导体液免疫反应,同时,巨噬细胞可能在附睾和输精管内的免疫调节中发挥作用,并负责吞噬衰老和过量的精子。目前,免疫细胞在雄性生殖道的分布研究在牛、小鼠和人类均有报道,而有关免疫细胞在雄性牦牛生殖道的表达研究较少,本团队前期对牦牛睾丸的免疫细胞分布特征进行了研究(数据未发表),在此基础上,本研究运用qRT-PCR和免疫组织化学法,分析CD68巨噬细胞、CD3T淋巴细胞、CD79αB淋巴细胞、IgA和IgG浆细胞在牦牛附睾和输精管的分布及其表面标志分子的表达水平,以期了解它们在牦牛附睾和输精管的表达情况,从而推测其相关局部免疫功能,为进一步研究牦牛附睾和输精管局部病理及防治奠定基础。
1 材料与方法
1.1 样品收集
试验动物来自西宁屠宰场的健康幼龄(5~6月龄)和成年(3~4岁)雄牦牛,各5头份,采集左侧附睾(头、体和尾)和输精管,免疫组织样品固定于 4%的中性多聚甲醛溶液,qRT-PCR样品存放于液氮,之后转至-80 ℃冰箱备用。
1.2 qRT-PCR
1.2.1 不同年龄牦牛附睾和输精管总RNA提取及反转录 使用 TRIzol试剂(Invitrogen)从牦牛附睾和输精管组织提取总RNA,使用分光光度计测定提取总RNA浓度和纯度(OD/OD=1.8~2.0)。根据cDNA 逆转录试剂盒说明书,使用特异性引物逆转录总RNA。
1.2.2 基因引物的合成 qRT-PCR 引物参考GenBank 中牦牛()3ε、79α、、、68和-基因序列设计的。采用 Primer Premier 5.0 软件设计,并由 TaKaRa公司(大连)合成, qRT-PCR 引物序列和基因序列号如表1所示。
1.3 免疫组织化学
1.3.1 抗体 CD3单克隆抗体(rabbit anti-CD3,ab16669)、CD79α单克隆抗体(mouse anti CD79α,ab199001)、IgA多克隆抗体(rabbit anti- IgA,ab112630)和 IgG多克隆抗体(rabbit anti- IgG,ab6692)购自英国Abcam公司,CD68多克隆抗体(rabbit anti- CD68,252281)购自美国Abbiotec公司。以上抗体均已进行特异性验证,适用于牦牛后续研究。
1.3.2 免疫组织化学检测 石蜡切片贴于免疫组化防脱切片上,60 ℃烘片3~5 h,切片脱蜡至水,蒸馏水浸泡5 min,PBS浸泡5 min。一抗(见“1.3.1”)均按1∶200稀释,4 ℃冰箱孵育过夜,生物素化二抗室温孵育10 min,SABC复合物室温孵育10 min。以上各步骤之间均用0.01 mol·L PBS, pH 7.3洗3 min ×3 次。DAB显色,经苏木精复染、分化和返蓝,最后脱水、透明并用中性树胶封片。空白对照用0.01 mol·LPBS代替一抗,棕黄色为阳性表达。显微镜下观察CD68巨噬细胞、CD3T淋巴细胞、CD79αB淋巴细胞、IgA和 IgG浆细胞的分布位置,并通过Image-Pro Plus图像分析系统观察分析上述蛋白平均光密度值。

表1 目的基因及内参基因引物序列
1.4 数据统计
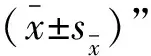
2 结 果
2.1 牦牛附睾和输精管内CD68、CD3ε、CD79α、IgA和IgG mRNA水平
qRT-PCR结果显示,各年龄组牦牛附睾和输精管内3ε和68 mRNA水平在附睾头最高(<005), 之后是附睾体,附睾尾和输精管的转录水平较低(图1A、B);另外,79α、和mRNA水平在输精管和附睾尾显著高于附睾体(<0.05), 附睾头mRNA水平最低(<0.05)(图1C~E)。 此外,在同一部位,3ε、79α、、和68 mRNA水平在成年牦牛显著高于幼龄牦牛(<005)(图1A~E)。
2.2 牦牛附睾和输精管内CD68+、CD3+、CD79α+、IgA+和 IgG+细胞分布
2.2.1 分布 CD68巨噬细胞(图2)、CD3T淋巴细胞(图3)、CD79αB淋巴细胞(图4)、IgA(图5)和 IgG(图6)浆细胞均主要分布在幼龄和成年牦牛的附睾头、体、尾部和输精管的上皮和间质,阳性产物主要定位在上述免疫细胞的胞质。
2.2.2 光密度分析 光密度分析显示,CD68和CD3蛋白水平在幼龄和成年牦牛的附睾头最高(<0.05), 随后是附睾体,在附睾尾和输精管较低。而CD79α、IgA和 IgG蛋白水平在幼龄和成年牦牛的输精管和附睾尾显著高于附睾头和附睾体(<005)。此外,成年牦牛的附睾和输精管内的CD68、CD3、CD79α、IgA和 IgG蛋白水平均显著高于幼龄牦牛(<005)(图7)。
3 讨 论
附睾和输精管内的免疫细胞在防御病原体和精子耐受方面发挥着重要作用。本研究关注了免疫细胞在幼龄和成年牦牛附睾头、附睾体、附睾尾和输精管的分布,并检测了这些细胞表面标记物表达量的变化。
CD68是巨噬细胞的表面标记物,本研究发现同一年龄组牦牛附睾和输精管中,CD68 mRNA和蛋白水平在附睾头、附睾体、附睾尾和输精管呈下调趋势,这与前人的对牛和人类的研究结果一致,附睾头中含有丰富的巨噬细胞。Wang等报道附睾巨噬细胞主要参与构成血-附睾屏障,且一般情况下附睾头的屏障作用强于附睾尾和输精管。这提示牦牛附睾头含量较高的巨噬细胞可能与构成血-附睾屏障相关,为抵御外部病原及阻止精子抗原外逃提供了一定保障。另外,巨噬细胞可吞噬和消化精子降解产物,在局部通过释放如IL-1等可溶性因子参与并调节免疫应答过程中复杂的细胞间相互作用,也可发挥抗原提呈功能。Grigoryeva等发现,小鼠附睾头、附睾体及附睾尾黏膜上皮和间质内分布有巨噬细胞,这与本研究结果相似,幼龄和成年牦牛附睾头、附睾体、附睾尾及输精管都可见CD68巨噬细胞,散布于上皮和间质,提示附睾和输精管上皮和间质可能是巨噬细胞的主要靶点。

A.CD68; B. CD3ε; C. CD79α; D. IgA; E. IgG。不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)A.CD68; B. CD3ε; C. CD79α; D. IgA; E. IgG. Bars with different superscripts are significantly different (P<0.05), same letters mean no significant difference(P>0.05)图1 幼龄和成年牦牛附睾和输精管的免疫细胞表面标志分子mRNA水平Fig.1 The mRNA level of CD68, CD3ε, CD79α, IgA and IgG in the epididymis and vas deferens of juvenile and adult yaks
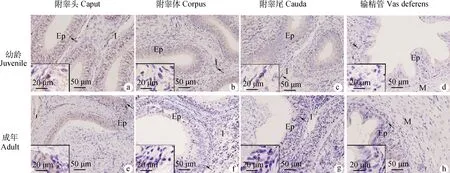
a~d.幼龄牦牛附睾头、附睾体、附睾尾和输精管; e~h. 成年牦牛附睾头、附睾体、附睾尾和输精管;箭头所示阳性细胞(棕色)。I.间质组织; Ep.上皮; M.肌层a-d. The caput, corpus, cauda epididymis and vas deferens of juvenile yaks. e-h. The caput, corpus, cauda epididymis and vas deferens of adult yaks. Arrowheads indicate examples of positive cells (brown). I. Interstitial tissue; EP. Epithelium; M. Muscularis图2 CD68+ 巨噬细胞在幼龄和成年牦牛附睾和输精管的免疫组化定位Fig.2 Immunohistochemical localization of CD68 positive macrophages in the epididymis and vas deferens of juvenile and adult yaks
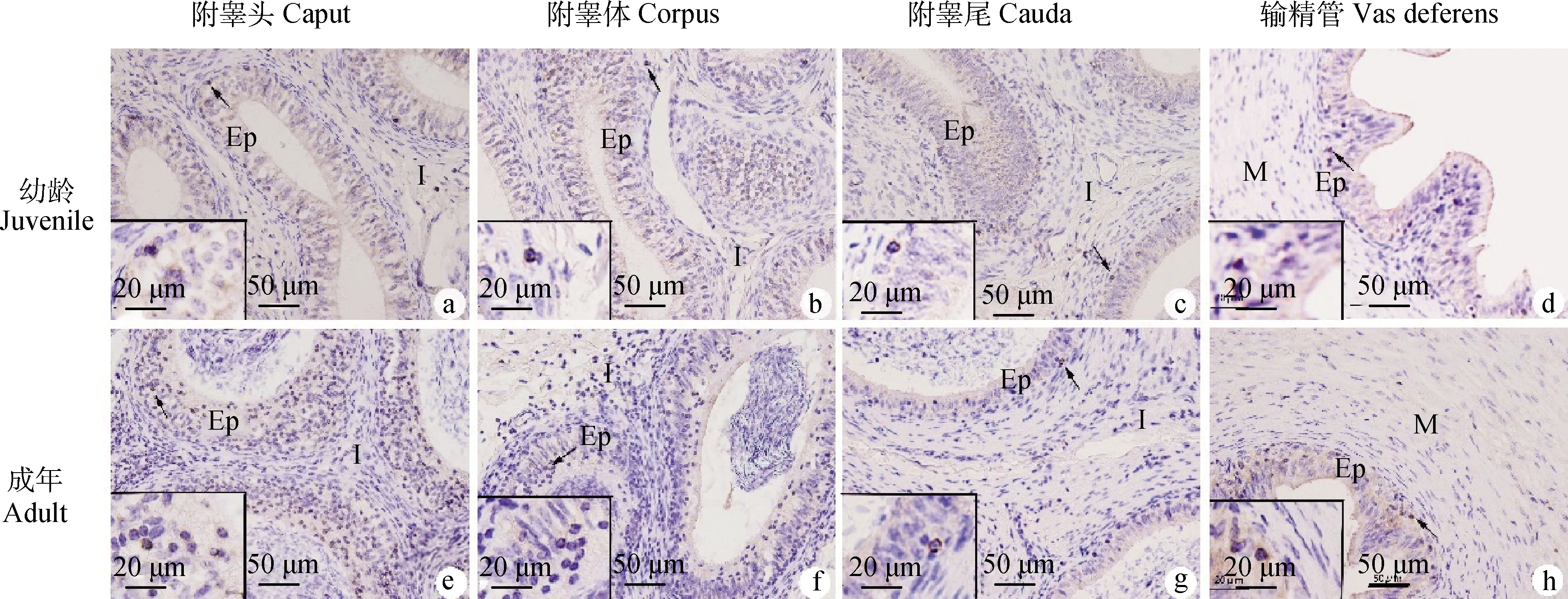
a~d.幼龄牦牛附睾头、附睾体、附睾尾和输精管; e~h. 成年牦牛附睾头、附睾体、附睾尾和输精管;箭头所示阳性细胞(棕色)。I.间质组织; Ep.上皮; M.肌层a-d. The caput, corpus, cauda epididymis and vas deferens of juvenile yaks. e-h. The caput, corpus, cauda epididymis and vas deferens of adult yaks. Arrowheads indicate examples of positive cells (brown). I. Interstitial tissue; Ep. Epithelium; M. Muscularis图3 CD3+ T淋巴细胞在幼龄和成年牦牛附睾和输精管的免疫组化定位Fig.3 Immunohistochemical localization of CD3 positive T lymphocytes in the epididymis and vas deferens of juvenile and adult yaks
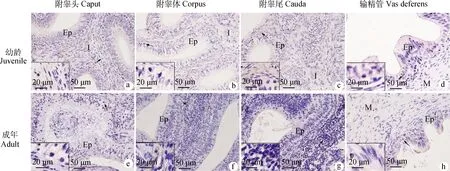
a~d.幼龄牦牛附睾头、附睾体、附睾尾和输精管; e~h. 成年牦牛附睾头、附睾体、附睾尾和输精管;箭头所示阳性细胞(棕色)。I.间质组织; Ep.上皮;M.肌层a-d. The caput, corpus, cauda epididymis and vas deferens of juvenile yaks. e-h. The caput, corpus, cauda epididymis and vas deferens of adult yaks. Arrowheads indicate examples of positive cells (brown). I. Interstitial tissue; Ep. Epithelium; M. Muscularis图4 CD79α+ B淋巴细胞在幼龄和成年牦牛附睾和输精管的免疫组化定位Fig.4 Immunohistochemical localization of CD79α positive B lymphocytes in the epididymis and vas deferens of juvenile and adult yaks
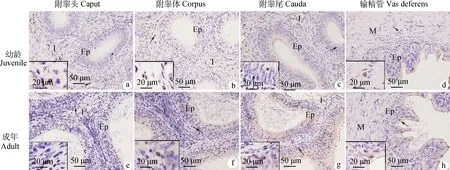
a~d.幼龄牦牛附睾头、附睾体、附睾尾和输精管; e~h. 成年牦牛附睾头、附睾体、附睾尾和输精管;箭头所示阳性细胞(棕色)。I.间质组织; Ep.上皮; M.肌层a-d. The caput, corpus, cauda epididymis and vas deferens of juvenile yaks. e-h. The caput, corpus, cauda epididymis and vas deferens of adult yaks. Arrowheads indicate examples of positive cells (brown). I. Interstitial tissue; Ep. Epithelium; M. Muscularis图5 IgA+ 浆细胞在幼龄和成年牦牛附睾和输精管的免疫组化定位Fig.5 Immunohistochemical localization of IgA positive plasmocytes in the epididymis and vas deferens of juvenile and adult yaks

a~d.幼龄牦牛附睾头、附睾体、附睾尾和输精管; e~h. 成年牦牛附睾头、附睾体、附睾尾和输精管;箭头所示阳性细胞(棕色)。I.间质组织; Ep.上皮;M.肌层a-d. The caput, corpus, cauda epididymis and vas deferens of juvenile yaks. e-h. The caput, corpus, cauda epididymis and vas deferens of adult yaks. Arrowheads indicate examples of positive cells (brown). I. Interstitial tissue; Ep. Epithelium; M. Muscularis图6 IgG+ 浆细胞在幼龄和成年牦牛附睾和输精管的免疫组化定位Fig.6 Immunohistochemical localization of IgG positive plasmocytes in the epididymis and vas deferens of juvenile and adult yaks

A.CD68; B. CD3ε; C. CD79α; D. IgA; E. IgG。不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)A.CD68; B. CD3ε; C. CD79α; D. IgA; E. IgG. Bars with different superscripts are significantly different (P< 0.05), same letters mean no significant difference(P>0.05)图7 幼龄和成年牦牛附睾和输精管的免疫细胞表面标志分子蛋白表达水平Fig.7 The expression level of CD68, CD3ε, CD79α, IgA and IgG protein in the epididymis and vas deferens of juvenile and adult yaks
CD3能够与T淋巴细胞受体(TCR)结合,在T细胞膜上形成一个CD3-TCR复合物,参与抗原识别和信号转导,并参与哺乳动物T细胞的成熟和激活,本研究选用CD3标记T淋巴细胞,结果显示同一年龄组牦牛附睾和输精管中,CD3 mRNA和蛋白水平在附睾头、附睾体、附睾尾和输精管依次下降,这与前人的研究结果一致,即附睾头T淋巴细胞比输精管丰富。Ritchie等报道上皮内T淋巴细胞具有细胞免疫和耐受功能,提示牦牛附睾头可能是T细胞发挥效应的主要位置。另外,本研究还显示CD3T淋巴细胞出现在幼龄和成年牦牛附睾及输精管上皮和间质区,这与CD68巨噬细胞的分布位置一样,Voisin等报道巨噬细胞和淋巴细胞之间的相互作用对抗原的摄取和免疫功能的发挥非常重要,推测附睾和输精管上皮和间质区巨噬细胞和T淋巴细胞可能存在活跃的相互作用。另外,本团队前期研究发现牦牛睾丸生精小管上皮无免疫细胞浸润,而在附睾上皮内经常观察到免疫细胞,可能由于血-附睾屏障相对血-睾屏障来说功能较弱。
CD79α在B淋巴细胞抗原受体信号转导、发育、稳定和功能中发挥关键作用。本研究选用CD79α标记牦牛附睾和输精管的B淋巴细胞,结果显示,不同于CD68和CD3ε,CD79α在附睾尾和输精管的表达量显著高于附睾头和体。Stern等报道病原体一般通过附睾尾进入并感染组织,推测牦牛附睾尾和输精管数量丰富的B淋巴细胞可能通过介导体液免疫,防止上行病原体感染附睾和睾丸。此外,本研究还在幼龄和成年牦牛附睾和输精管的上皮和间质检测到CD79αB淋巴细胞,这与T淋巴细胞和巨噬细胞相似。Tanaka等报道B细胞可以调节T淋巴细胞的分化和生存、募集,以及产生调节性和促炎细胞因子,提示牦牛附睾和输精管中的B淋巴细胞可能与其他免疫细胞互作,发挥调节局部免疫的功能。
IgG和IgA的表达水平与抗体分泌水平直接相关,它们能够干扰微生物表面与宿主表面受体互补的黏附素间的特定相互作用,是抵御雄性生殖道感染的第一道重要防线。本研究观察到幼龄和成年牦牛附睾头、体、尾及输精管的间质和上皮均出现少量IgA和IgG浆细胞。JIRI报道正常射精过程约60%~70%精子通过输精管射出,剩余精子降解被吸收,而附睾和输精管中降解的精子抗原产物具有免疫原性,能够启动免疫反应,随后发生对这些抗原的免疫耐受。另外,Sirigu等报道正常情况下精浆中可检测到IgG和IgA。Moldoveanu等报道附睾和输精管的上皮细胞可以表达主要的组织相容性复合体II类和pIgR,这是一种负责运输IgA和IgG穿过黏膜表面的分子。以上提示牦牛附睾和输精管局部少量浆细胞可能是B淋巴细胞受正常精原抗体刺激产生的,也可能是运输免疫球蛋白的上皮细胞。另外,本研究还发现IgA和IgG mRNA和蛋白水平在从附睾头到输精管呈上调趋势,即附睾尾和输精管的表达量较高。GUDISA报道前列腺分泌物中可检测到大量的IgA 和IgG,而输精管处不仅有大量前列腺分泌物回流至此,还残留有未射出的降解的精子抗原,提示牦牛输精管局部略高的IgA和IgG水平可能与此相关,具体机制仍需进一步研究。
此外,本研究结果显示,成年牦牛附睾和输精管内免疫细胞表面标记物CD68、CD3、CD79α、IgA和 IgG mRNA和蛋白水平高于幼龄牦牛,与前人对小鼠的研究结果一致,小鼠附睾的巨噬细胞数量会随着增龄而上升。作者推测,成年牦牛免疫系统发育较幼龄完善,更丰富的免疫细胞在附睾和输精管维持免疫稳态和形成免疫屏障以保护精子。
4 结 论
各年龄组牦牛附睾和输精管内,CD68和CD3 mRNA和蛋白水平从附睾头到输精管依次下降;相反,CD79α、IgA和IgG表达水平逐渐上升;此外,幼龄牦牛附睾和输精管内上述免疫细胞表达均显著高于成年牦牛。上述结果提示,牦牛附睾头细胞免疫效应可能强于附睾尾和输精管,而附睾尾和输精管的体液免疫功能可能更占优势,另外,成年牦牛局部免疫可能发育更完善,以上数据可为进一步探究牦牛局部生殖免疫机制和病理研究提供形态学资料。
