羽毛降解菌DHW-06的分离鉴定及产酶特性研究
2021-07-06董萌萌郝鹏泽王佳柳贾良辉
董萌萌,郝鹏泽,王佳柳,陈 欢,颜 华,贾良辉
(西北农林科技大学 生命科学学院,陕西 杨凌 712100)
全球家禽业每年约产生200万t的羽毛,大量羽毛堆积为病原微生物如弧菌和沙门氏菌提供了栖息地,同时排放出各种污染气体,如NH3、N2O、H2S等,对人类的生活生产产生不良影响[1]。羽毛的主要成分是角蛋白,富含丝氨酸、缬氨酸、赖氨酸、色氨酸和胱氨酸,由α-螺旋和β-折叠构象组成。羽毛的外部主轴几乎完全由β-折叠组成,β-折叠构象中胱氨酸含量高,相比α-螺旋结构有更多的二硫键和更少的孔隙结构,因此被称为硬性角蛋白,不能被常见的胰蛋白酶和胃蛋白酶等蛋白水解酶降解[2]。但是羽毛又是肽、必需氨基酸和一些氮、磷、钾等矿物质的良好来源[3-4],如何将羽毛资源变废为宝一直是科研工作者致力解决的问题。传统的羽毛处理方法主要是焚化和化学法降解,如碱水解或加压蒸煮,不仅消耗了大量能量,降低了蛋白质的整体质量,破坏了赖氨酸、蛋氨酸和色氨酸等必需氨基酸,而且形成了赖氨肽胺丙氨酸和羊毛硫氨酸等非营养性氨基酸[5-7]。目前,用角蛋白分解菌对羽毛进行生物降解是一种有效、经济且环保的羽毛处理方法,可以将羽毛废料生物转化为营养平衡、可消化的羽毛裂解液,其中含有多种游离氨基酸、肽和铵离子[8-9]。细菌、放线菌和真菌中均已发现能够分解羽毛的菌株[10],常见的如放线菌中的链霉菌属(Streptomyces)以及细菌中的枯草芽孢杆菌属(Bacillussubtilis)和短小芽孢杆菌属(Bacilluspumilis)等[2],主要产生丝氨酸类蛋白酶或金属蛋白酶类,可应用于高蛋白动物饲料[9]和植物含氮肥料添加剂[11]的开发及原料皮的脱毛、洗涤剂的生产等领域[12-13]。因此,羽毛降解菌的发掘为开发成本低廉且生态友好的羽毛处理方式提供了新的思路。
本研究从土壤样品中筛选分离到1株高效降解羽毛的菌株,初步鉴定为蜡样芽胞杆菌BacilluscereusDHW-06;同时探究菌株DHW-06的最佳产酶条件,并以此条件进行酶学性质的测定,为角蛋白酶的分离纯化提供理论依据,并为研究羽毛的降解机理提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品采集 土壤样品采集于西北农林科技大学寄生虫中心。鸡羽毛收集于家禽市场,自来水洗净,纯水洗3次,60 ℃烘干至恒质量。
1.1.2 主要试剂 克隆菌株大肠杆菌DH5α,为本实验室保藏;pMD19-T载体连接试剂盒,购自大连宝生物公司。2×AccurateTaq预混液和琼脂糖凝胶DNA回收试剂盒,购自湖南艾科瑞生物公司;酪蛋白,购自上海源叶生物公司;天青角蛋白,购自Sigma生物公司;福林酚、二甲基亚砜(DMSO)、苯甲基磺酰氟(PMSF)和β-巯基乙醇,购自北京索莱宝生化试剂公司。其他试剂均为国产分析纯试剂。
1.1.3 培养基 羽毛粉培养基:羽毛粉10 g/L,K2HPO41.0 g/L,NaCl 0.5 g/L,KH2PO40.4 g/L,MgCl2·7H2O 0.1 g/L,CaCl20.06 g/L,琼脂20 g/L;牛肉膏蛋白胨培养基:蛋白胨10 g/L,牛肉膏5 g/L,琼脂20 g/L,NaCl 0.5 g/L,K2HPO41 g/L,KH2PO40.4 g/L,pH 7.5;牛奶培养基:10%脱脂奶粉与牛肉膏蛋白胨培养基按照1∶9的比例均匀混合;LB液体培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.0;液体羽毛培养基:羽毛(整根)10 g/L,K2HPO41 g/L,NaCl 0.5 g/L,KH2PO40.4 g/L,MgCl2·7H2O 0.1 g/L,CaCl20.06 g/L。
1.2 羽毛降解菌的分离筛选
1.2.1 羽毛降解菌的初筛 称取土壤样品1 g,研磨成粉末状置于三角瓶中,加入9 mL无菌生理盐水,90 ℃水浴加热2 h后,28 ℃振荡培养1 h,使其充分混匀。得到的土壤悬液接种至羽毛粉培养基上。挑选平板上长势良好的菌落转接至牛奶培养基中,挑取平板上能够产生明显水解圈的菌落进行传代,淘汰酶活力不稳定或生长能力较弱的菌株。
1.2.2 羽毛降解菌的复筛 将水解圈明显且长势稳定的菌种活化后接种至含整根羽毛的液体羽毛培养基中。于28 ℃、180 r/min振荡培养72 h,每隔12 h观察羽毛降解情况。
1.2.3 分离菌株羽毛降解率的测定 准确称量并记录液体羽毛培养基中整根羽毛的质量(保留至小数点后4位),接种已培养至OD600为0.6时的分离菌株,37 ℃恒温、180 r/min振荡培养48 h,观察培养基中羽毛的降解情况,并对羽毛降解液进行真空抽滤,将吸附有羽毛残渣的滤纸在烘箱中干燥至恒质量,采用失重法测定降解率:羽毛降解率=(羽毛干质量-残渣干质量)/羽毛干质量×100%。试验筛选出的菌株用甘油保藏。
1.3 羽毛降解菌株的鉴定
1.3.1 菌株的形态特征检测 挑取少量甘油保藏菌株,划线接种于LB平板上,37 ℃恒温倒置培养48 h,观察菌株的形态特征,并挑取少量菌体进行显微镜观察和革兰氏染色观察。
1.3.2 菌株的生理生化特征检测 生理生化试验根据《常见细菌系统鉴定手册》[14]进行,其中NaCl梯度设 0,10,20,…,100 g/L,pH梯度设5,6,7,…,12。
1.3.3 菌株的16S rRNA鉴定 根据16S rRNA序列的保守性,设计通用引物,PF:5′-AGAGTTTGATTCTGGCTC-3′,PR:5′-AAGGAGGTGATCCAGCCGCA-3′,引物由擎科生物公司合成。采用Kirby Mix法提取菌株DHW-06的基因组DNA。PCR扩增分离菌株的16S rRNA,反应体系为:2×AccurateTaq预混液 25 μL,引物PF和PR各1 μL,基因组DNA 1 μL,二甲基亚砜(DMSO)5 μL,最后用ddH2O补足50 μL体系。PCR反应程序为94 ℃预变性30 s;98 ℃变性10 s,58 ℃退火30 s,72 ℃延伸90 s,32次循环;72 ℃延伸2 min。PCR产物经1%琼脂糖凝胶电泳检测后,用琼脂糖凝胶DNA回收试剂盒回收目的片段,与pMD19-T载体连接后转化大肠杆菌DH5α细胞,挑取阳性克隆送至擎科生物公司测序。使用NCBI的Blast软件对测序所得序列进行同源性分析,选取GenBank数据库中与该序列相似度较高的14条16S rRNA序列,用ClustalX软件进行多序列比对后,再用MEGA 7.0软件构建系统发育树。
1.4 羽毛降解菌株的产酶条件
1.4.1 角蛋白酶活力的测定 采用酪蛋白作为底物进行酪氨酸标准曲线的绘制和角蛋白酶活力的测定。在试管中加入1 mL 20 g/L的酪蛋白溶液(pH 8.0),预热2 min后加入1 mL过滤后的粗酶液,精确反应10 min,立刻加入2 mL 0.4 mol/L的三氯乙酸(TCA)终止反应,混匀后置于40 ℃保温20 min,12 000 r/min离心10 min后取1 mL上清样品,加入1 mL福林酚试剂和5 mL 0.4 mol/L的碳酸钠溶液,混匀后40 ℃保温发色20 min,于660 nm处测定吸光度(OD660)。绘制吸光度(OD660)与酪氨酸质量浓度(μg/mL)的标准曲线,将试验获得的吸光度(OD660)换算成酪氨酸质量浓度(μg/mL)。1 mL粗酶液精确反应10 min后,每释放出1.0 μg酪氨酸,定义为1个酶活单位(U)[15]。
1.4.2 培养时间对菌株产酶的影响 将菌株的发酵种子液培养至OD600为0.6时,以适当的比例转接入液体羽毛培养基,在37 ℃下180 r/min振荡培养24 h,期间每隔3 h取发酵液上清样品,测定角蛋白酶活力。每个时间点设置3个重复试验,并设置不加底物的处理为对照。
1.4.3 接种量对菌株产酶的影响 将OD600为0.6的菌液转接入液体羽毛培养基,接种量分别为体积分数1.5%,3.0%和6.0%,在37 ℃、180 r/min条件下振荡培养,于培养的10,12和14 h,分别取发酵液上清样品,测定角蛋白酶活力。每组试验设置3个重复,并设置不加底物的处理为对照。
1.4.4 发酵温度对菌株产酶的影响 将OD600为0.6的菌液以体积分数3%的接种量转接入液体羽毛培养基,分别在22,27,32,37和42 ℃下180 r/min振荡培养10 h,取发酵液上清样品,测定角蛋白酶活力。每个温度梯度设置3个重复试验,并设置不加底物的处理为对照。
1.4.5 培养基初始pH对产酶的影响 将OD600为0.6的菌液以体积分数3%的接种量转接入液体羽毛培养基,培养基的初始pH分别为6.0,6.5,7.0,7.5和8.0,在37 ℃、180 r/min条件下培养10 h,取发酵液上清样品,测定角蛋白酶活力。每个pH梯度设置3个重复试验,并设置不加底物的处理为对照。
1.5 羽毛降解菌株的酶学特性
1.5.1 粗酶液的最适反应温度及其温度稳定性的测定 (1)以酪蛋白为底物测定粗酶液的最适反应温度。反应温度分别设定为30,40,50,60,70和80 ℃,试验方法同1.4.2节,测定不同反应温度下的酶活力。每个温度梯度设置3个重复试验,并设置不加底物的处理为对照。以试验组最大酶活力为100%,确定其他试验组的相对酶活力。
(2)以酪蛋白为底物测定粗酶液的温度稳定性。将样品分别在30,40,50,60和70 ℃的条件下保温30 min后,测定不同温度处理后的酶活力。每个温度梯度设置3个重复试验,并设置不加底物的处理为对照。以试验组最大酶活力为100%,确定其他试验组的相对酶活力。
1.5.2 粗酶液最适pH的测定 以酪蛋白作为底物测定粗酶液的最适反应pH。分别配制pH 6.0,7.0,8.0,9.0,10.0的PBS缓冲液(用0.2 mol/L Na2HPO4-柠檬酸缓冲液调节PBS缓冲液的pH为6.0,7.0;用0.2 mol/L NaOH-硼酸缓冲液调节PBS缓冲液的pH为8.0~10.0),将底物溶于其中进行试验。每个pH梯度均设置3个重复试验,并设不加底物的处理为对照。以试验组最大酶活力为100%,确定其他试验组的相对酶活力。
1.5.3 金属离子对粗酶液的影响 以酪蛋白为底物测定不同金属离子对粗酶液的影响。在2 mL的反应体系中分别加入低浓度(1 mmol/L)和高浓度(10 mmol/L)的K+、Ca2+、Mg2+、Zn2+、Fe3+、Cu2+、Ni2+和Mn2+,按照1.4.2节的方法测定不同金属离子对酶活力的影响。每种金属离子在2种浓度下均设置3个重复试验,并设不加金属离子的处理为对照。以对照处理的酶活力为100%,确定试验组的相对酶活力。
1.5.4 化学试剂对粗酶液的影响 以酪蛋白为底物测定化学试剂DMSO、β-巯基乙醇、异丙醇、EDTA、PMSF、SDS和DTT对酶活力的影响,反应体系为2 mL,化学试剂设定低和高2种水平处理,低浓度处理中DMSO、β-巯基乙醇和异丙醇均为体积分数1%,EDTA、PMSF、SDS和DTT均为1 mmol/L;高浓度处理中DMSO、β-巯基乙醇和异丙醇均为体积分数10%,EDTA、PMSF、SDS和DTT均为10 mmol/L。每种化学试剂在2种水平均设置3个重复试验,并设不加化学试剂的处理为对照。以对照处理的酶活力为100%,确定试验组的相对酶活力。
1.5.5 粗酶液的底物特异性试验 以可溶性底物牛血清蛋白、角蛋白、牛血红蛋白和酪蛋白及不可溶底物天青角蛋白和羽毛粉,测定菌株粗酶液对不同底物的利用能力。可溶性底物的反应体系为2 mL,包括1 mL 20 g/L的底物溶液(pH 8.0)和1 mL的粗酶液;不可溶底物的反应总体系为4 mL,包括40 mg不可溶底物,2 mL的粗酶液和2 mL PBS缓冲液(pH 8.0),混匀后在37 ℃下180 r/min反应2 h,离心取上清样品,然后按照1.4.2节的相应方法测定酶活力。每种底物均设置3个重复试验,并设不加底物的处理为对照。以酪蛋白为底物的酶活力为100%,确定其他底物的相对酶活力。
2 结果与分析
2.1 羽毛降解菌株的分离筛选
试验筛选出1株羽毛降解菌,命名为DHW-06,在羽毛培养基中培养48 h后,其羽毛降解情况如图1所示,羽毛降解率达71.38%。
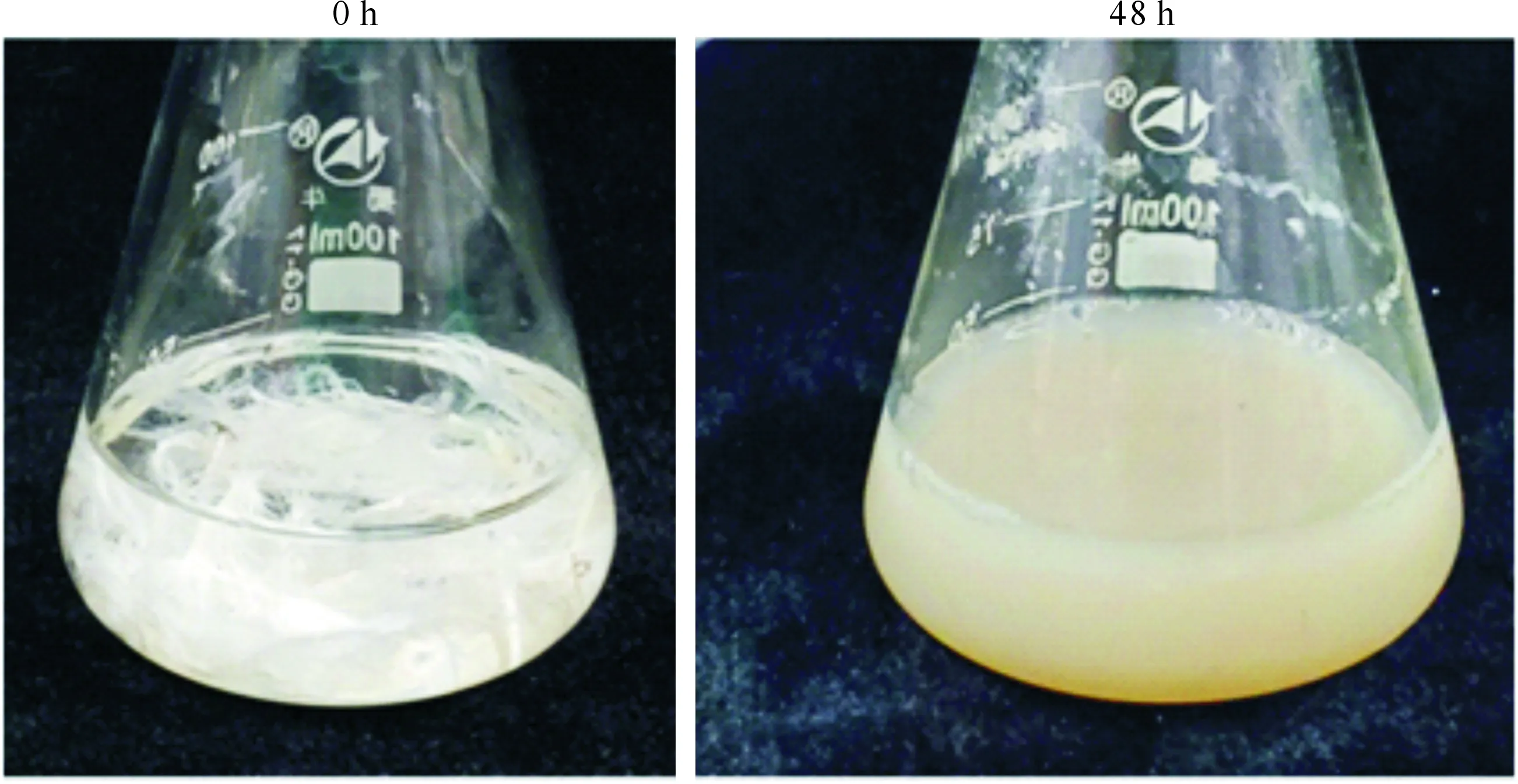
图1 分离菌株DHW-06的羽毛降解效果Fig.1 Degradation of feather by bacterial isolation DHW-06
2.2 羽毛降解菌株DHW-06的鉴定
2.2.1 形态和生理生化特征 菌株DHW-06在37 ℃恒温倒置培养24 h时菌落大,白色圆形,表面湿润有光泽。菌株DHW-06革兰氏染色呈紫红色,是1株杆状、产芽孢的革兰氏阳性细菌(图2)。生理生化特征鉴定结果(表1)显示,菌株DHW-06能利用葡萄糖、蔗糖等碳源;在不含NaCl的培养基中生长良好,能在含有70 g/L NaCl的培养基中生长;能够分解明胶,但不能利用尿素、柠檬酸钠和苯丙氨酸; pH耐受能力强,在pH 5~10条件下均生长良好。
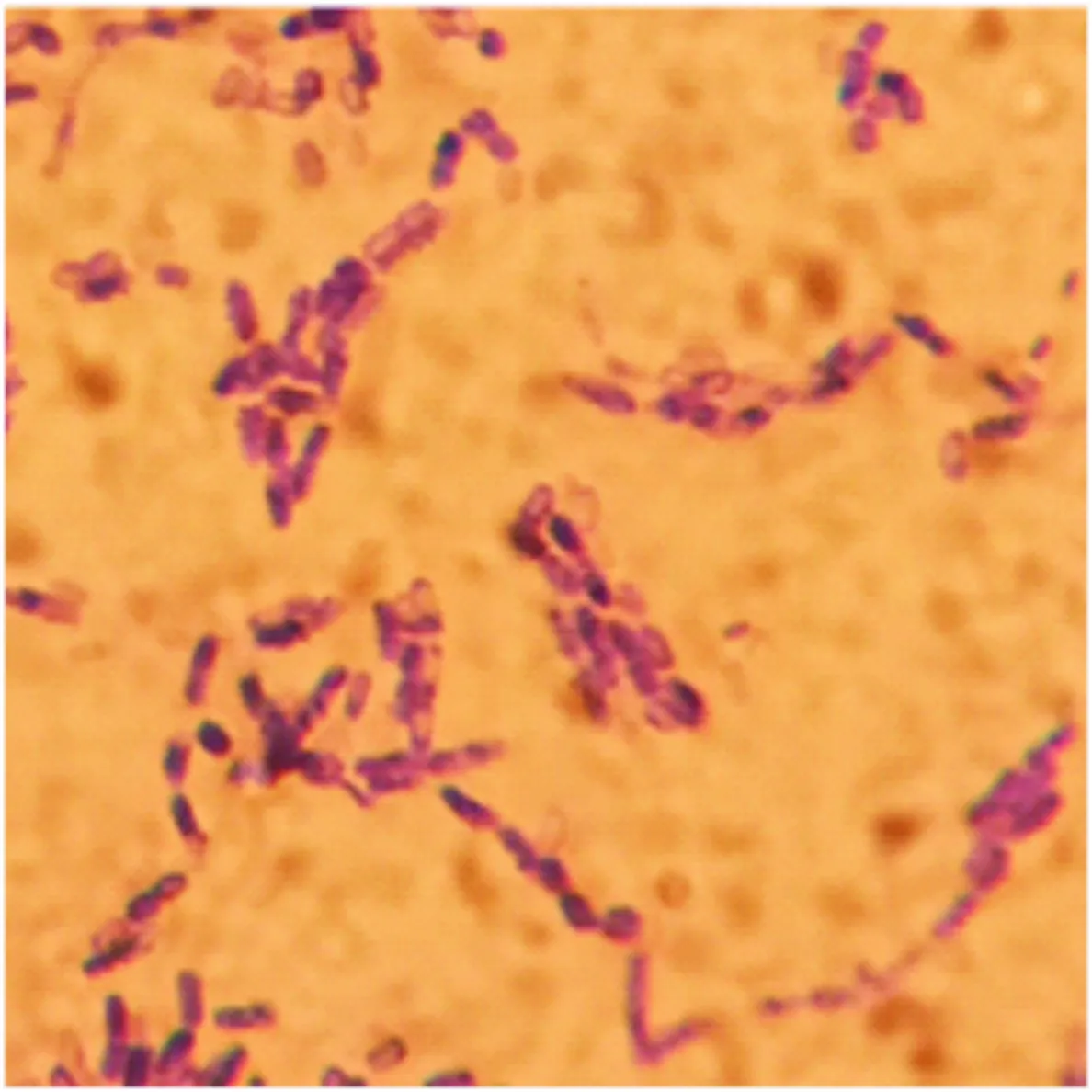
图2 羽毛降解菌株DHW-06的形态观察(×100)Fig.2 Morphology of strain DHW-06 under microscope (×100)

表1 羽毛降解菌株DHW-06的生理生化特征Table 1 Physiological and biochemical characters of strain DHW-06
2.2.2 16S rRNA序列分析 由图3可知,菌株DHW-06的16S rRNA序列与蜡样芽孢杆菌(Bacilluscereus)相似度最高,达98%,因此初步鉴定该菌株为蜡样芽孢杆菌(Bacilluscereus)。
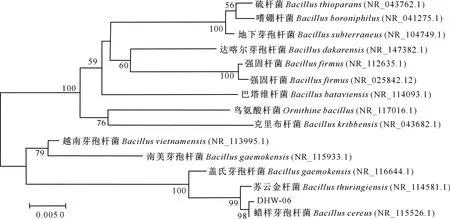
图3 羽毛降解菌株DHW-06的16S rRNA序列系统发育树Fig.3 Construction of phylogenetic tree of feather degrading strain DHW-06 based on 16S rRNA sequence
2.3 羽毛降解菌株DHW-06的产酶条件研究
2.3.1 培养时间对菌株DHW-06产酶的影响 由图4-A可知,在培养12 h时,角蛋白酶活力达到最高值,为64.30 U/mL。
2.3.2 接种量对菌株DHW-06产酶的影响 由图4-B可知,当接种量为体积分数1.5%时,随培养时间的延长角蛋白酶活力逐渐升高,培养14 h时,角蛋白酶活力达104.51 U/mL;当接种量为体积分数3.0%时,随培养时间的延长角蛋白酶活力逐渐降低,培养10 h时,角蛋白酶活力达到最高值,为107.62 U/mL;当接种量为体积分数6.0%时,角蛋白酶活力在12 h时达到峰值,为55.85 U/mL。将接种量体积分数3.0%,发酵时间10 h作为后续研究的发酵条件。
2.3.3 发酵温度对菌株DHW-06产酶的影响 由图4-C可以看出,37 ℃时角蛋白酶活力最高,达122.27 U/mL。
2.3.4 培养基初始pH对菌株DHW-06产酶的影响 由图4-D可知,在初始pH为6.5~7.5时,角蛋白酶活力均处于相对较高的水平,其中pH为6.5时角蛋白酶活力最高,为129.47 U/mL。
2.4 羽毛降解菌株DHW-06粗酶液的酶学性质
2.4.1 最适反应温度和稳定性 由图5-A可以看出,菌株DHW-06粗酶液的最适反应温度为60 ℃。由图5-B可知,菌株DHW-06粗酶液在30~50 ℃条件下处理30 min后仍能保留85%以上的相对酶活力,表明该酶的耐热性较好;在60 ℃以上稳定性较差,高于70 ℃酶活力几乎完全丧失。
2.4.2 最适反应pH 粗酶液的最适pH测定结果(图6)表明,该酶能够耐受的pH范围较广,在pH 6.0~10.0均有活性,在pH 8.0时相对酶活力达到最高值,表明该酶在微碱性环境中能发挥最大活力。
2.4.3 金属离子对粗酶液活力的影响 由表2可知,Mn2+和Cu2+对粗酶液具有显著的激活作用,低浓度的Mn2+和Cu2+分别使相对酶活力提高94%和21%,高浓度的Mn2+和Cu2+分别使相对酶活力提高300%和120%;K+、Mg2+、Ca2+和Ni2+均对粗酶液有微弱的激活作用;Fe3+和Zn2+在低浓度下对粗酶液有不同程度的抑制作用,而在高浓度下又有促进作用。结果说明,该酶活力的发挥需要金属离子的参与,以维持酶活性中心的稳定。
2.4.4 化学试剂对粗酶液活力的影响 由表3可以看出,低浓度和高浓度的β-巯基乙醇分别使相对酶活力提高1 525.03%和1 658.95%;低浓度和高浓度的DTT分别使相对酶活力提高36.26%和577.99%;低浓度的PMSF可使相对酶活力丧失35.32%;低浓度的EDTA使相对酶活力提高30.3%,高浓度的EDTA使相对酶活力丧失59.08%;SDS、DMSO和异丙醇对粗酶液均有不同程度的抑制作用。
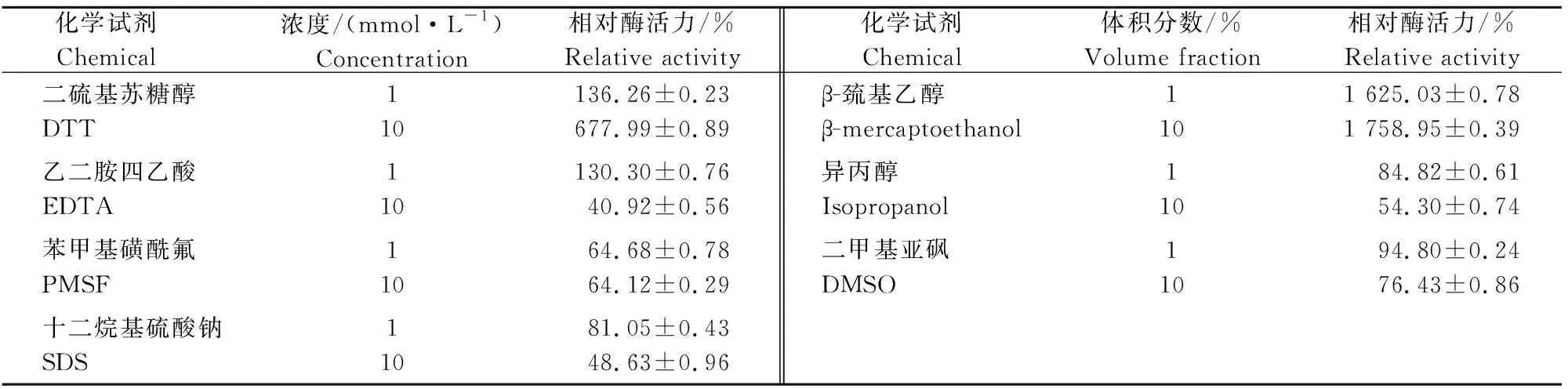
表3 化学试剂对羽毛降解菌株DHW-06粗酶液活力的影响Table 3 Effect of chemicals on activity of crude enzyme from strain DHW-06
2.4.5 粗酶液的底物特异性 粗酶液的底物特异性结果(表4)显示,该酶具有广泛的底物适应能力,能够降解可溶性底物酪蛋白、角蛋白、牛血清蛋白和牛血红蛋白,也可以降解不可溶底物天青角蛋白和羽毛粉。该酶对角蛋白的降解能力最强。
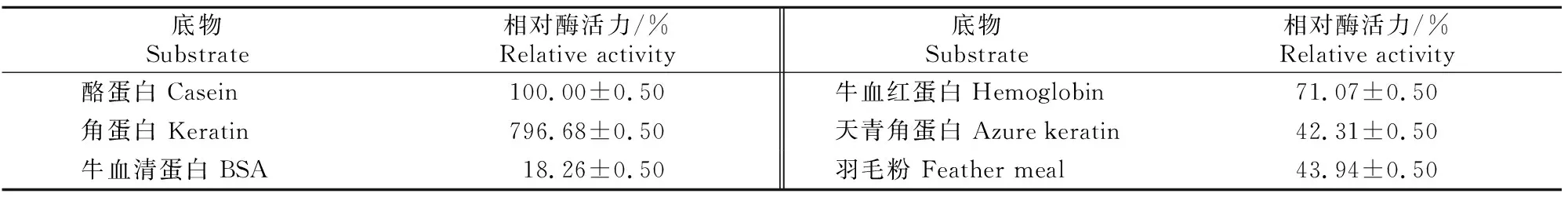
表4 底物对羽毛降解菌株DHW-06粗酶液活力的影响Table 4 Effects of substrates on enzymatic activity of crude enzyme from strain DHW-06
3 讨论与结论
本研究成功地从土壤中分离到1株新型羽毛降解菌DHW-06,根据其形态、生理生化特征及16S rRNA序列分析,初步鉴定为蜡样芽孢杆菌;菌株DHW-06产芽孢、杆状,抗逆性强,耐高温、耐盐,在pH 6.0~10.0环境中均能良好生长,能在48 h将培养基中的羽毛降解,其降解效率高于其他大多芽孢杆菌属的细菌[16-17]。菌株DHW-06的最适生长温度也是其最佳的发酵温度。微生物的生长阶段分为4个时期,即迟缓期、对数期、稳定期和衰亡期。角蛋白酶活力通常在菌株生长的对数期前期开始缓慢积累,在对数期后期或稳定期达到最大值,而蜡样芽孢杆菌的最大酶活力出现在稳定期[18]。不同的接种量使菌株DHW-06生长到稳定期阶段的时间有所不同,故接种量为体积分数1.5%,角蛋白酶活力峰值出现在发酵14 h时;接种量为体积分数3.0%,角蛋白酶活力峰值出现在发酵10 h时。菌株DHW-06发酵24 h后角蛋白酶活力骤降,但仍能高效降解羽毛,推测其可同时产胞外角蛋白酶和胞内角蛋白酶[19]。
相关文献表明,地衣芽孢杆菌(BacilluslicheniformisHK-1和BacilluslicheniformisPWD-1)、枯草芽孢杆菌(BacillussubtilisKD-N2)产生的角蛋白酶的最适反应条件为50~55 ℃和pH 7.0~9.0[20-22]。本试验菌株DHW-06粗酶液的最适反应条件为60 ℃,pH 8.0。除低浓度(1 mmol/L)的Fe3+和Zn2+外,其他金属离子激活剂均能够提高菌株DHW-06的酶活力,推测金属离子在稳定酶活性位点、维持酶构象稳定中发挥重要作用。角蛋白降解的第一步是二硫键还原酶催化二硫键断裂[23-26],β-巯基乙醇和二硫基苏糖醇(DTT)是常见的还原剂,能够催化二硫键断裂,使酶活力大大提高。PMSF是常见的丝氨酸蛋白酶抑制剂[27]。本试验结果表明PMSF可抑制菌株DHW-06的酶活力,表明该菌株所产生的酶可能属于丝氨酸蛋白酶类。菌株DHW-06的粗酶液对可溶性底物酪蛋白和角蛋白等及不可溶底物天青角蛋白和羽毛粉均有降解能力。菌株DHW-06能够在羽毛底物中快速生长,表明其在技术工艺上具备可行性,具有广阔的应用前景。
