地塞米松聚乳酸羟基乙酸磁性微球体外生物相容性评价
2021-07-01孙永海
金 鑫,孙永海
1 空军特色医学中心 麻醉科,北京 100142;2 解放军总医院第二医学中心 综合治疗科,北京 100853
疼痛作为第五大生命体征,不同程度地影响着患者们的生活质量,其中慢性病理性疼痛患者占比较大,是临床上最棘手的症状之一。目前,临床上常用的治疗方案为地塞米松联合其他药物单次注射,虽然效果尚可,但长期大量使用激素容易产生不良反应及并发症,如高血压、高血糖、股骨头坏死、真菌感染、消化道溃疡,严重者可出现精神症状。磁性微球是近年来出现的一种靶向给药技术,不仅能局部给药,达到控释或缓释的给药效果,还能改善药物对注射部位的刺激反应,减少药物不良反应的发生率。本研究拟制作一种可在局部用药的地塞米松聚乳酸羟基乙酸(poly lactic-co-glycolic acid,PLGA)磁性微球,能够逐步缓慢地释放地塞米松,且可维持有效的治疗浓度。而糖皮质激素的局部应用是慢性病理性疼痛最常用的治疗方法,如地塞米松与其他药物联合的单次注射,其优点是疗效较好,缺点是长期应用并发症较多,如骨质疏松,消化道溃疡,真菌感染、糖脂代谢障碍及精神状况的改变。
近年来,由于缓释技术的发展,磁性PLGA微球作为一种缓/控释药物的理想载体出现在大家面前。其不仅能控制药物的释放速度,且相容性也较好,还能局部给药。如果制成糖皮质激素微球,不仅可减少药物的总用量,还可降低给药频次,从而减少激素总体的使用量。理论上,地塞米松制成该种微球可以降低激素使用者的并发症,改善长期预后。因此,本研究拟自制地塞米松PLGA磁性微球,期望为临床上治疗局部疼痛提供一种新的手段。
材料和方法
1 试剂与设备 1)药品、试剂及耗材:地塞米松标准品(德国Sigma公司),PLGA(50/50)(山东省药学科学院),聚乙烯醇(日本可乐丽公司),色谱柱(德国Thermo公司),甲醇(色谱纯),其余均为分析纯,弗氏完全佐剂(德国Sigma公司)。2)设备仪器:恒温水浴震荡仪(上海精宏有限公司),2120型号血细胞分析仪(德国拜耳医疗设备有限公司),CR3i型号高速离心机(德国Thermo公司),ZS-MV小动物麻醉机专用氧源(北京众实迪创发展有限责任公司),ZS-MV小动物麻醉机(北京众实迪创发展有限责任公司),Von Frey纤维丝(美国生物器械公司),LS-50B型号荧光/磷光分光光度计(美国 Perkin Elmer 公司),大鼠吸入麻醉箱(军事医学科学院)。
2 微球的制备 根据前期实验结果按地塞米松/药物总和=1∶4、PLGA/Fe3O4=4∶1的投料比标准,微球以固相(solid phase,S)/油相(oil phase,O)/水相(water phase,W)方法制作而成。具体步骤:将适量PLGA放入3 mL二氯甲烷中(O),3 000 r/min涡旋3 min左右,直至完全溶解。并按比例将纳米Fe3O4粉末放入以上溶液中,超声震荡1 min。再将100 mg地塞米松粉剂(S)溶于二氯甲烷(O)中,超声震荡1 min,3 000 r/min涡旋2 min左右,直至完全溶解。之后,将以上混合溶液用滴管按30 drops/min的速度缓慢滴入浓度为2%的PVA溶液(W,O/W=1∶10)——该溶液此前已冰浴1 h。溶液挥发4 h,转速1 800 r/min,直至二氯甲烷完全挥发。微球固化后,经0.20 μm滤膜真空负压过滤,收集微球,去离子水洗涤后冻干。
3 微球评价指标 根据陶利军等[1]的研究,微球质量的评估采用以下公式:
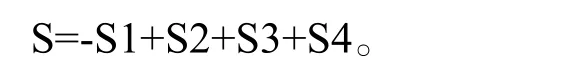
S代表微球质量的求和值;S1表示微球直径,即跨距;S2表示微球的产率;S3表示微球的包封率;S4表示载药量。
1)跨距(S1)与磁响应性:将自制载药微球(n≥500)涂于载玻片,使用双蒸水将其分散,于光镜下(400×)拍照并测定多个微球的跨距,统计后得出平均值[1]。磁响应性:取自制载药微球微球5 mg,用100 mL双蒸水配成标准溶液;将微球溶液置于4 000 GS的磁场下,光镜下(400×) 观察其运动及分布。并在干燥后,称取未吸附及吸附的微球根据以下公式算出磁吸附率(%):
吸附率=吸附微球 /(吸附微球+未吸附微球)×100%。
2)产率(S2)、包封率(S3)及载药量(S4)计算公式[1]如下:
S2=wt(已包裹DXM+Fe)/wt(已投入DXM+Fe)×100%
S3=wt(已包裹DXM+Fe)/ wt(已投入所有成分)×100%
S4=wt(已包裹DXM)/wt(已投入所有成分)×100%
DXM表示“地塞米松”,Fe表示“纳米Fe3O4粉末”,wt表示药物的“质量”。
4 微球相关参数测定方法 1)色谱条件Hypersil C18 色谱柱(150 mm×4.6 mm,5μm)。流动相乙腈:磷酸盐缓冲液(25 mmol/L,pH=3.0,45∶55);流速1.0 mL/min;检测波长240 nm;柱温:30℃。2) 对照品溶液的制备:精密称取地塞米松对照品5 mg,与20 mL乙腈配成0.5 mg/mL溶液(D溶液)。3)标准曲线的制备:精密吸取10 μL、100 μL、200 μL、300 μL、400 μL、500 μL的D溶液,用流动相稀释并定容至5 mL,使其分别配成1倍、10倍、20倍、30倍、40倍、50倍浓度为百万分之一的对照品溶液,并各取50 μL其溶液注入液相色谱仪,计算峰面积。以峰面积×对药物浓度Y(mg/L)进行线性回归。4)回收率实验:精密移取D溶液一定体积各5份,置于10 mL容量瓶中,用流动相稀释并定容。取50 μL注入液相色谱仪,根据峰面积算出回收率。5) 精密度实验: 取地塞米松对照品(D溶液)1 mL,置于10 mL容量瓶,根据实验要求,用不同容积的流动相稀释并定容。重复进样5次,记录色谱图,依据峰面积,算出相对标准差(relative standard deviation,RSD)。6)重复性实验:取相同批号的地塞米松PLGA磁性微球若干,精密称取5份,记录色谱图,依据峰面积,算出RSD数值。7) 样品检测方法:精密称取地塞米松PLGA磁性微球10 mg,置于10 mL容量瓶中,用乙腈溶解定容后,过滤器过滤,移取滤液1 mL置于50 mL容量瓶中,流动相稀释并定容。取50 μL该溶液注入液相色谱仪,根据色谱图峰面积得出最终浓度。
5 体外释放 分别精密称取投料比为1∶3、1∶4、1∶5的地塞米松PLGA磁性微球各10 mg,分别置于具塞烧瓶中,其中放入50 mL的PBS溶液(磷酸缓冲盐,pH=7.4)。将烧瓶放入恒温水浴震荡仪中,水位超过PBS溶液平面。震荡条件:36℃~37℃,100~120 min。在0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h之后,每间隔24 h采取上清液,直至第14天。每次移取样本2 mL,每次采样后等量填充,所采集样本储存于4℃冰箱保存。用前述的高效液相检测其药物浓度,并计算该药物的释放百分比,公式:
其中Q为该微球的累计释放量(%),Ct为t时的PBS溶液里地塞米松的药物浓度(μg/mL),V为药物稀释体积(mL),m为每瓶中地塞米松的总质量。
6 稳定性实验 将不同投料比的微球(n ≥ 500)分别置于EP管中,并将其放入4℃~8℃的冰箱中3个月,分别在放入后即刻和第1个月、第2个月、第3个月的第1天观察其物理特征(光镜下粒径及外观)是否改变,同时使用前述方法检测其载药量。
7 体外溶血实验 移液枪精确移取不同浓度的供试品各3份(0.3 mL/份)。A受试品:红细胞悬液2.5 mL+ 0.9%氯化钠注射液2.2 mL+X溶液0.3 mL;B阴性对照:红细胞悬液2.5 mL+0.9%氯化钠注射液2.5 mL;C阳性对照:红细胞悬液2.5 mL+蒸馏水2.5 mL。将A+B+C溶液混匀,立即恒温(36℃ ~ 37 ℃)水浴孵育3 h。将上述处理溶液离心(3 000 r/min,5 min)后,移取上清液,室温静置30 min。以B溶液(阴性对照)的上清液为空白标准,根据540 nm处光谱扫描得出的吸光值,溶血率(%)计算公式:
HL%=At/Apc100%
At:受试样品吸光值;Apc:阳性对照吸光值。
阴性对照吸光度≤0.03,阳性对照吸光度范围(0.8±0.3),溶血率(%)<5%,说明该受试样品无溶血作用[2]。2.2 mL+X溶液0.3 mL。B阴性对照:红细胞悬液2.5 mL+0.9%氯化钠注射液2.5 mL。C阳性对照:红细胞悬液2.5 mL+蒸馏水2.5 mL。将以上A+B+C样品混匀,立即置于恒温水浴震荡仪中孵育3 h,水温为36℃~37℃。将上述处理的受试样品离心,3 000 r/min、5 min,移取上清液,室温静置30 min。以阴性对照上清液为空白,根据540 nm处光谱扫描得出的吸光值,计算溶血率(%)公式:
HL%=At/Apc×100%
At受试样品吸光值;Apc阳性对照吸光值。
阴性对照吸光度 ≤ 0.03,阳性对照吸光度范围0.8±0.3,溶血率<5%,说明该受试样品无溶血作用[2]。
8 体内血液相容性实验 取9只清洁度为SD级别的成年雄性大鼠,体质量为220 ~ 250 g,称重后将上述供试品母液根据体质量按照高剂量(0.8 mL/100 g)、中剂量(0.5 mL/100 g)及低剂量(0.2 mL/100 g)的标准经尾静脉注射入大鼠体内[3-4]。且于注射前及注射后0.5 h、6 h、12 h、24 h眼眶静脉轮流取血0.5 mL,置于抗凝管中并行血常规检查。。
9 组织相容性实验 取6只清洁度为SD级别的成年雄性大鼠,体质量为220 ~ 250 g,七氟醚吸入麻醉(3只/组)后,剃除背部毳毛,对照组皮下注射1 mL 0.9%氯化钠注射液,实验组皮下注射供试品母液1 mL。第10天后取注射部位皮肤及皮下组织做HE染色。
10 统计学方法 采用SPSS17.0软件进行统计分析,计数样本比较采用χ2检验,计量资料组间两两比较采用配对t检验,组内多样本比较采用单因素方差分析。 P<0.05为差异有统计学意义。
结 果
1 微球形态与质量评估 本实验自制地塞米松微球为球形、黑色、微小颗粒,在光镜下(400×)多呈圆形,该微球求和值(S)为167.47±4.15;跨距(S1)为(29.66±10.02) μm。产 率(S2)为(87.25±3.14)%,包封率(S3)为(78.89±2.42)%,载药量(S4)为(30.33±2.01)%。见图1。

图1 磁性微球光镜下形态(1∶4)Fig.1 Optical microscope image of magnetic microspheres (1∶4)
2 磁响应性 在磁场强度为4 000 GS时,光学显微镜(400×)下见该地塞米松微球在乙醚溶液中的运动方向朝向磁铁并呈不规则路线。其运动距离约为(80.0±5.0) mm直至瓶壁。
3 地塞米松标准曲线及色谱图 标准曲线方程为Y=1.241 63e-006X - 0.176 918 (R=0.999 9)。地塞米松峰值约为180 v,出峰时间约5 min (图2)。

图2 地塞米松色谱图Fig.2 Dexamethasone chromatogram
4 回收率、精密度及重复性实验 1)回收率:该方法回收率≥90%,RSD为0.3%~1.1%。2)精密度:按照色谱图,根据其峰面积算出精密度RSD为1.98%(n=5)。3)重复性实验:测得地塞米松平均含量为81.33%,RSD为2.05%。以上结果均提示本实验采用的药物检测方法精密度好,准确性高。
5 体外释放 第2天地塞米松微球的体外累积释放率为32.91%,第7天62.74%,第14天66.99%,其体外释药模型为Q=4.084 4t1/2+6.660 2 (R2=0.977),释放曲线见图3。

图3 微球体外释放线性趋势Fig.3 In vitro release linear trend of microspheres
6 地塞米松PLGA磁性微球的稳定性 置入4℃ ~8℃冰箱中的微球投料比虽然不同,但其载药量及粒径的变化均无统计学差异,物理性质光镜下也无明显改变,说明稳定性置于冰箱(4℃ ~ 8℃) 中的微球虽然批次不同,但形状、跨距及载药量在3个月内均无明显变化。
7 体外溶血实验 所有样本经过本实验得出浓度分别为 1 mg/mL、2 mg/mL、4 mg/mL的样品吸光度为0.006、0.011、0.032;溶血率为0.5%、1.2%、3.3%(阳性对照和阴性对照的吸光度分别为0.802及0.003;溶血率分别为99.9%及0),按照溶血率≤5%为无溶血作用的标准,以上样本均无致溶血作用(表1)。
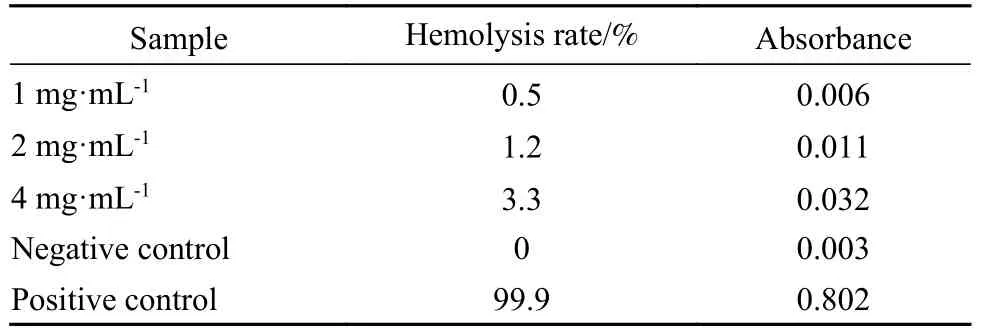
表1 不同待测样品的吸光值及溶血率(n=3)Tab.1 Absorbance and hemolysis rate of different samples to be tested (n=3)
8 对大鼠血常规的影响 与大鼠给药前的红细胞、白细胞及血小板的计数及体积进行比较,各组大鼠的注射不同剂量微球供试品后0.5 h、6 h、12 h、24 h的红细胞、白细胞及血小板的计数及体积的变化均无统计学意义。但与给药前白细胞分类(%)比较,各组大鼠注射后6 h、12 h、24 h的中性粒细胞(%)明显降低;而淋巴细胞(%)的变化则反之;单核细胞(%)则在12 h、24 h的变化有统计学差异;嗜酸性粒细胞(%)在注射后0.5 h、6 h、12 h、24 h均明显减少(P < 0.01);嗜碱性粒细胞的变化无统计学意义。见表2。
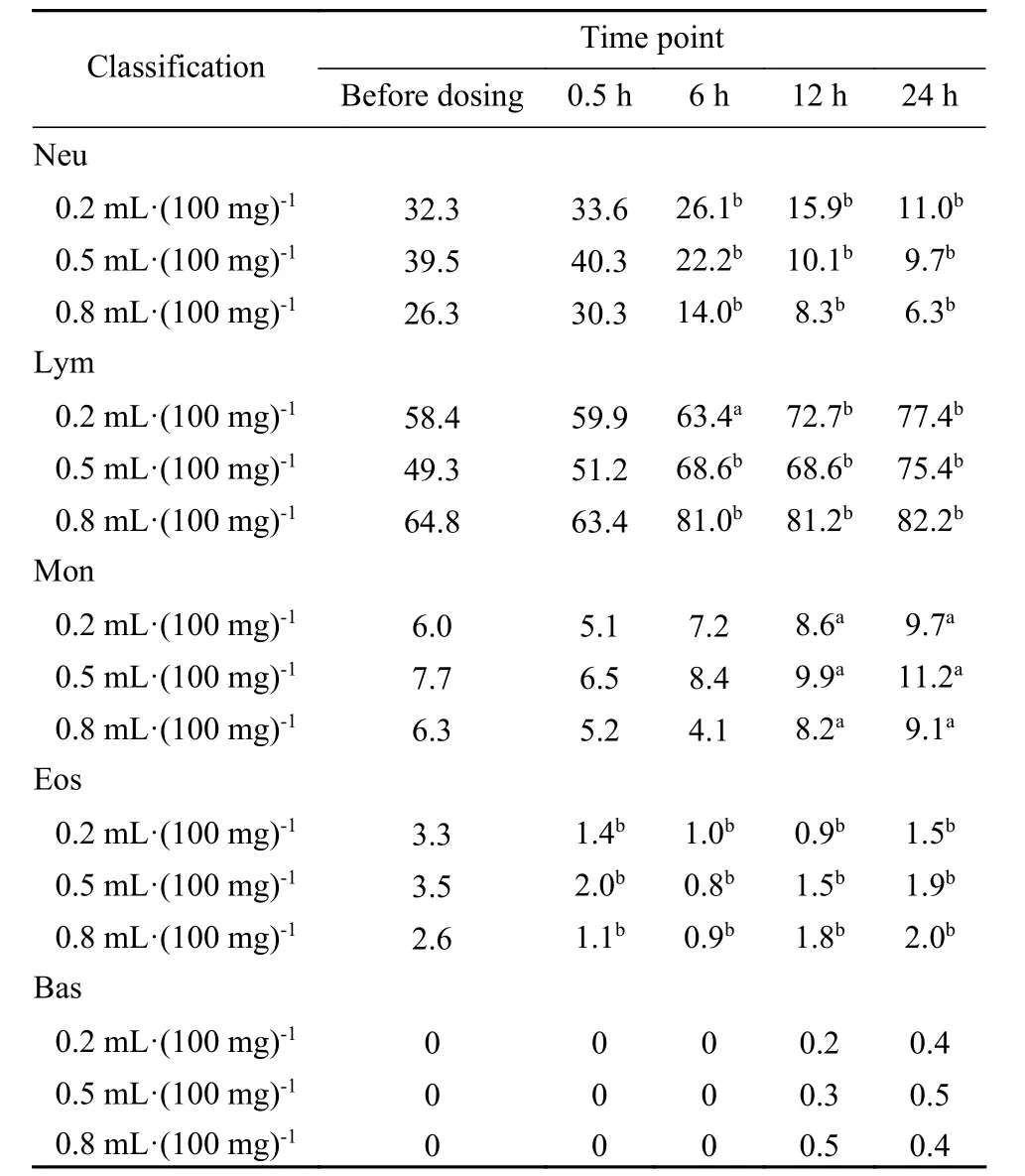
表2 不同剂量微球对大鼠白细胞分类的影响(%)Tab.2 Effects of different dosages of microspheres on leukocytes (%)
9 组织相容性 局部注射后两组大鼠背部皮肤第10天均无病理性改变。两者无统计学差异。见图4。
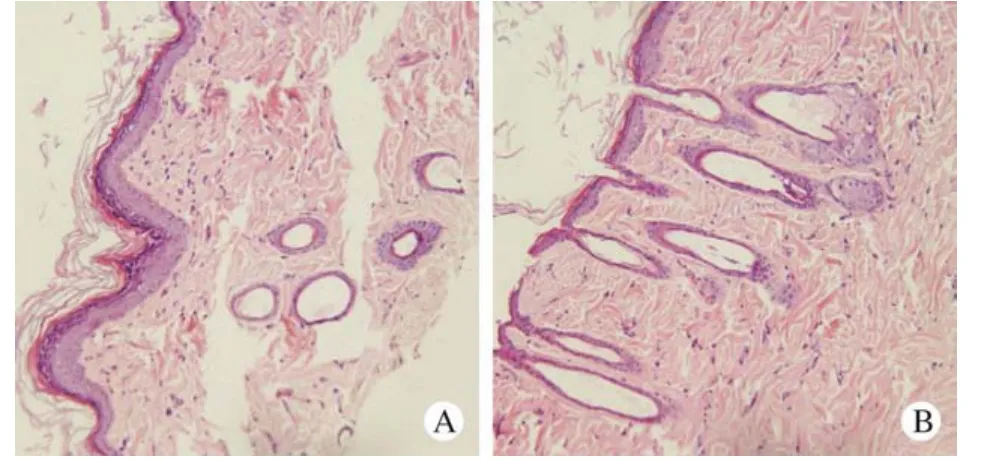
图4 实验组(A)和对照(B)组大鼠微球注射10 d前后病理切片对比(400×)Fig.4 Comparison of pathological sections between the experimental group (A) and the control group (B) of rats before and after microspheres injection for 10 days (400×)
讨 论
PLGA磁性微球作为靶向给药时一种较好的药物载体,其特点是为缓释时间长、突释量小、载药量高[5-6]。本实验自制的地塞米松微球(1∶4)其包封率、产率及磁响应性均较好,该特性对于磁场引导下的靶向治疗非常有利。该微球已获批发明专利,专利号为201810537459.3,专利人为孙永海、孙畅、金鑫。
PLGA磁性微球体外代谢根据释放速度分为两个阶段——突释相和缓释相。本实验自制微球体外释放的突释相,第2天累计释放率为32.91%,约为总量的1/3;而后释放速度逐渐减缓,即为缓释相,至第14天释放了66.99%,即总量的2/3。说明该微球在第2~14天又释放了1/3,其缓释性较好。比我们前期实验所做投料比为1∶3及1∶5的微球缓释性更好。
可能影响药物突释的原因。1)微球制作过程中部分没有完全包裹进去的药物停留在微球的表面、近表面或者内部空洞周围,在释放初期形成突释相。2) PLGA的质量及纯度,负荷药物的理化性质及载药量,微球制备方法及仪器参数等均是影响因素[7-8]。Bao等[9]的研究结果表明体外累积释放率与PLGA分子之间自我降解的程度与速度相关。本实验在初期选材时,就PLGA/PLA比例的选择参考了于力等[10]的研究,其研究报道PLGA含量较高时微球亲水性较差,但降解速度较PLA更快,二者适当比例混合可取长补短。其中以75/25和50/50比例制作出来的微球较好,但预实验时PLGA/PLA(75/25)跨距约100 μm,而PLGA/PLA (50/50)跨距约30 μm。因不是在同一时间所测,其差异不排除与制作参数及流程日益成熟有关。
关于生物相容性方面,溶血性实验是唯一由国家规定标准流程的检验方法[11]。其影响因素有微球的跨距、形状及浓度等。Tomic等[12]的研究表明在相同浓度下,微球的跨距与溶血率成反比,即跨距越大溶血率越小[13]。该现象可能与细胞的吞噬相关,尤其是微球跨距≤10 μm时更容易被外周巨细胞及巨噬细胞所吞噬加速其降解[11]。但微球跨距较大不容易通过注射器的针头,使其临床应用受限,所以微球跨距要适中。形状规则圆整的微球也与降低溶血率相关性较高[14-15]。本实验中的自制载药微球因其跨距为25 ~ 30 μm,不易被吞噬,并且形状规则圆整,通针率较高,对血细胞的破坏性较小。另外,浓度也是一重要影响因素,即不同浓度的微球溶液的溶血率也不同。Zhang等[16]的研究显示1.5 mg/mL的微球溶液溶血率较其他组别更低。该现象或许与溶液的渗透压或张力有关。目前,本研究自制的微球所配制不同浓度的溶液,其溶血率均未超过5%,说明该自制微球符合国家标准。
体内血液相容性实验显示该自制微球注入大鼠体内后,白细胞、红细胞和血小板的体积及计数与之前比较无统计学差异。但在白细胞分类方面却有明显影响,如大鼠注射微球6 h后,淋巴细胞占比明显升高,而中性粒细胞则反之。在大鼠注射微球12 h后,单核细胞占比也明显升高,而嗜酸粒细胞则反之。以上表象均可能与微球进入体内后被大鼠身体当作异物,从而导致白细胞的吞噬行为有关。Soliman等[17]的研究也提示了该现象,但并不能因此简单推断该微球的生物相容性欠佳,该现象却是大鼠身体对异物正常反应的结果。通常当微球进入体内后身体会出现一系列反应,主要分为三个阶段[18]。第一阶段:当微球刚进入体内时,体内的排异反应使药物与组织交界处发生炎症反应,且以嗜酸粒细胞与中性粒细胞浸润为主,本研究结果也与此类似。第二阶段:当微球进入体内14天后,在组织与药物交界处会发现纤维包裹现象。其出现与维持时间和微球降解速度有关。第三阶段:主要为微球降解后期,也就是微球已经逐渐降解为小颗粒之后的阶段。在本研究中,大鼠注射微球后第10天,皮下组织的病理切片并无炎症细胞浸润及其他皮肤组织病理性改变,另外注射部位的外观亦无明显变化,大鼠的行为学也无变化。所以并未做之后的病理切片。因为微球进入体内时,与病毒、细菌一样都会被认为是异物,引发细胞启动自身免疫系统,但微球对机体的治疗作用大于其启动免疫应答而引发的炎症反应,利大于弊。并且随着时间推移免疫反应会逐渐减弱直至消失。综上所述,该自制微球组织的相容性良好,注射后并未导致明显的炎症反应及其他不良表现。
总之,本研究自制的地塞米松PLGA磁性微球(1∶4),从跨距、包封率、产率、载药量方面评价均为良好,其血液及组织相容性也符合国家标准。因此该自制磁性微球为一种较理想的靶向给药载体。但本研究并未做体内释放试验,但初步推测由于身体内环境复杂因素的影响会导致体内释放速度和方式较体外释放均不同[19-20]。
