自制毛囊再生乳膏对小鼠皮肤创面毛囊再生的影响
2021-07-01孙梦黎奎1梅谨瑜赵安东付小兵
孙 浩,汤 茂,孙梦黎,秦 华,马 奎1,,梅谨瑜,赵安东,付小兵,4
1 解放军总医院医学创新研究部 创伤修复和组织再生研究中心,北京 100853;2 解放军总医院第四医学中心 全军创伤修复与组织再生重点实验室 皮肤损伤修复与组织再生北京市重点实验室,北京100048;3 天津医科大学,天津 300070;4 中国医学科学院 严重创伤救治和组织修复与再生医学创新单元,北京 100048;5 解放军总医院第一医学中心 组织再生与创面修复科,北京 100853
皮肤是人体最大的器官,易遭受外界因素的损伤。人体皮肤在遭受大面积创(烧)伤后,瘢痕愈合时缺失毛发等皮肤附属器,其中毛发难以再生是创面愈合时面临的主要问题之一。毛发的发育和生长依赖于毛囊中皮芽基细胞和真皮毛乳头的相互调控[1]。而在创面愈合过程中,这种上皮-间质调控关系遭到破坏。因此,重建毛囊上皮-真皮间质细胞的相互调控网络,是促进创面愈合时毛囊再生的突破点。大量研究发现,毛囊的发育和再生过程主要受到Wnt信号通路、Shh信号通路以及骨形态发生蛋白(bone morphogenetic protein,BMP)信号通路的调控[1-6]。对上述信号通路进行人为干预可促进受损皮肤愈合过程中毛囊再生。CHIR-99021是一种氨基嘧啶衍生物,可有效激活Wnt/β-catenin 信号通路,广泛参与毛囊形态发生和周期性生长的各个环节,也常用于诱导体细胞重编程的相关研究[7]。Purmorphamine是一种嘌呤衍生物,也是一种新型小分子平滑受体 (smoothened receptor,Smo) 激动剂,能够取代Shh与Smo结合从而促进Shh信号通路的表达,参与毛囊生长发育调控和毛囊干细胞的维持[8]。托法替尼是一种小分子JAK激酶(Janus kinase,JAK)抑制剂,具有抗炎作用,也可用于促进毛囊干细胞活化[9]。SJ000291942是一种人工合成的乙酰氨基类小分子化合物,可靶向激活BMP信号传导通路,参与调控毛囊周期性生长和毛囊基板形成,促进毛乳头细胞再生[10]。本研究将上述小分子化合物组合制备成药膏(以下简称毛囊再生乳膏),涂抹于成年小鼠背部皮肤全层缺损创面,探讨其诱导毛囊再生的可能性及相关机制,为创面修复过程中毛囊再生的药物研究提供实验依据。
材料和方法
1 实验动物 SPF级的健康C57BL/6小鼠45只,雌性,体质量(20±5) g,8周龄,由北京斯贝福生物技术有限公司提供,许可证号:SCXK (京)2019-0010。饲养于解放军总医院第四医学中心实验动物中心SPF级屏障环境(温度20℃ ~ 23℃,湿度50%~60%)。
2 主要试剂和仪器 小分子化合物CHIR-99021、Purmorphamine、Tofacitinib 和SJ000291942 (Med-ChemExpress公司,美国);凡士林(宁建医疗器械,中国);苏木精-伊红染色(HE)染色试剂盒和Masson染色试剂盒(索莱宝生物技术有限公司,北京);中性树胶(中杉金桥生物技术有限公司,北京);一抗:抗细胞角蛋白5(cytokeratin 5,CK5)、抗细胞角蛋白15(cytokeratin 15,CK15)、抗细胞角蛋白(cytokeratin 17,CK17)、抗β-catenin、抗头蛋白(Noggin)(Abcam,英国);抗转谷氨酰胺酶1(TGase 1)、抗音猬因子蛋白(Shh)(Santa Cruz,美国);抗波形蛋白(Vimentin)(Cell Signaling Technology公司,美国)、抗α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(Sigma公司,德国);抗Gli家族锌指蛋白1(Gli1)(博士德,中国);抗外皮蛋白(Involucrin)(Biolegend,美国)。荧光二抗:Alexa488和Alexa594(索莱宝生物技术有限公司,北京)。普通光学显微镜(Olympus公司,日本)、普通荧光显微镜和共聚焦激光扫描荧光显微镜(Leica公司,德国)。
3 毛囊再生乳膏的制备 用不同剂量的二甲亚砜(DMSO)分别溶解小分子化合物CHIR-99021、Purmorphamine、Tofacitinib、SJ000291942,制备成4种化合物母液。取适量凡士林装入50 mL离心管内,放入65℃烘箱烘烤至融化。量取1 mL凡士林装入EP管内,依次加入配制好的4种化合物母液并迅速混匀,冷却后的成品药膏中含有4种小分子化合物,各化合物终浓度见表1。对照组空白药膏制备:仅向凡士林中加入同剂量的DMSO,无其他化合物成分。毛囊再生乳膏在处理创面前临时制备,现配现用。
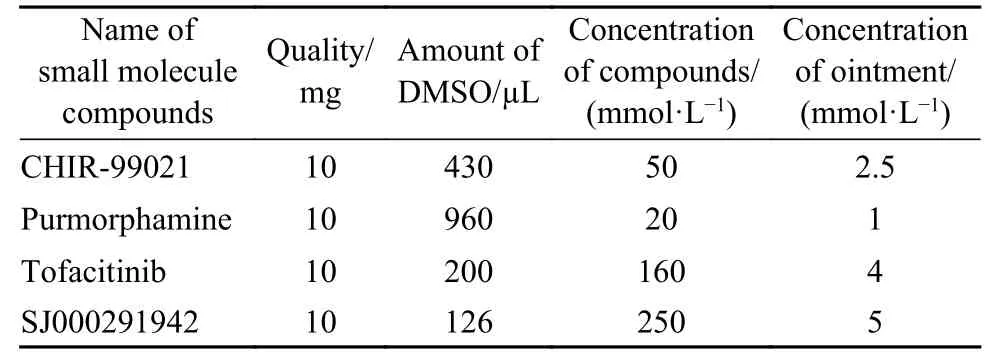
表1 四种化合物母液浓度及药膏终浓度Tab.1 Solution concentrations of the four compounds and concentration of the ointment
4 小鼠皮肤缺损模型制作与分组处理 取45只健康雌性C57BL/6小鼠,用1%戊巴比妥钠按50 mg/kg腹腔注射麻醉后,脱去小鼠背部皮肤毛发,并以脊柱为中线,两侧用直径为6 mm的圆形打孔器打孔,再用眼科剪进行修整,剪去多余组织,形成直径为6 mm的圆形全层皮肤缺损创面。每只小鼠背部左侧创面为用药组,右侧创面为对照组。造模后即刻,在左侧创面上涂抹约100 μL毛囊再生乳膏,在右侧创面涂抹等量空白药膏,两侧创面每天涂抹1次,连续涂抹28 d。造模后7 d、14 d、21 d、28 d随机选取10只小鼠进行取材,剩余5只小鼠作为替补,以防参与实验的小鼠中途死亡。将小鼠单笼喂养,自由摄食和饮水。
5 创面愈合率计算 造模后每两天用数码相机拍照背部创面,取第3 d、5 d、7 d、9 d、11 d小鼠背部创面照片,用ImageJ软件进行分析,每个时间点随机选取10只小鼠,分别计算用药组与对照组创面愈合率:
创面愈合率 =(创面初始面积-术后第n天的面积)/ 创面初始面积×100%。
6 常规组织病理学观察 造模成功后7 d、14 d、21 d、28 d采用脱颈法分别处死10只小鼠,取左右两侧创面组织,各放入预先标记的组织收集瓶中,迅速加入新鲜配制的4%多聚甲醛溶液固定,按常规石蜡切片方法进行脱水透明、浸蜡、石蜡包埋、切片(厚度为5 μm)。将组织切片在65℃烘箱内烤片2 h、脱蜡至水,行常规HE染色和Masson染色,观察创面愈合及毛囊生长情况。
7 免疫荧光染色 将组织切片常规脱蜡至水后置于柠檬酸钠抗原修复液中微波修复。用5%山羊血清封闭液封闭30 min。去除封闭液,分别加入一抗,包括抗CK5、CK15、CK17、抗β-catenin、抗Noggin、抗TGase 1、抗Shh、抗Vimentin、抗α-SMA、抗Gli1、抗Involucrin 4℃过夜。磷酸盐缓冲液清洗3次,加入Alexa 488和Alexa 594荧光二抗(1∶400),室温孵育1 h后磷酸盐缓冲液清洗3次,加入DAPI染色液进行染色10 min,磷酸盐缓冲液清洗3次。用中性树脂封片,荧光显微镜和共聚焦激光扫描荧光显微镜下拍照记录,观察表皮细胞分化、创面皮下纤维化、毛囊细胞特征性标志物Involucrin、TGase1、α-SMA、CK17、CK15、Noggin等表达等情况。
8 统计学方法 采用GraphPad Prism5软件进行统计分析。计量资料以表示。两组资料分别在不同时间点采用t检验比较。P < 0.05为差异有统计学意义。
结 果
1 实验动物情况 45只小鼠中,3只于造模当天因麻醉过量死亡,1只于造模后第1天死亡;剩余41只小鼠随机选择1只退出实验。参与实验的小鼠共计40只。
2 创面愈合率 造模后3 d左右,用药组和对照组创面均开始收缩。造模后7 d左右在创面开口处肉眼可见新生上皮组织,两侧无明显差异(图1A)。造模后11 d,两侧创面均趋于愈合,用药组与对照组的创面愈合率差异在各时间点均无统计学意义(P > 0.05),见图1B。

图1 毛囊再生乳膏处理创面后皮肤愈合情况 A:造模后3 d、5 d、7 d、9 d、11 d拍照。左侧创面为用药组,用毛囊再生乳膏涂抹,右侧创面为对照组,用空白药膏涂抹;B:造模后3 d、5 d、7 d、9 d、11 d创面愈合率比较,用药组与对照组创面愈合率在各时间点均无统计学差异(每个时间点n=10)Fig.1 Skin healing after hair follicle regeneration ointment treatment A: On day 3, 5, 7, 9, 11 after surgery, the left side of back skin was treated with small molecule-based ointment, and the right side of back skin was treated with control ointment; B: Comparison of wound healing rate on day 3, 5, 7, 9, 11 after surgery showed that there was no statistical difference in the wound healing rates between the treatment group and the control group at each time point (n=10 for each time point)
3 常规组织病理学观察 HE染色显示,造模后14 d用药组和对照组创面新生表皮细胞均覆盖创面,新生表皮层厚度、上皮细胞大小形态和排列无明显区别(图2A)。用药组创面表皮层细胞向下长出毛囊上皮芽基细胞,毛囊上皮芽基细胞底部长出新生的毛乳头细胞,部分毛囊周围还可见皮脂腺;而对照组创面表皮细胞向下长出毛囊上皮芽基细胞的情况较罕见,未见毛乳头样结构,且新生毛囊数量极少(图2A)。用药组与对照组新生毛囊数量在14 d、28 d均有统计学差异(图2B)。这些结果表明毛囊再生乳膏能够诱导全层皮肤缺损创面的毛囊再生。Masson染色发现,用药组与对照组创面皮下胶原纤维排列方式、密度、形态等特征无明显差异,且用药组新生的毛囊和毛乳头细胞生长在创面瘢痕中(图3)。以上表明毛囊再生乳膏促进创面毛囊再生与周围的瘢痕没有明显的关系。

图2 HE染色分析创面愈合和毛囊再生情况 A:黑色箭头示新生的毛囊上皮芽基细胞,造模后28 d用药组毛囊再生明显,对照组无明显毛囊再生(标尺=100 μm);B:实验组与对照组新生毛囊数量14 d、28 d时差异有统计学意义 (aP < 0.001)Fig.2 HE staining analysis of wound healing and hair follicle regeneration A: Black arrows indicates the de novo hair epithelial germ cells(scale bar=100 μm); B: There are statistically significant differences in the number of new hair follicles between the experimental group and the control group on day 14 and 28 (aP < 0.001)

图3 Masson染色分析创面纤维化瘢痕形成情况。用药组与对照组创面胶原纤维排列方式、胶原纤维密度等特征无显著差异(标尺=100 μm)Fig.3 Masson staining analysis of wound fibrosis.There is no significant difference between the treatment group and the control group in the pattern of collagen fiber arrangement and density of collagen fiber (scale bar=100 μm)
4 免疫荧光染色观察 免疫荧光染色显示,两侧创面表皮上层细胞在14 d均开始表达表皮细胞分化相关标志物Involucrin和TGase1(图4A,图4B),表皮基底层在造模后7 d、14 d、28 d均表达表皮干细胞的标志物CK5,用药组与对照组无明显差异(图5),表明毛囊再生乳膏对表皮细胞的发育无明显影响。用药组与对照组肌成纤维细胞标志物α-SMA的表达情况在造模后7 d、14 d、28 d均无显著差异(图5),说明毛囊再生乳膏对创面瘢痕增生无明显抑制作用。造模后14 d,用药组新生的毛囊上皮芽基细胞表达其特征性标志物CK17(图6A)、毛囊细胞特征性标志物CK15(图6B)。新生毛乳头细胞表达其特征性标志物Noggin(图6C)。而对照组未见CK17、CK15、Noggin显色,进一步证实了毛囊再生乳膏对小鼠皮肤创面毛囊再生的促进作用。
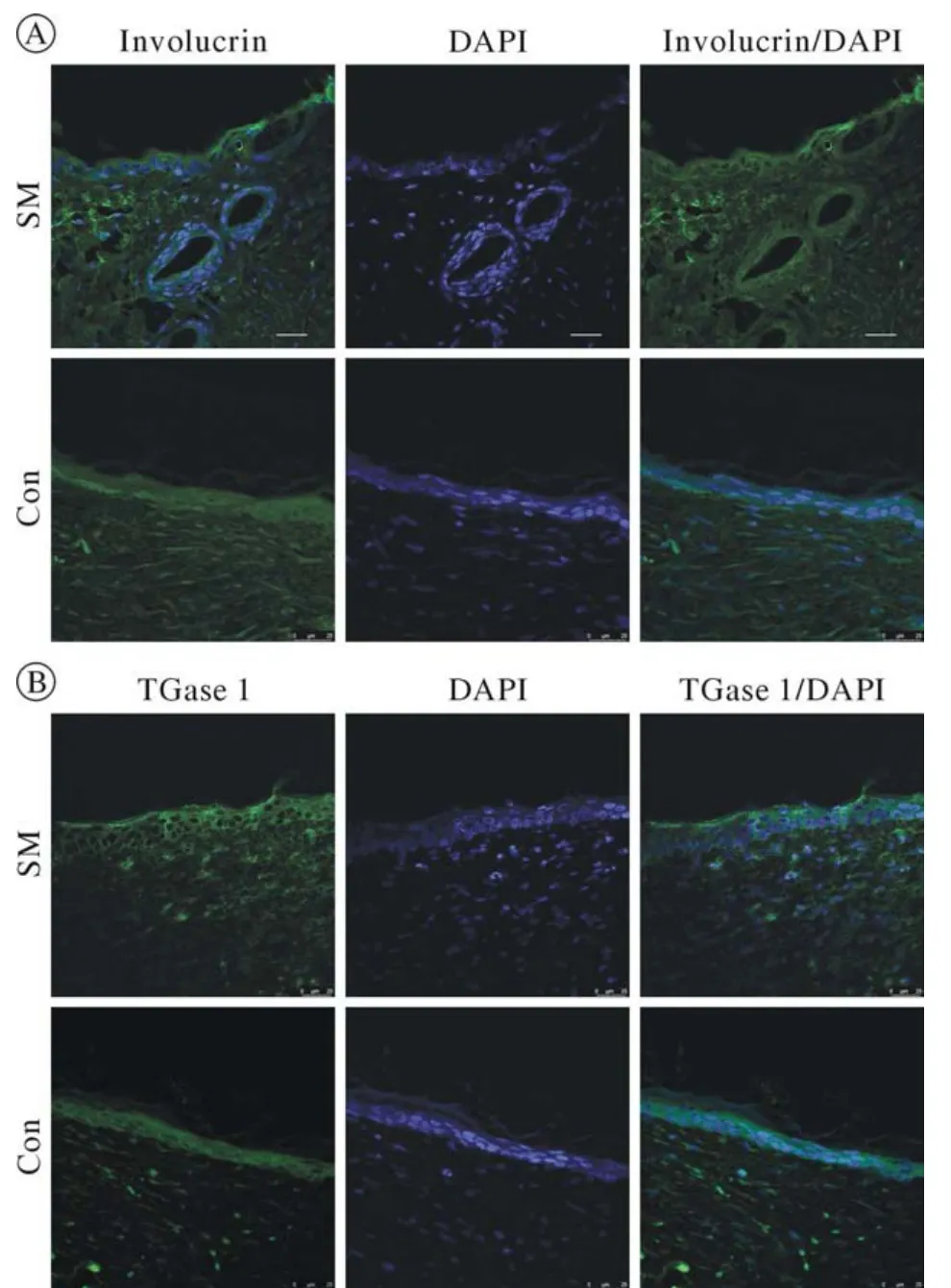
图4 造模后14 d免疫荧光染色分析创面表皮细胞分化标志物Involucrin (A)和TGase1 (B)。绿色荧光为表皮细胞,蓝色荧光为细胞核(标尺=25 μm)Fig.4 Immunofluorescence staining for epidermal cell differentiation-associated markers Involucrin (A) and TGase 1 (B) on day 14 after surgical operation.Epidermis cell is green, and the cell nucleus is blue (scale bar=25 μm)
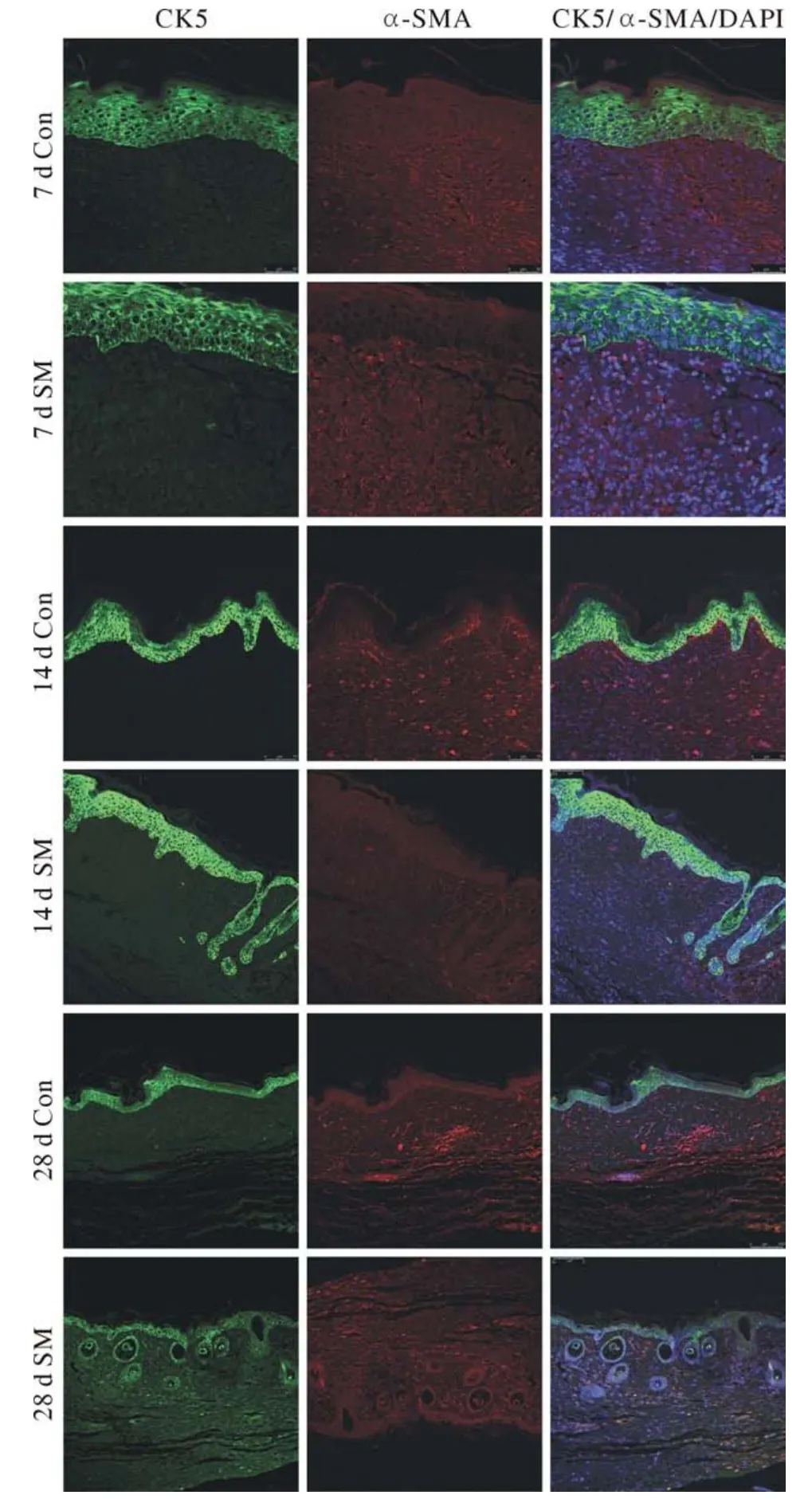
图5 创面表皮干细胞、毛囊上皮芽基细胞标志物CK5和肌成纤维细胞标志物α-SMA表达变化情况免疫荧光分析。绿色为表皮细胞、毛囊上皮芽基细胞。红色为肌成纤维细胞。蓝色为细胞核(标尺=25 μm)Fig.5 Immunofluorescence staining for the hair epithelial germ cell and epidermal stem cell marker CK5 and myofibroblastspecific marker α-SMA.Epidermis cell and hair epithelial germ cell is green, myofibroblast is red, and cell nucleus is blue (scale bar=25 μm)
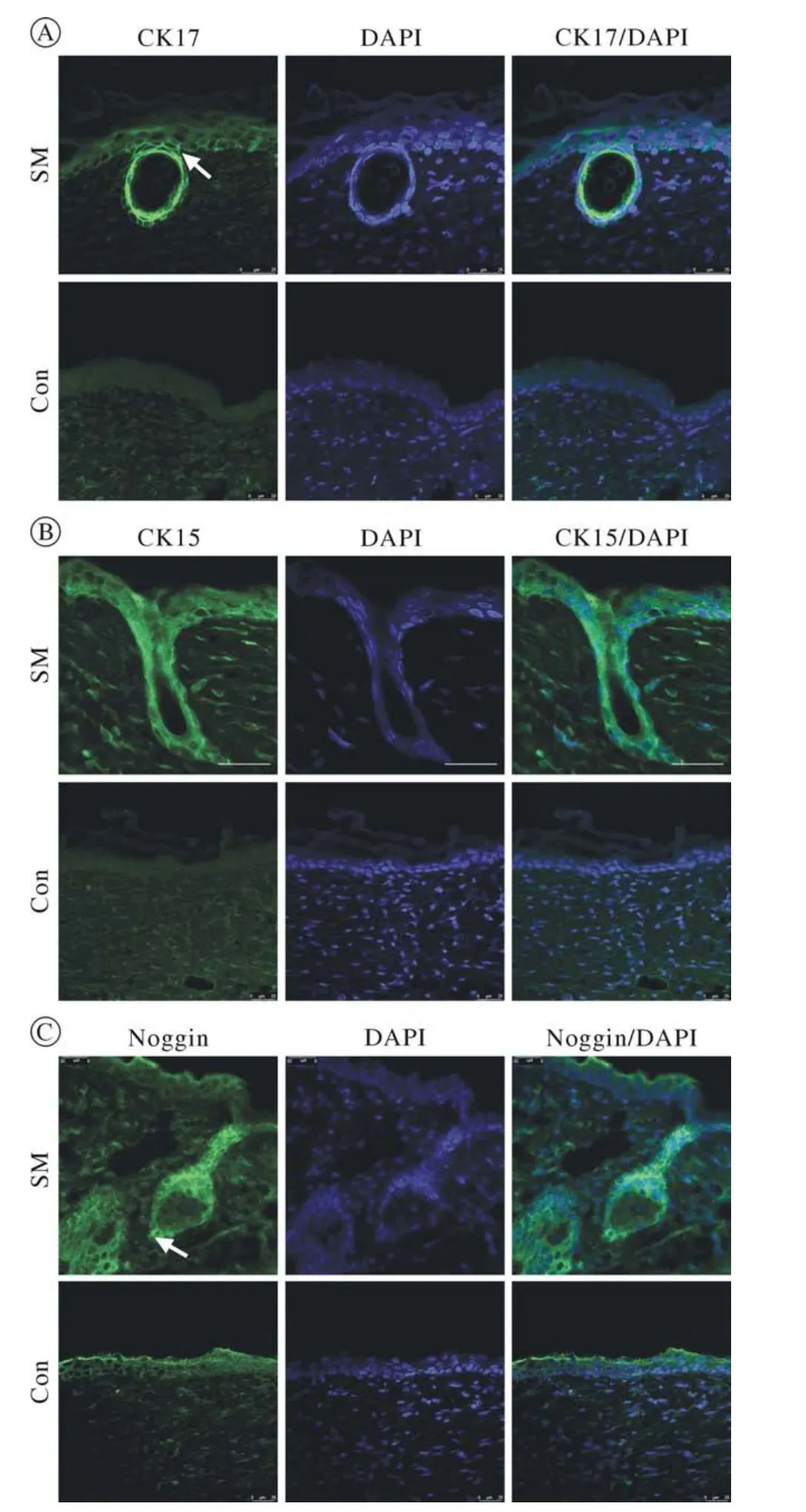
图6 造模后14 d免疫荧光染色分析创面毛囊上皮芽基细胞标志物CK17 (A)、毛囊细胞特征性标志物CK15 (B)和毛乳头细胞标志物Noggin (C)。A中箭头处为新生的毛囊上皮芽基细胞,C中箭头处为毛乳头细胞(标尺=25 μm)Fig.6 Immunofluorescence staining for hair epithelial germ cell marker CK17(A), hair follicle cell marker CK15(B), and dermal papilla cell marker Noggin (C) on day 14 after surgical operation.White arrows in A indicates the de novo hair epithelial germ cells, and in C indicates the de novo dermal papilla cells (Scale bar=25 μm)
5 毛囊再生乳膏对Wnt、Shh信号通路的作用免疫荧光染色显示,造模14 d后用药组创面新生的表皮细胞、毛囊上皮芽基细胞、新生毛乳头细胞中Wnt信号通路下游关键蛋白β-catenin显色明显,并且在部分表皮细胞、毛囊芽基细胞胞核处可见绿色荧光显色,这表明β-catenin表达水平上调,且已转移到细胞核;而对照组创面表皮层βcatenin表达较弱,且未进入细胞核,创面组织中未见β-catenin阳性的毛囊芽基细胞或毛乳头细胞(图7A)。用药组创面新生的毛囊上皮芽基细胞和毛乳头细胞中Shh信号通路的重要配体Shh以及下游因子Gli1显色明显,提示Shh、Gli1表达水平上调(图7B,图7C),而对照组Shh、Gli1表达均不明显。这提示着毛囊再生乳膏可能通过激活Wnt、Shh信号通路促进毛囊再生。
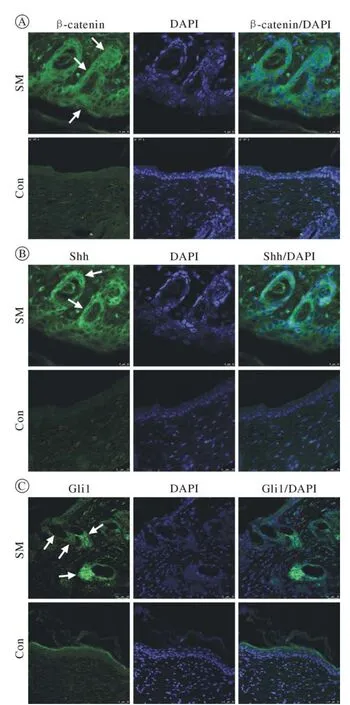
图7 造模后14 d免疫荧光染色分析Wnt信号通路下游关键蛋白β-catenin (A)表达情况、Shh信号通路的配体Shh (B)和下游关键因子Gli1 (C)表达情况。A、B中表皮细胞、毛囊上皮芽基细胞、毛乳头细胞显示为绿色,箭头处为毛囊上皮芽基细胞。C中箭头处为毛乳头细胞,Gli1高表达。蓝色为细胞核(标尺=25 μm)Fig.7 Immunofluorescence staining for the Wnt signaling downstream factor β-catenin (A) and the Shh signaling ligand Shh(B) and its downstream factor Gli1 (C).Epidermis cell, hair epithelial germ cell and dermal papilla cell in A and B is green, white arrows indicates the hair epithelial germ cell.White arrows in C indicates the dermal papillas, which express Gli1 strongly.Cell nucleus is blue in A, B, C (scale bar=25 μm)
讨 论
毛囊、皮脂腺和汗腺等皮肤附属器再生是损伤皮肤完美修复的必要条件。尤其是毛囊的再生,不仅对创面愈合十分重要,对治疗高发生率的秃发也具有重要意义[9]。毛囊的发育和再生需要形成毛囊上皮芽基细胞和真皮毛乳头细胞,并且需要二者持续相互调控。Wnt信号通路、Shh信号通路在毛囊发育和再生过程起着关键性作用。在创面表皮细胞中激活Wnt信号通路能够诱导毛囊上皮芽基细胞形成和毛囊的再生[3]。Wnt信号通路激活还能诱导真皮成纤维细胞分化为毛乳头细胞,并维持真皮毛乳头细胞引导毛囊形成的能力[6,11-13]。在创面表皮细胞中,Shh的过度表达能够诱导毛囊芽基细胞形成和毛囊的再生,毛囊上皮芽基细胞和真皮毛乳头细胞均能分泌Shh蛋白,从而激活Shh信号通路,形成正反馈调节网络,诱导毛囊上皮芽基细胞向下持续生长[1,14]。真皮层中Shh的过度表达也能诱导成纤维细胞分化为毛乳头细胞,促进毛囊再生[15]。BMP信号通路的表达能诱导真皮成纤维细胞重编程为毛乳头细胞[13]。本研究利用小分子化合物CHIR-99021激活Wnt信号通路;Purmorphamine激活Shh信号通路;SJ000291942促进成纤维细胞再分化为毛乳头细胞;Tofacitinib通过抑制JAK/STAT信号通路,辅助激活Wnt和Shh信号通路,活化毛囊干细胞[9,16]。这些小分子化合物重建了创面愈合过程中毛囊再生的信号调控网络。
本研究选择了成年小鼠背部皮肤全层缺损的小面积创面,这是因为大面积创面(>2 cm2)能够诱发创面中心部分再生少量毛囊,影响实验结果,而小面积创不会诱发毛囊再生[17]。本研究中,对照组毛囊再生数量极少,而用药组创面新生出较多毛囊,其周围还有新生皮脂腺。胎儿皮肤创面不易留瘢痕,但成年后容易留瘢痕,因此有学者提出纤维化是抑制皮肤附属器再生的重要因素[18]。本研究发现新生的毛囊和皮脂腺生长于瘢痕中,这表明瘢痕可能不是抑制毛囊再生的最重要因素。本研究发现,Wnt信号通路下游关键因子β-catenin在细胞质和细胞核积累,说明毛囊再生乳膏激活Wnt信号通路是形成毛囊上皮芽基细胞的重要因素。我们也观察到了Wnt信号通路在新生的真皮毛乳头细胞中激活。这与Wnt信号通路调控毛囊上皮芽基细胞命运和维持毛乳头细胞引导毛囊再生能力的相关研究报道结果一致[11-13]。Lim等[1]报道Shh信号通路在创面表皮细胞中过表达,可促使创面瘢痕中再生出毛囊,这也说明瘢痕不是阻碍毛囊再生的关键因素。
Shh信号通路激活是促进毛囊上皮芽基细胞形成和持续生长的关键。通过免疫荧光和免疫组化染色发现在新生的毛囊上皮芽基细胞中Shh表达水平明显增加。在新生的真皮毛乳头细胞中,同样检测到Shh表达上调。说明毛囊再生乳膏可增强Shh信号通路表达,调控毛囊上皮芽基细胞和真皮毛乳头细胞形成。这与Purmorphamine和Tofacitinib能够激活Shh信号通路相吻合[9,19]。重建毛囊上皮芽基细胞和毛乳头细胞是毛囊再生的必备条件。我们推测小分子化合物CHIR-99021、Purmorphamine和Tofacitinib在创面表皮细胞中激活了Wnt信号通路和Shh信号通路,诱导创面新生表皮细胞再分化为毛囊上皮芽基细胞。而在真皮中CHIR99021、SJ000291942、Purmorphamine和Tofacitinib诱导真皮成纤维细胞向毛乳头细胞分化,从而再生出真皮毛乳头细胞。有研究报道在体外激活Wnt和BMP信号通路能诱导真皮成纤维细胞向毛乳头细胞重编程[11-13,20]。激活创面真皮层Shh信号通路可促使成纤维细胞分化为毛乳头细胞[1]。这些研究支持了我们的推测。
综上,本研究通过制备毛囊再生乳膏促进创面愈合过程中毛囊再生。鉴于其便捷性和使用安全性,有望进一步转化为创面治疗药物应用于临床。本研究认为,通过调控创面愈合过程中的关键信号通路实现原位重编程获取皮肤再生所需的种子细胞,或许可达到皮肤及附属器再生的目的。
