探讨非小细胞肺癌术后患者PD-L1表达水平与临床病理特征的关系
2021-07-01智晓玉李卫威陶海涛张智博葛祥伟汪进良
智晓玉,李卫威,燕 翔,陶海涛,张智博,葛祥伟,汪进良
1 解放军总医院第五医学中心 肿瘤内科,北京 100039;2 解放军总医院研究生院,北京 100853;3 解放军第八十一集团军医院 肿瘤内科,河北张家口 075000;4 解放军总医院第一医学中心 肿瘤内科,北京 100853
非小细胞肺癌(non-small cell lung cancer,NSCLC)是全球癌症最主要死亡原因之一[1]。免疫检查点抑制剂抗程序性细胞死亡受体1/程序性细胞死亡配体1(PD-1/PD-L1)抑制剂正在改变NSCLC患者的治疗模式。在精准治疗的时代背景下,能够筛选出PD-1/PD-L1抑制剂的潜在获益者尤为重要。早先一项研究通过免疫组织化学(immunohistochemistry,IHC)对42例患者肿瘤细胞的PD-L1表达进行检测,将PD-L1表达高于5%定义为PD-L1表达阳性,在25例PD-L1阳性表达患者中有9例(36%)对Nivolumab表现出客观应答,而另外17例PD-L1表达阴性患者均无客观应答[2]。该研究发现,肿瘤细胞PD-L1表达阳性患者对Nivolumab的治疗反应可能更好。Keynote研究结果也进一步体现了肿瘤细胞PDL1的表达水平对于预测Pembrolizumab治疗疗效的重要性[3-5]。目前,利用IHC检测PD-L1表达水平是美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于晚期NSCLC患者一线Pembrolizumab治疗的唯一生物标志物[3-4]。尽管PD-L1表达水平与PD-1/PD-L1抑制剂预后具有相关性得到广泛认可,但其与患者临床病理特征的关系仍然不清晰。因此,我们收集了NSCLC患者术后肿瘤组织中PD-L1表达情况的资料,并进一步探究其与临床病理特征的关系。
资料与方法
1 资料 收集2019年3 - 8月在解放军总医院第一医学中心确诊并接受手术治疗的NSCLC患者临床资料。纳入标准:1)病理学诊断为肺腺癌或肺鳞癌并同时运用22C3抗体完成免疫组化PD-L1检测;2)病历资料完整,包括年龄、性别、吸烟史、T分期、N分期、TNM分期、胸膜浸润、Ki-67表达、EGFR基因突变状态、ALK基因突变状态。2)排除标准:1)病理诊断为腺鳞癌、大细胞癌或小细胞肺癌;2)合并其他原发性肿瘤;3)术前进行过抗肿瘤治疗;4)肺腺癌未进行EGFR和ALK状态检测或具有多个基因突变的患者。TNM分期采用美国癌症联合委员会(AJCC)第8版[6]。
2 免疫组织化学检测PD-L1、ALK以及Ki-67表达 手术切除标本用10%甲醛固定并进行石蜡包埋。将4 μm厚的切片进行脱蜡抗原修复,灭活内源性过氧化物酶后进行封闭。然后分别滴加PDL1一抗(22C3,Agilent Technologies,美国)、ALK一抗(D5F3,Cell Signal Technology,美国)、Ki-67一抗(MIB1,Santa Cruz,中国上海),并于4℃冰箱中过夜。二抗孵育DAB显色苏木素复染分化、脱水、透明封片。按以下方法进行各项检测结果判读:1)PD-L1表达肿瘤比例评分(tumor proportion score,TPS)为任意强度下部分或完全膜染色肿瘤细胞的百分比,TPS<1%为PD-L1表达阴性,≥ 1%为阳性[4]。2)ALK 阳性判定标准:细胞质内出现强棕黄色颗粒状染色为阳性,无强颗粒状染色为阴性。3)Ki-67染色结果评估:细胞核呈现棕黄色颗粒为阳性表达,不着色为阴性。染色结果由两名病理科副高级职称医师独立评估,如果评估结果存在差异,则一起审查切片以达成共识。
3 分析指标 1)对比肺腺癌与肺鳞癌临床病理特征差异;2)分别评估肺腺癌、肺鳞癌肿瘤组织PD-L1表达水平与患者临床病理特征(年龄、性别、吸烟史、T分期、N分期、TNM分期、胸膜浸润、Ki-67表达、EGFR基因突变状态、ALK基因突变状态)的关系。
4 统计学方法 使用SPSS26.0进行统计分析。计量资料以表示,采用t检验;不符合正态分布且方差不齐时采用Kruskal-Wallis秩和检验。计数资料以例数(百分比)表示,采用χ2检验;当样本量<40或理论频数<1时采用Fisher确切概率法。采用Spearman方法分析PD-L1与Ki-67表达的相关性。基于单因素分析结果构建logistic多因素回归模型以评估PD-L1表达水平的影响因素。P<0.05为差异有统计学意义。
结 果
1 被纳入患者的临床特征 共178例患者纳入本研究。其中82例(46.1%)男性,96例(53.9%)女性,中位年龄58.7(38~79)岁。42例(23.6%)既往有吸烟史。T分期为T1期83例(46.6%),≥ T2期95例(53.4%)。N分期为N0期149例(83.7%),≥ N1期29例(16.3%)。术后TNM病理分期为Ⅰ期120例(67.4%),≥Ⅱ期58例(32.6%)。病理类型为腺癌151例(84.8%),鳞癌27例(15.2%)。侵及胸膜的患者有69例(38.8%)。TPS<1%有86例(48.3%),≥ 1%有92例(51.7%)。EGFR突变患者有60例(33.7%)。ALK融合突变患者有18例(10.1%)。共有163例(92%)患者进行了Ki-67检测,表达水平为20.4%±21.3%。患者临床特点见表1。
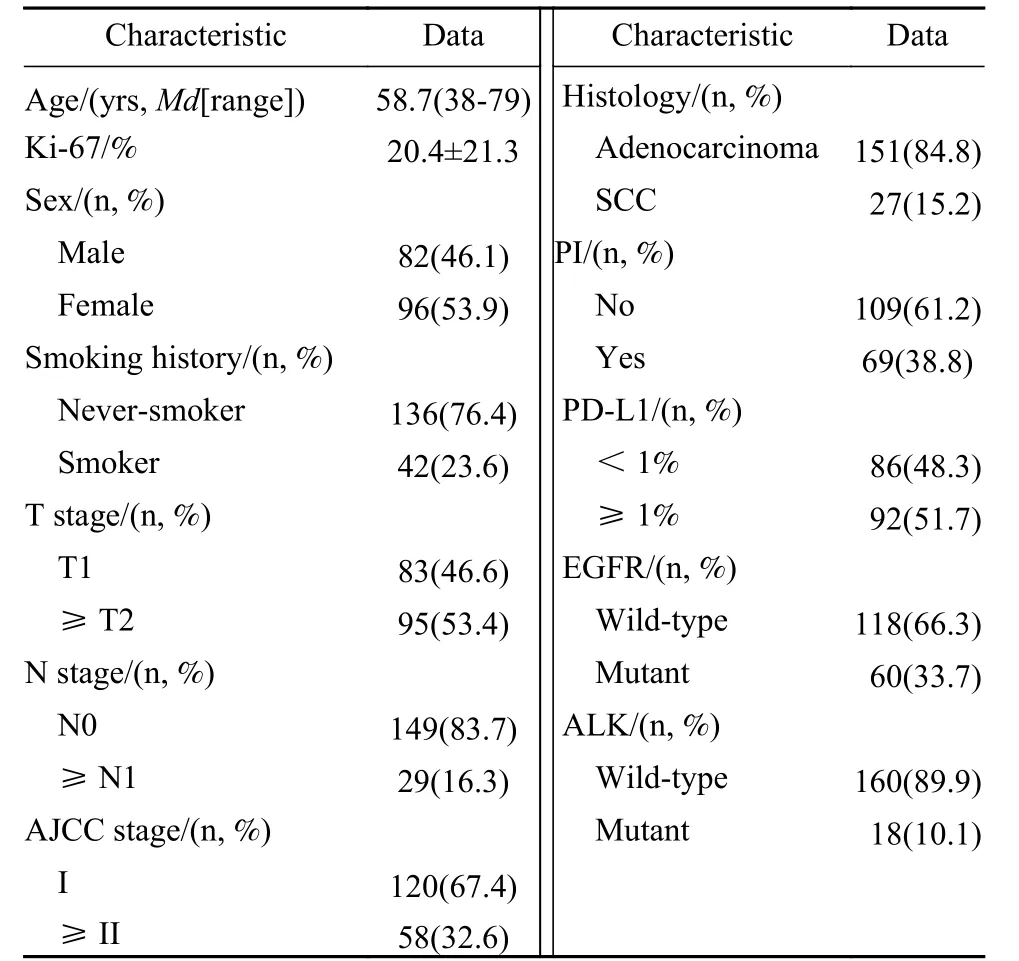
表1 NSCLC患者一般资料与临床病理特征Tab.1 Clinical and biological characteristic in the NSCLC patients
2 腺癌与鳞癌组临床病理特征比较 腺癌组出现侵及胸膜的患者比例高于鳞癌组(44.4% vs 7.4%,P<0.05)。EGFR、ALK基因突变病理均为腺癌。鳞癌组年龄大于腺癌组(64.4岁 vs 57.7岁,P<0.05),男性多于腺癌组(96.3% vs 37.1%,P<0.001),PDL1表达水平高于腺癌组(77.8% vs 47.0%,P<0.05),Ki-67表达水平明显高于腺癌组(53.6% ±18.8% vs 16.3% ±17.7%,P<0.05)。见表2。

表2 腺癌组和鳞癌组的临床特征比较Tab.2 Clinicopathological features comparison between the lung adenocarcinoma group and squamous cell carcinoma group
3 PD-L1表达水平与临床病理特征的关系 考虑到肺腺癌与肺鳞癌临床病理特征本身存在差异性,本研究接下来将分别探究二者临床病理特征与PD-L1表达水平的关系。在肺腺癌组中,单因素分析显示淋巴结转移及Ki-67表达水平与PDL1表达水平相关(P<0.05)。多因素分析中应变量为PD-L1表达状况,赋值1为PD-L1表达 ≥ 1%,赋值0为PD-L1表达<1%。自变量为单因素分析中P<0.15的指标(T分期、TNM病理分期、EGFR基因突变状态、N分期以及Ki-67表达水平)。回归过程采用全模法。回归结果显示,有淋巴结转移的患者PD-L1表达水平高于无淋巴结转移患者(OR=3.392,95% CI:1.055~10.90,P=0.040);Ki-67表达水平较高的患者PD-L1表达水平较高(OR=1.028,95% CI:1.004~1.054,P=0.024)。EGFR、ALK基因突变状态与PD-L1表达水平无显著相关性,见表3。Spearman相关性分析显示PD-L1与Ki-67表达水平呈正相关(r=0.363,P<0.001),见图1。肺鳞癌组由于病例数太少未做进一步分析。
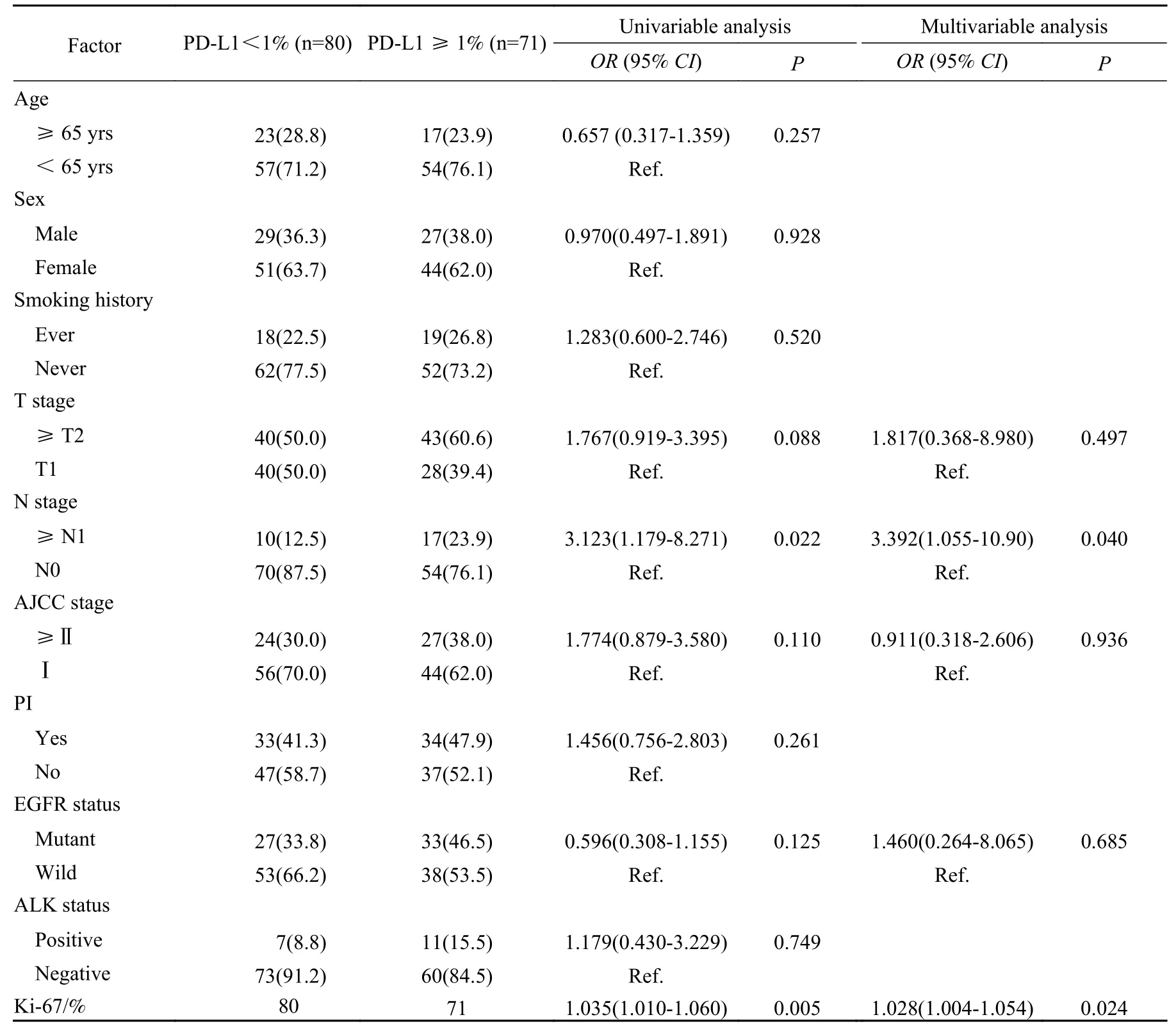
表3 多因素logistic分析PD-L1表达水平与肺腺癌临床病理特征的关系(n, %)Tab.3 Multivariate logistic regression analysis of clinicopathological features to predict PD-L1 expression in lung adenocarcinoma (n, %)

图1 肺腺癌患者PD-L1与Ki-67表达水平相关性散点图(n=151)Fig.1 Scatter plot depicting the relationship between PD-L1 expression and Ki-67 index in lung adenocarcinoma.Statistical analysis of the data was performed using the nonparametric Spearman test (n=151)
讨 论
免疫治疗的飞速发展带来了肺癌治疗的新曙光。PD-L1表达水平是NSCLC患者进行PD-1/PDL1抑制剂治疗的重要生物标志物。然而,PDL1表达水平与患者临床病理特征的相关性仍存在争议。目前,通过IHC检测PD-L1表达的抗体主要包括SP263、SP142(Ventana)以及28-8、22C3(Dako,Carpinteria,CA,U.S)[7]。在我国,运用22C3抗体通过IHC进行NSCLC肿瘤组织PDL1表达水平检测的报道较少。并且,既往研究显示经过不同的抗肿瘤药物治疗后会影响肿瘤组织PD-L1表达水平[8-9]。因此,本研究收集了术前未进行过抗肿瘤治疗并且通过IHC(22C3抗体)检测PD-L1表达水平的NSCLC患者临床资料,分析了PD-L1表达水平与临床病理特征的关系。
本研究中,纳入患者PD-L1阳性表达率为51.7%,这与之前的研究结果基本一致[10-11]。肺鳞癌组PD-L1表达明显高于腺癌组,但未发现鳞癌组临床病理特征与PD-L1表达水平存在相关性。肺腺癌组中,单因素及多因素分析发现PD-L1表达水平与淋巴结转移以及Ki-67表达水平有相关性,这与Xue等[12]和Lee等[13]的研究结果一致。既往研究结果显示,Ki-67表达于增殖性肿瘤细胞中,与肿瘤的增殖、转移及预后关系密切[14-15]。Pawelczyk等[16]在研究过程中发现NSCLC患者PD-L1表达水平较高,与肿瘤的增殖及侵袭性增强相关,并且这种相关性在肺腺癌中更为显著。我们在研究过程中通过Spearman相关性分析发现了Ki-67及PD-L1表达水平呈正相关,但目前它们之间的具体影响机制尚未明确,需要进一步探索。
由于东亚国家NSCLC患者EGFR基因突变概率明显高于西方国家[17],因此存在EGFR基因突变的NSCLC患者对PD-1/PD-L1抑制剂的响应受到广泛关注。但多项临床研究显示PD-1/PD-L1抑制剂对存在EGFR基因突变的NSCLC患者治疗疗效欠佳[4,18-20]。在深入研究的过程中发现,EGFR基因突变状态以及不同突变位点可能是通过影响PD-L1表达水平对治疗疗效产生影响,但目前的研究结果却存在不一致性[21-23]。因此,对该研究方向的进一步探讨是十分有必要的。本研究发现EGFR基因突变的状态对PD-L1表达水平无特异性影响。同时,我们也并未发现ALK基因突变与PD-L1表达水平的相关性,该研究结果与Yang等[23]以及Koh等[24]的研究结果一致。
本研究存在一定的局限性:1)本研究为回顾性研究,纳入病例数量较少;2)本研究纳入的是早期可手术肺癌患者,淋巴结分期多为N0/N1期,因此未能将其他不同淋巴结分期(N2/N3)单独与PD-L1表达水平的相关性进行分析;3)参加本研究的患者大部分尚未接受抗肿瘤药物治疗,缺乏生存随访数据。
综上所述,肺鳞癌以及存在Ki-67高表达或淋巴结转移的肺腺癌患者PD-L1表达水平可能较高。期待本研究结果可以为筛选PD-L1表达水平较高的NSCLC患者提供参考依据,使更多患者受益于PD-1/PD-L1抑制剂治疗。
