阻塞性睡眠呼吸暂停与恶性肿瘤的相关性*
2021-06-30马炳亚李梦真王玥慧林事成庄垚雪李泉旺
马炳亚 李梦真 王玥慧 林事成 庄垚雪 李泉旺
(1.北京中医药大学,北京 100029;2.北京中医药大学东方医院肿瘤科,北京 100078)
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种睡眠时上气道塌陷阻塞引起的呼吸障碍性疾病,常伴有打鼾、睡眠结构紊乱等。OSA是最常见的导致睡眠相关的呼吸紊乱的疾病,常见于老年人、男性和肥胖人群[1]。在世界范围内,有9.3亿人患有OSA,其中有4.2亿患者表现为中度至重度[2]。我国的流行病学调查也表明,20岁以上成人OSA的患病率为5.1%[3],60岁以上老年人的OSA患病率更是高达32.5%[4]。慢性间歇性缺氧(chronic intermittent hypoxia,CIH)是OSA的主要病理表现。近年来,多项动物实验及临床研究开始关注OSA与恶性肿瘤的相关性。Kang等[5]发现诱导肿瘤的小鼠在间歇性低氧的环境下,相较正常室内空气的小鼠,肿瘤体积及数目均增加。Deniau等[6]发现CIH环境下的小鼠,相较于暴露在常氧环境下的小鼠,上皮细胞增值增加,有助于肿瘤的发展。在临床研究方面,Jara等[7]发现在美国退伍军人队列中,先前存在OSA与随后的癌症发生密切相关,同时排除了年龄、吸烟、饮酒、肥胖等已知恶性肿瘤危险因素的影响。而Kendzerska等[8]却认为OSA的严重程度与恶性肿瘤的发生无关。同时,多篇系统综述也得出了不一致的结论。因此,本文通过检索数据库,在前期系统综述的基础上,纳入近年新发表的多项大样本临床研究进行系统综述和meta分析,以定量分析和探究OSA是否与恶性肿瘤的发生独立相关,为OSA及恶性肿瘤的防治提供参考。
1 资料与方法
1.1 检索策略 由2名研究者分别对中国知网、万方、维普、Pubmed、EMbase、Cochrane Library等数据库进行检索。检索时间限定为数据库成立至2020年6月17日,语言不限。中文检索词包括:睡眠呼吸暂停、间歇低氧、瘤、癌等。英文检索词包括:apnea、obstructive、sleep apnea syndromes、sleep disordered breathing、hypoventilation、intermittent hypoxia及cancer、neoplasms、carcinoma、tumor、malignancy等。
1.2 纳入与排除标准 纳入标准:①暴露组或病例组为明确诊断OSA患者。②非暴露组或对照组为未患OSA的人群。③结局指标为新发恶性肿瘤。④研究设计类型为队列研究或病例对照研究。⑤原文直接提供或可根据原文数据计算出比值比(odds ratio,OR)、相对危险度(relative risk,RR)或风险比(hazard ratio,HR)。排除标准:①综述、摘要、病例报告、通讯。②动物实验研究。③基线未排除已有恶性肿瘤患者的研究。④数据不完整的文献。同时,对使用相同研究人群数据的文献,本研究仅纳入最新、相关或最全面的文献。
1.3 资料提取和质量评价 本研究由两名研究者独立按照纳入、排除标准筛选文献并提取相关信息,并按照纽卡斯尔-渥太华量表 (The Newcastle-Ottawa Scale,NOS)对文献逐条进行质量评价[12]。≥6分为高质量文献,<6分为低质量文献。提取的信息主要包括:第一作者、文献发表时间、国家或地区、研究设计类型、研究对象特征、样本量、随访时间、新发恶性肿瘤数量、恶性肿瘤类型、调整各种混杂因素后的HR值(如有)、控制的混杂因素(如有)等。另外,部分文献根据呼吸暂停低通气指数(Apnea-hypopnea Index,AHI)或呼吸紊乱指数(Respiratory Disorder Index,RDI)对OSA的严重程度进行分级:正常(AHI或RDI <5次·小时-1),轻度OSA(AHI或RDI 5~14.9次·小时-1),中度OSA(AHI或RDI 15~29.9次·小时-1)和重度OSA(AHI或RDI≥30次·小时-1)。对此类文献,在提取上述信息的基础上,同时提取不同程度OSA对应的调整后HR值。如双方意见不一致且经过讨论不能解决,将与第三方共同讨论,得出明确的结论。
1.4 统计学分析 采用Stata 15.0软件进行meta分析,计算二分类变量的RR或OR 值及95%CI,并对部分文献提供的调整后HR值及95%CI,先对其进行对数转化,再合并分析。异质性采用Q检验和I2统计量进行评估,I2≤30%则采用固定效应模型,I2>30%采用随机效应模型。此外,按照不同地区人群进行亚组分析探讨异质性的来源,并对提供轻、中、重度OSA调整后HR值的文献合并分析。运用Begg秩相关检验和Egger回归定量检验发表偏倚,如P>0.05则表示不存在明显的发表偏倚。同时,通过逐项剔除纳入研究并计算剩余文献合并值的方法进行敏感性分析。Meta分析中P<0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 本研究共纳入10篇文献,均为队列研究,发表年限为2013~2020年,共纳入病例1 789 966例。研究人群来自台湾、韩国、美国、澳大利亚、加拿大、以色列、西班牙等国家或地区。文献质量评分均≥6分,为高质量文献,见表1。
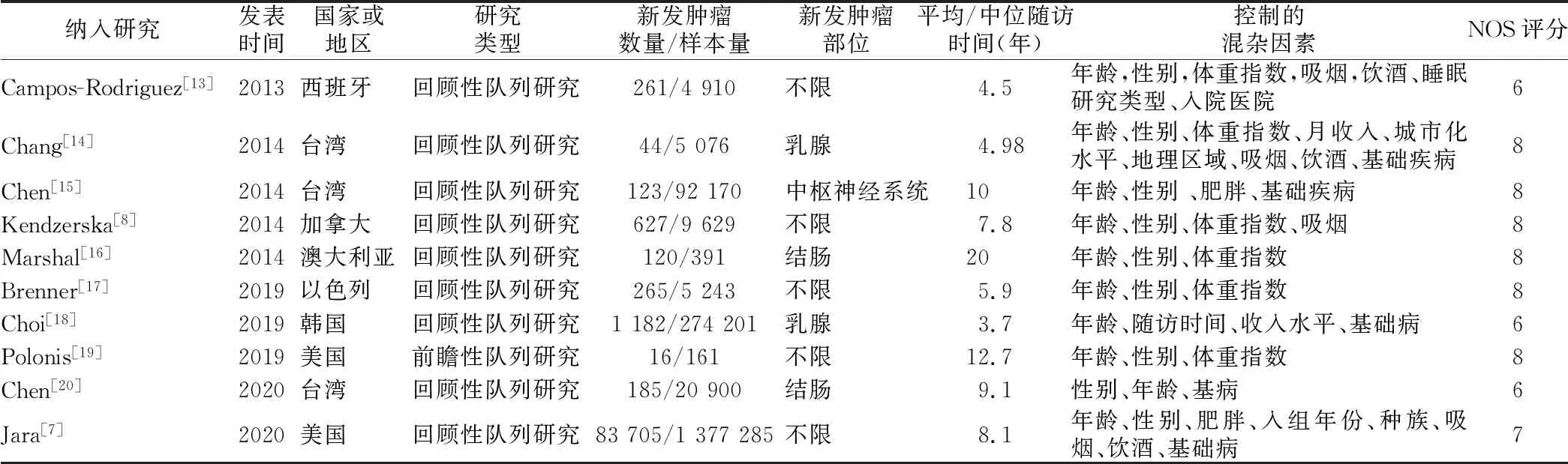
表1 纳入文献的基本特征Table 1 Basic characteristics of included literature
2.2 OSA与恶性肿瘤相关性分析
2.2.1 OSA患者与非OSA患者恶性肿瘤发生率的比较 对提供OSA组与非OSA组恶性肿瘤发病率的9篇研究进行分析,结果显示,OSA患者恶性肿瘤发生率较非OSA患者高52%(OR=1.52,95%CI:1.13~2.06,P=0.006),见图1。
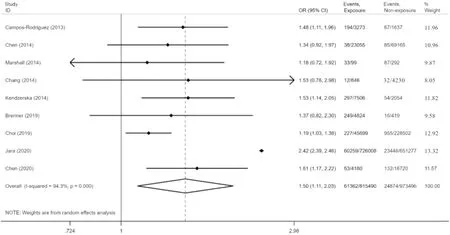
图1 OSA患者与非OSA患者恶性肿瘤发生率的比较Figure 1 Comparison of the incidence of malignant tumors between OSA patients and non-OSA patients
2.2.2 OSA患者与非OSA患者恶性肿瘤风险的比较 对提供OSA组与非OSA组恶性肿瘤调整后HR值的6篇研究进行分析,结果显示,在排除性别、年龄、肥胖等混杂因素的影响后,OSA患者恶性肿瘤风险是非OSA患者的1.65倍(HR=1.65,95%CI:1.24~2.20,P=0.001),见图2。I2=88.3%,异质性较大,故采用亚组分析探讨异质性来源。

图2 OSA患者与非OSA患者恶性肿瘤风险的比较Figure 2 Comparison of malignant tumor risk between OSA patients and non-OSA patients
2.2.3 不同地区OSA患者与非OSA患者恶性肿瘤风险的比较 依据研究人群所在地区不同进行亚组分析发现,在亚洲人群中,OSA患者恶性肿瘤的风险较高(HR=1.50,95%CI:1.15~1.96,P=0.003);在欧美人群中,也可得出相似的结果(HR=1.97,95%CI:1.94~2.00,P<0.001),见图3。

图3 不同地区OSA患者与非OSA患者恶性肿瘤风险的比较Figure 3 Comparison of malignant tumor risk between OSA patients and non-OSA patients in different regions
2.2.4 不同程度OSA患者恶性肿瘤的风险 对提供轻、中、重度OSA患者恶性肿瘤风险调整后HR的4篇研究进行分析发现,虽然OSA患者的恶性肿瘤风险随着其严重程度的增加而增加,但差异均无统计学意义(P>0.05),如图4。

图4 不同程度OSA患者恶性肿瘤的风险Figure 4 The risk of malignant tumors in patients with different degrees of OSA
2.3 发表偏移 采用Begg秩相关检验检测Z值为0.00(P=1.000);Egger线性回归法检测,t值为-1.21(P=0.294),显示无明显发表偏倚。
2.4 敏感性分析 逐项剔除纳入研究的各项文献并计算剩余文献的合并值,观察OSA患者与非OSA患者恶性肿瘤风险的差异。结果显示2篇文献对研究结果存在较大影响。其中,Choi等[18]是6项研究中唯一使用倾向性得分匹配法(Propensity Score Matching,PSM)控制混杂因素的研究,而Jara等[7]的样本量及男性受试者比例与其他研究相比显著较大,这可能为2篇文献异质性产生的主要原因。但整体来说,研究结果基本稳定。见图5。

图5 敏感性分析结果Figure 5 Sensitivity analysis results
3 讨论
近年来,越来越多研究者关注阻塞性睡眠呼吸暂停与恶性肿瘤的相关性。但各项研究由于研究人员、研究方法的不同,尚未得出一致的结论。近十年来发表多篇的meta分析,也由于纳入排除标准及统计方法的不同,得出了不同的结论。其中,孙瑶等[9]在2019年发表的meta分析显示,OSA患者的恶性肿瘤发生率相较非OSA患者明显增高,该结论在亚洲人群和睡眠监测确诊患者中尤为显著。但其采用未控制混杂因素的OR值为效应量,无法确定OSA是否为恶性肿瘤发生的独立预后因素。而本研究纳入了最新发表的多篇大样本队列研究,并合并调整了性别、年龄、体重指数等常见混杂因素[21]后的HR值,发现OSA不仅与恶性肿瘤的发生有显著的相关性,更可能是独立的致癌因素。
OSA导致的呼吸通气不足、低氧环境是其促进恶性肿瘤发生的关键机制[22-23]。低氧环境可以刺激缺氧诱导因子(hypoxia-inducible factors,HIF)的生成[24],导致血管内皮生长因子增加[25],从而诱导异常血管的生成,为肿瘤提供生长所需的营养物质;缺氧细胞可通过再氧化逐步补充在低氧环境下过多消耗的ATP,而分子氧水平的增加则会导致活性氧(reactive oxygen species,ROS)的增加,从而进一步诱导细胞的氧化应激[26];此外,低氧环境还能通过促进肿瘤干细胞的(cancer stem cells,CSC)增生与分化[27]、免疫抑制[28]等作用促进肿瘤的发生。
本研究和Zhang等[10]的研究结果一致,未观察到不同程度OSA与恶性肿瘤风险的显著相关性。笔者发现,主要影响结果的几项阴性结果研究均采用了睡眠监测诊断,并根据AHI水平进行严重程度分级。我国2018版《成人阻塞性睡眠呼吸暂停基层诊疗指南》指出:OSA的程度分级应当充分考虑临床症状、合并症情况、AHI及夜间血氧饱和度(Saturation of Pulse Oxygen,SpO2)等实验室指标,其中以AHI作为主要判断标准,夜间最低SpO2作为参考[29]。然而,Kendzerska等[8]及Campos-Rodriguez等[13]的研究发现,夜间血氧饱和度低于 90%的百分比(percent of nighttime spent with oxygen saturation<90%,TSat90)相较OSA诊断的“金标准”AHI,与恶性肿瘤的发生有更密切的关系。采用AHI而不是TSat90作为划分标准可能是本研究未观察到上述显著相关性的主要原因,夜间睡眠低氧程度可能对OSA与恶性肿瘤的相关性有更大的影响。
同时,本研究尚存在一定局限性:①不同患者对持续正压通气(Continuous Positive Airway Pressure,CPAP)或其他OSA治疗手段的依从程度不同,这一定程度导致了不同研究的异质性。②本研究纳入文献的数量有限,无法根据不同类型的恶性肿瘤发生率进行有针对性的分析讨论。因此,本研究的适用范围仍有待更多大样本、多中心、试验设计完善的研究的支持和验证。
4 结论
OSA不仅与恶性肿瘤的发生有显著的相关性,更可能是独立的致癌因素,但结论的适用范围仍有待更多大样本研究的支持。
