利用多重PCR技术快速检测4种水稻病原细菌
2021-06-29莫瑾王哲周慧平朱宏建朱水芳廖晓兰
莫瑾 王哲 周慧平 朱宏建 朱水芳 廖晓兰

摘要 :对水稻中多种病原细菌的检测,使用常规方法往往耗时耗力,而多重PCR可以更加高效地进行多种细菌的检测。根据水稻细菌性谷枯病菌gyrB基因,水稻细菌性叶鞘褐腐病菌PfsI/R quorum sensing 位点以及水稻细菌性条斑病菌和水稻白叶枯病菌含铁细胞接受因子基因设计引物,建立4种水稻病菌的多重PCR检测方法,对方法进行特异性和灵敏度测试,并对采自不同地区的水稻样本進行检测。结果显示,多重PCR方法能同步地快速检测出水稻细菌性谷枯病菌、水稻细菌性叶鞘褐腐病菌、水稻细菌性条斑病菌或水稻白叶枯病菌,检测灵敏度达到103 cfu/mL的菌液浓度,利用该方法对我国不同地区的58份水稻种子进行检测,其中17个样本检测出水稻细菌性条斑病菌或水稻白叶枯病菌,未检测到水稻细菌性谷枯病菌和水稻细菌性叶鞘褐腐病菌。
关键词 :多重PCR; 水稻病原细菌; 检测
中图分类号:
S 435.111
文献标识码: A
DOI: 10.16688/j.zwbh.2020205
A multiplex PCR method for rapid detection of four rice pathogenic bacteria
MO Jin1,2, WANG Zhe2, ZHOU Huiping2, ZHU Hongjian1, ZHU Shuifang1, LIAO Xiaolan1*
(1. College of Plant Protection,Hunan Agricultural University, Changsha 410128, China;
2. Technology Center of Changsha Customs, Changsha 410004, China)
Abstract
Multiplex PCR is an efficient and simple method to detect a variety of pathogenic bacteria in rice at the same time. A multiplex PCR detection method was established for four rice pathogenic bacteria, and the primers were designed based on the gyrB gene of Burkholderia glumae,the PfsI/R quorum sensing locus of Pseudomonas fuscovaginae and the iron-containingcell-receiving factor genes of Xanthomonas oryzae pv. oryzae and X. oryzae pv. oryzicola. The specificity and sensitivity of the multiplex PCR method were validated, and rice samples from different regions were tested using this method. The results showed that the multiplex PCR method can fast and accurately detect four rice pathogenic bacteria. The detectability of this method reached 103 cfu/mL in the bacterial solution. Among 58 rice samples from different regions, neither B.glumae nor P.fuscovaginae was detected,while X.oryzae pv. oryzae or X.oryzae pv. oryzicola were positive in 17 samples.
Key words
multiplex PCR; rice pathogenic bacteria; detection
水稻细菌性谷枯病(病原菌:Burkholderia glumae)[12]、水稻细菌性叶鞘褐腐病(病原菌:Pseudomonas fuscovaginae)[34]、水稻白叶枯病(病原菌:Xanthomonas oryzae pv. oryzae)和水稻细菌性条斑病(病原菌:X.oryzae pv. oryzicola)[56]等水稻细菌性病害,对水稻危害严重,导致严重减产。其中水稻细菌性谷枯病、水稻细菌性条斑病和水稻白叶枯病属于我国进境检疫性病害,水稻细菌性叶鞘褐腐病是马来西亚等稻种进口国的进境检疫性病害。
目前有多种关于这4种病原菌检测技术的报道。Takeuchi等[1]建立了B.glumae的检测方法;罗金燕等[7]研究了B.glumae的生理生化特点、Biolog、RAPD-PCR和致病性测定等鉴定方法;Sayler等[8]和Fang等[9]建立了B.glumae的实时荧光PCR鉴定法;朱金国、莫瑾等制定了PCR、实时荧光PCR、生理生化鉴定等方法检测B.glumae、X. oryzae pv. oryzae和X.oryzae pv. oryzicola的国家标准[1011];刘雅婷等设计了X.oryzae pv. oryzae和X.oryzae pv. oryzicola的多重PCR检测体系并申请了专利[12];田茜等建立了X.oryzae pv. oryzae和X.oryzae pv. oryzicola的数字PCR检测方法[13]。徐福寿等采用生理生化鉴定、Biolog生化鉴定和脂肪酸鉴定等方法对P. fuscovaginae进行了鉴定研究[13]。传统生化方法往往费时且对菌种纯度、操作等要求比较高,荧光定量PCR、数字PCR对于检测设备条件要求高,成本高。且相关研究所使用的标准菌株及病理材料数量有限,有必要进行检测特异性及准确性方面的验证。
本研究采用国家标准中B.glumae、X. oryzae pv. oryzae和X.oryzae pv. oryzicola的特异性检测引物[1011],并根据水稻细菌性叶鞘褐腐病PfsI/R quorum sensing 位点设计引物,以期建立快速、灵敏且特异性高的多重PCR方法对水稻中B.glumae、P.fuscovaginae以及X.oryzae pv. oryzae或X.oryzae pv. oryzicola进行同步检测。
1 材料与方法
1.1 材料
病原菌:水稻细菌性谷枯病菌、水稻白叶枯病菌、水稻细菌性条斑病菌和水稻细菌性叶鞘褐腐病菌菌株,购自英国国家植物病原菌种保存中心(NCPPB);其他对照菌株分别来源于水稻种子中自然分离和购自美国国家菌种保藏中心(ATCC)、中国国家菌种保藏中心(CGMCC)和NCPPB。具体菌株来源及编号见表1。
试剂:PCR反应液MasterMix(2×),DNA Marker,为北京天根试剂公司产品。
仪器:PCR扩增仪(Applied Biosystems),凝胶成像仪(Bio-RAD)。
1.2 DNA提取
制备菌悬液:取营养琼脂平板上新鲜菌落(生长24~48 h)至PS液体培养基[10],振荡培养16 h±2 h(培养条件:28℃±1℃、180 r/min)后取1 mL菌液,8 000 r/min离心5 min,弃上清,用1.5 mL 0.01 mol/L pH 7.4的PBS缓冲液将沉淀重悬,重复离心、洗涤3次,用1 mL PBS重悬菌体,96℃灭活5 min,-20℃保存备用。多重PCR检测将振荡培养的菌液各取500 μL混合后,再按以上操作离心收集菌体。采用10倍稀释法进行菌液浓度测定。按照萨姆布鲁克等[15]的方法提取细菌DNA。
1.3 引物设计及合成
gryB基因因其分辨率高等特点,广泛应用于细菌近源种的鉴定[16],针对B.glumae的gryB基因(GenBank AB207074)设计特异性引物,BG-F3:5′-GCAGCGGCAAGGAAGACG-3′;BG-R3:5′-GTCGTCGCCCGACGTCTC-3′,PCR产物大小为317 bp。 参考Mattiuzzo等的研究[4],利用水稻细菌性叶鞘褐腐病菌保守的N-酰基高丝氨酸内酯(AHL)群体感应(QS)系统中PfsI/R系统的编码基因PfsI/R quorum sensing(GenBankFN598970.1)设计扩增水稻细菌性叶鞘褐腐病菌的上下游引物,PfsI/R-F: 5′-AGTGAATGGGAGTGCCAGGAC-3′;PfsI/R-R: 5′-TGTAGCGAAATAACCCGAGCC-3′,预期扩增片段大小为494 bp。比对GenBank 水稻白叶枯病菌和水稻细菌性条斑病菌的含铁细胞接受因子基因(putative siderophore receptor gene, GenBank AF3257323)的保守序列,设计引物F1:5′-GAATATCAGCATCGGCAACAG-3′;R1:5′-TACCGGAGCTGCGCGTT-3′,两种病菌预期扩增片段大小均为152 bp。引物由Invitrogen公司合成。
1.4 PCR扩增及产物测序
PCR扩增体系:2×PCR Mix 25 μL、10 μmol/L引物(工作浓度10 pmol/μL)F1、R1各1.0 μL,BG-F3、BG-R3各0.75 μL,PfsI/R-F、PfsI/R-R各05 μL,DNA模板(1~10 ng/μL)2 μL,用ddH2O补足至50 μL反应体系。反应程序:96℃ 5 min;96℃ 30 s,59℃ 30 s,72℃ 30 s,30个循环;最后72℃ 5 min。
电泳检测:PCR产物采用2%琼脂糖凝胶电泳,电泳电压为120 V,紫外凝胶成像仪进行电泳观察。由上海生工生物工程有限公司进行PCR产物测序。
1.5 特异性和灵敏度检测
单一目标菌多重PCR检测特异性试验:PCR扩增参试的单一菌株,对PCR产物进行电泳检测。
多目标菌多重PCR检测特异性试验:提取A1、B11、C7、F1按体积等比两两混合的菌液DNA,提取等比混合的A1、B11、F1,A8、C7、F2以及A1、B11、C7、F1等3组组合的菌液DNA,采用设计的3对引物同时扩增提取的DNA,电泳检测PCR产物。
多重PCR灵敏度检测试验:将浓度为106cfu/mL的A1、B11、F1以及A8、C7、F2目标菌菌液等比例混合,采用10倍稀释法将目标菌液制备至浓度均为106、105、104、103、102 cfu/mL和10 cfu/mL,提取DNA并进行PCR扩增,电泳检测PCR产物。
1.6 应用多重PCR技术检测水稻种子
对来自安徽、四川、湖南、海南和广西等地的58个水稻种子样品进行多重PCR检测。用灭菌蒸馏水冲洗水稻种子3次后,取10 g加入90 mL 0.001%吐温磷酸盐缓冲液(pH 7.0),将种子充分破碎后,立即取1.5 mL液体至离心管内,8 000 r/min离心5 min,弃上清,沉淀用灭菌蒸馏水重悬后重复离心3次,得到的沉淀进行DNA提取及多重PCR扩增,扩增条件见1.4,其中扩增体系中DNA模板(1~10 ng/μL)加入体积为5 μL。分别以A1、B11、C5和F1菌液浸泡经无菌水冲洗表面后的水稻种子,晾干后作为阳性带菌材料进行试验。
2 结果与分析
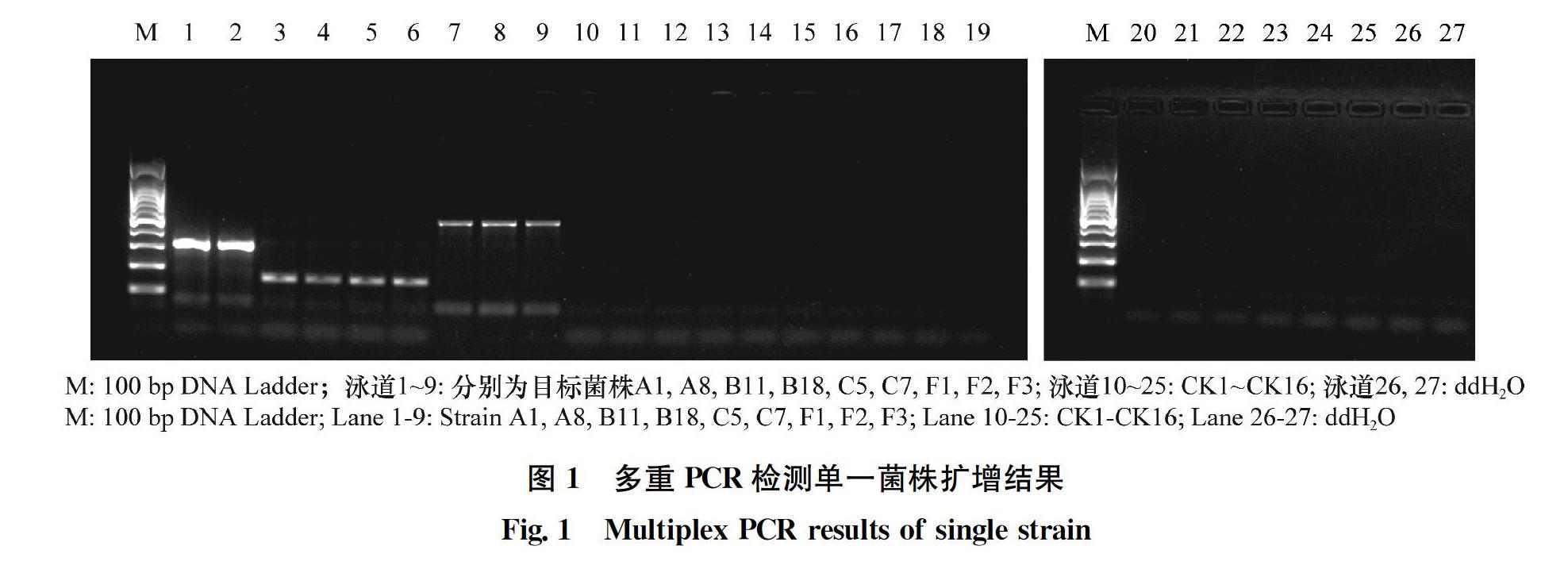
2.1 多重PCR单一目标菌特异性检测
对单个参试菌株提取的DNA,使用BG-F3和BG-R3、PfsI/R-F和PfsI/R-R、F1和R1 3对引物的混合反应体系进行PCR扩增,结果显示,多重PCR反应能同时特异性地扩增出B.glumae、P.fuscovaginae、X.oryzae pv. oryzae或X.oryzae pv. oryzicola,混合反应体系扩增B.glumae得到PCR产物片段为317 bp,扩增P.fuscovaginae得到PCR产物片段为494 bp,扩增X.oryzae pv. oryzae或X.oryzae pv. oryzicola得到PCR產物片段为152 bp,片段大小均与预期一致,同时对菌株CK1~CK16提取的DNA进行多重PCR扩增,均未扩增出目的条带(图1)。在GenBank中对扩增产物的测序结果进行比对分析,证明得到的PCR产物与设计的目标菌片段大小一致,其中PfsI/R-F和PfsI/R-R、BG-F3和BG-R3扩增的PCR产物与GenBank中的P.fuscovaginae、B. glumae序列同源性大于99%,F1和R1扩增的产物与X.oryzae pv. oryzae或X.oryzae pv. oryzicola序列同源性大于97%。
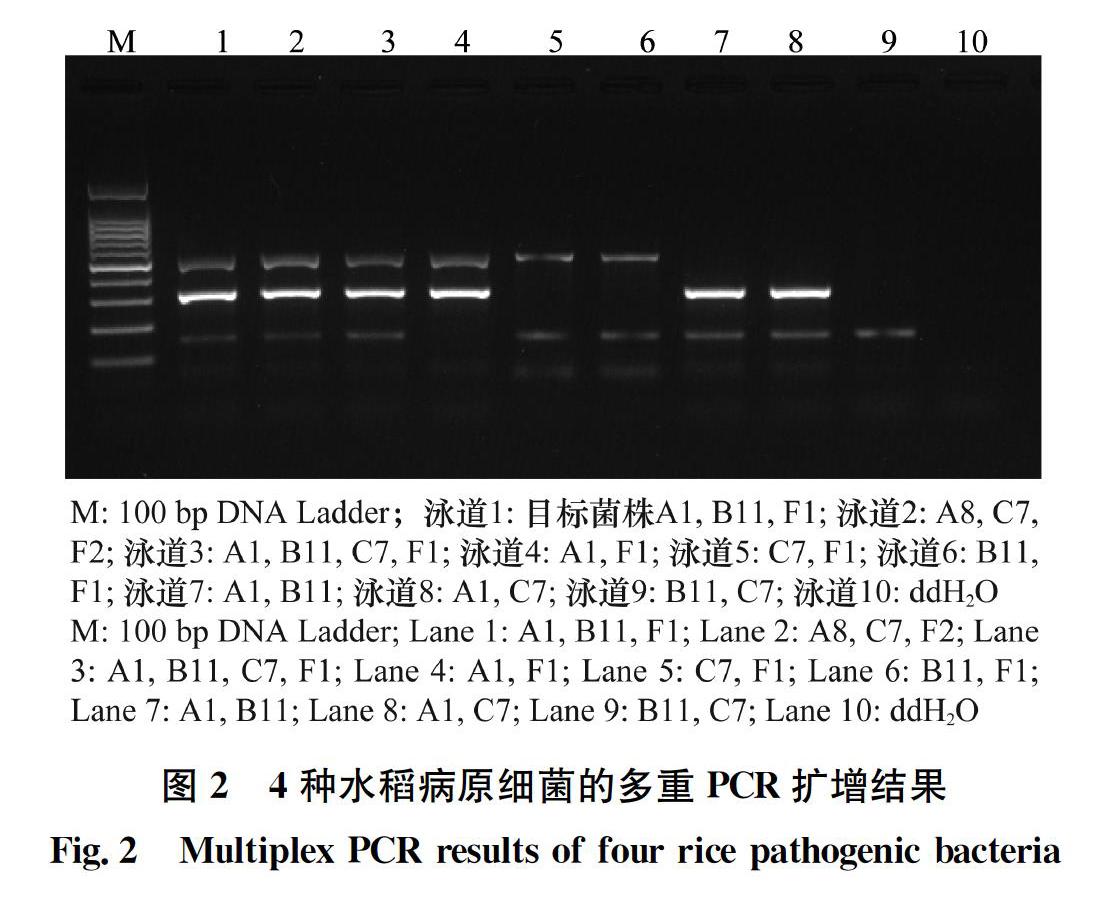
2.2 多重PCR多目标菌检测结果
结果显示,多重PCR反应体系同步扩增B.glumae、P.fuscovaginae以及X.oryzae pv. oryzae或X.oryzae pv. oryzicola,均能扩增出与目的片段大小一致的条带(图2),而采用多重PCR扩增其他参试菌株时,均未出现目标条带。说明同时应用3对引物进行目标菌的多重PCR检测,引物间无相互干扰,检测特异性强,可采用该方法对B.glumae、P.fuscovaginae以及X.oryzae pv. oryzae或X.oryzae pv. oryzicola进行检测。
2.3 多重PCR灵敏度检测
提取不同浓度的混合菌液的DNA后,采用多重PCR反应体系进行PCR灵敏度检测。结果显示,菌液浓度为103 cfu/mL时,能有效地检测出4种细菌(图3),检测灵敏度可达到103 cfu/mL菌液浓度。
2.4 多重PCR技术在水稻种子检测中的应用
对采自不同地区的58份水稻种子样本进行多重PCR检测,其中阳性对照检测结果正常,安徽的8个种子样品、四川的12个种子样品、湖南稻区的20个种子样品、广西的10个种子样品和海南的8个种子样品均未检测出水稻细菌性谷枯病菌或水稻细菌性叶鞘褐腐病菌,有17个样本检测出水稻白叶枯病菌或水稻细菌性条斑病菌。
3 讨论
水稻细菌性谷枯病、水稻细菌性叶鞘褐腐病以及水稻白叶枯病和水稻细菌性条斑病,4种病害均可通过种子传播,宿主广泛,具有较强的侵染性,导致水稻减产严重,其中水稻细菌性谷枯病、水稻细菌性叶鞘褐腐病在我国尚无大面积病害发生的报道。同时,进口国对于我国出口的杂交稻种不断提出新的检疫要求,影响我国稻种的顺利出口。因此,无论是在水稻种植的各个环节还是在稻种的调运过程中,及时开展水稻病害的快速检测,为防止病害的大面积传播、跨境传播、有害生物的入境以及稻种的顺利出口都提供了必要的技术保障。再者,为方便进出口贸易,降低仓储成本和保障商品品质,目前海关等部门大力推行“快检快放”“快速通关”等一系列政策,提高通关效率,由此对检疫速度提出了更高的要求,也是目前口岸检疫部门的迫切需求。
目前,国内外关于几种病害的检测技术主要以常规生理生化检测和分子检测为主。其中传统的生理生化检测方法操作复杂,耗时长,部分植物病原菌受其生长时间长的影响,其生理生化特征不稳定,因此,传统生化检测不能完全适用于快速检测鉴定。相对于单一检测某种目标菌的PCR检测方法,多重PCR检测能在一次反应中同时检测多种目标菌,李云飞等利用多重PCR诊断水稻白叶枯病和细菌性条斑病的复合发生[5],Maeda等建立了多重PCR检测B.plantarii、B.glumae 和 B.gladioli的方法[17],相关方法的建立极大地缩短了检测时间,实现了对目标细菌的快速鉴别。多重PCR检测技术的建立在及时预防病害的传播、防止外来有害生物的入侵、提高通关效率、保障我国杂交稻种的顺利出口等各方面提供了快速有效的解决方法。
本研究建立的三重PCR于同一反应体系中同步检测B.glumae、P.fuscovaginae以及X.oryzae pv. oryzae或X.oryzae pv. oryzicola 4种水稻病菌,3对检测引物相互间无干扰,在反应条件一致的情况下,能够特异性地同步扩增出各菌株目标基因,达到对目标菌快速、低成本检测鉴定的目的。其中X.oryzae pv. oryzae和X. oryzae pv. oryzicola同为稻黄单胞菌属,均属于我国进境植物检疫性有害生物,本多重PCR方法中用1对引物同时检测2种有害病原菌,减少了多重PCR中引物的相互干扰,对于快速筛选健康植物材料和保障“快速验放”提供了技术支持。通过对我国不同地区的水稻种子的检测结果表明,B.glumae和P.fuscovaginae在国内未发现有携带发生。因此,加强对入境物种携带B.glumae和P.fuscovaginae的控制和检疫,严防输入是有效防止相关病害在我国发生和传播的关键。
参考文献
[1] TAKEUCHI T, SAWADA H, SUZUKI F, et al. Specific detection of Burkholderia plantarii and B.glumae by PCR using primers selected from the 16S-23S rDNA spacer regions[J]. Japanese Journal of Phytopathology, 1997, 63(6): 455462.
[2] 罗金燕, 徐福寿, 王平, 等. 水稻细菌性谷枯病病原菌的分离鉴定[J]. 中国水稻科学, 2008, 22(1): 8286.
[3] 谢关林. 水稻细菌性叶鞘褐腐病研究[J]. 植物保护学报, 2001,28(2): 97102.
[4] MATTIUZZO M, BERTANI I, FERLUGA S, et al. The plant pathogen Pseudomonas fuscovaginae contains two conserved quorum sensing systems involved in virulence and negatively regulated by RsaL and the novel regulator RsaM [J]. Environmental Microbiology, 2011, 13(1): 145162.
[5] 李云飛, 陈雪娇, 杨雪, 等. 利用多重PCR诊断水稻白叶枯病和细菌性条斑病的复合发生[J]. 植物检疫, 2016, 30(1): 4852.
[6] 岳凯, 高雪, 曹红云, 等. 水稻细菌性条斑病菌和白叶枯病菌的多重PCR检测体系开发[J]. 云南农业大学学报(自然科学), 2016, 31(5): 773778.
[7] 谢关林, 罗金燕, 李斌. 水稻危险性病害—细菌性谷枯病及其病原鉴别[J]. 植物保护, 2003, 29(5): 4749.
[8] SAYLER R J, CARTWRIGHT R D, YANG Yinong. Genetic characterization and real-time PCR detection of Burkholderia glumae, a newly emerging bacterial pathogen of rice in the United States [J]. Plant Disease, 2006, 90(5): 603610.
[9] FANG Yuan, XU Lihui, TIAN Wenxiao, et al. Real-time fluorescence PCR method for detection of Burkholderia glumae from rice [J]. Rice Science, 2009, 16(2): 157160.
[10]中華人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 水稻细菌性谷枯病菌检疫鉴定方法:GB/T 29396-2012[S].北京:中国标准出版社,2012.
[11]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 水稻白叶枯病菌、水稻细菌性条斑病菌检疫鉴定方法:GB/T 28078-2011[S]. 北京:中国标准出版社,2011.
[12]刘雅婷, 岳凯, 李小林, 等. 水稻上两种种传病害的多重PCR检测试剂盒及其专用引物和多重PCR检测方法: CN201510292152. 8 [P]. 20150602.
[13]田茜, 李云飞, 王明生, 等. 水稻细菌性条斑病菌和白叶枯病菌数字PCR检测方法的建立[J]. 植物检疫, 2018, 32(6): 2531.
[14]徐福寿, 沈筱玉, 谢关林, 等. 小麦细菌性叶鞘褐腐病及其病原鉴定[J]. 植物保护学报, 2007,34(1): 2731.
[15]萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M] 黄培堂译.第3版. 北京: 科学出版社, 2002: 270300.
[16]安然, 易图永, 肖启明, 等. gyrB基因在细菌分类和检测中的应用[J].江西农业学报,2010,22(4):1820.
[17]MAEDA Y, SHINOHARA H, KIBA A, et al. Phylogenetic study and multiplex PCR—based detection of Burkholderia plantarii, Burkholderia glumae and Burkholderia gladioli using gyrB and rpoD sequences [J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(5): 10311038.
(责任编辑:田 喆)
