黏虫MagR和Cry2基因的时空表达分析
2021-06-29谢殿杰张蕾程云霞江幸福
谢殿杰 张蕾 程云霞 江幸福


摘要 :为了明确黏虫MagR、Cry2基因在定向行为中的作用,本研究采用基因序列分析及实时荧光定量技术,研究了黏虫MagR、Cry2基因的基因序列特征及其表达模式。结果表明,黏虫MagR基因编码131个氨基酸,蛋白分子量为14.17 kD,等电点为9.3,具有多个铁硫簇结合位点;黏虫Cry2基因编码757个氨基酸,蛋白分子量为87.04 kD,等电点为8.73。羽化后不同日龄迁飞型黏虫成虫各部位Cry2基因表达量存在显著差异。羽化后3 d成虫头部和胸部Cry2基因表达量显著高于其他日龄。迁飞型黏虫成虫羽化后不同日龄各部位MagR的表达量具有显著性差异;5 d时各部位的表达量达到最高,各日龄头部和胸部的表达量均显著高于腹部。
关键词 :黏虫; 时空表达; 定向; Cry2; MagR
中图分类号:
S 433
文献标识码: A
DOI: 10.16688/j.zwbh.2020035
Temporal and spatial expression of MagR and Cry2 genes in Mythimna separata
XIE Dianjie, ZHANG Lei, CHENG Yunxia, JIANG Xingfu*
(State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
In order to clarify the role of MagR and Cry2 genes in the orientation behavior of Mythimna separata, the gene sequence analysis and qRT-PCR were performed to study the gene sequence characteristics and expression patterns of MagR and Cry2 genes. The results showed that MagR gene encoded 131 amino acids, with a molecular weight of 14.17 kD, an isoelectric point of 9.3 and many iron sulfur cluster binding sites. The Cry2 gene encoded 757 amino acids, with a molecular weight of 87.04 kD and an isoelectric point of 8.73. After eclosion, there were significant differences of Cry2 gene expression in different parts of M.separata at different day-ages. The Cry2 gene expression in the head and thorax of 3-day-old adults was significantly higher than that in the adults of other day-ages. Meanwhile, after eclosion, there were also significant differences of MagR expression in different parts of M.separata at different day-ages. At 5-day-age, the expression level of each part reached the highest, and the expression levels in the head and thorax at each age were significantly higher than those in the abdomen.
Key words
Mythimna separata; temporal and spatial expression; orientation; Cry2; MagR
黏蟲Mythimna separata属鳞翅目,夜蛾科,为典型的远距离季节性迁飞害虫。黏虫迁飞距离最远可达1 400 km[1],主要在亚洲、大洋洲发生为害。在我国,除新疆外,其他地区均发现黏虫为害[2]。黏虫寄主种类多,为害范围广,对我国水稻、小麦和玉米三大主粮作物造成严重危害,同时也会对其他禾本科作物、牧草、经济作物和油料作物造成不同程度的损失。在我国,黏虫每年有多次大范围的往返迁飞为害活动,迁飞是其造成危害的主要方式。
“起飞、运转、降落”为昆虫迁飞的三个过程[3]。昆虫起飞后可以借助内部和外部的各种信号主动调整自身姿态及空间位置从而准确到达目的地的现象称为昆虫的定向[4]。目前,对昆虫定向行为有较多研究的主要有蜜蜂、蚂蚁、果蝇等近距离飞行昆虫,以及蝴蝶、蛾类、蝗虫等远距离迁飞昆虫。昆虫迁飞的定向机制包括时间补偿太阳罗盘、地面标志物、侧风漂移补偿、地磁场等研究[57]。黏虫起飞后对方向确定的机制已有一些研究。利用直筒风洞进行的黏虫自由飞行试验表明,黏虫成虫有迎风起飞和迎风飞行的现象。黏虫可逆风飞行的最大风速为7.2 m/s,风速小于等于4 m/s时,其飞行时头部迎风或与风向成一定的夹角,有侧风漂移补偿现象[6]。高空雷达观测发现,黏虫迁飞过程中有明显的聚集成层现象,即虫群在较大水平范围及较小的垂直范围内聚集,虫群密度高且有明显的上下分层,并有秋季回迁定向行为[6]。其头部总是朝向西南方向,迁飞方向与风向及风速有关,迁飞速度是飞行速度与风速的矢量和[5]。迁飞黏虫具有明显的飞行低温阈值,温度低于16℃时,空中虫群密度低、不聚集成层。温度较低的春季,空中虫群会主动选择高温层,虫群有侧风补偿或逆风飞行现象[6]。黏虫定向行为的分子机制还未见报道。
Cry蛋白是一种蓝光光敏蛋白,主要功能是调节植物的生长发育,在动物中起到生物钟的作用。动物隐花色素一般有Cry1和Cry2两种[89]。Cry1通常作为生物钟的光受体[1011],Cry2通常为非光依赖的转录抑制子[12]。果蝇只含有Cry1,而有些物种同时拥有Cry1和Cry2,如人类的hCry1和hCry2,帝王蝶Danaus plexippus中的DpCry1和DpCry2。Cry蛋白作为磁光信号感受器,其结构中由3个保守的色氨酸(Trp)形成的三联体与黄素腺嘌呤二核苷酸(FAD)之间的自由基对是Cry蛋白光依赖磁感应功能的关键结构。人体的各种组织中,均有Cry表达,而视网膜中表达量最高,其中hCry2表达量比hCry1高11倍[1314]。果蝇可以感应磁场,敲除其dCry基因后,果蝇便失去了磁定向的能力。将人类的Cry2基因导入后,这些果蝇又恢复了磁定向的能力[15]。
北京大学生命科学学院的谢灿课题组首次报道了一个全新的磁受体蛋白(magnetic receptor),并简化命名为MagR[16]。该团队从果蝇的编码基因入手,进行分析筛选、试验验证,最终锁定了铁硫簇蛋白IscA1(MagR)。该蛋白广泛存在于生物体内。张生家研究组发现,在外磁场刺激下,IscA1能够通过活化MagR调控相关磁基因表达,进而产生磁定向行为[17]。MagR磁受体的研究,为从分子水平上揭示生物磁感受机理提供了新的突破口,为基于“自由基对”理论的Cry/MagR磁蛋白复合体研究提供了新的切入点。关于鸟类光依赖磁颗粒定向[18],果蝇的Cry/MagR磁感应蛋白复合物定向[1617],帝王蝶的时间补偿太阳罗盘定向[19]等都已经有了较深入的研究,并获得了重大突破。但是,这些都是日间飞行定向生物,而黏虫为鳞翅目夜蛾科昆虫,昼伏夜出,其迁飞、求偶、交配及羽化等行为主要发生在傍晚至黎明期间。因此有必要对黏虫定向行为进行深入研究,理清其定向行为的分子机制。本研究通过qRT-PCR技术研究了定向相关基因Cry2和MagR的时空表达,为黏虫定向行为的分子机制研究提供理论依据。
1 材料与方法
1.1 材料
供试虫源来自田间采集在实验室内连续多代繁殖的黏虫成虫。饲养条件:相对湿度(70±10)%、温度(24±1)℃、光周期L∥D=14 h∥10 h。初孵幼虫以10头/瓶(750 mL,高14 cm,直径8 cm)的密度进行饲养,该密度条件下饲养的黏虫为迁飞型[2021]。幼虫采用新鲜玉米叶饲养,每日更換;幼虫停止取食后,在玻璃瓶中加入含水量为10%~15%的土粒供其化蛹;成虫羽化后,将成虫放入直径8 cm,高20 cm的塑料罩中饲养,并喂食5%蜂蜜水,每日更换。
主要试剂:RNA提取试剂TRIzol、琼脂糖购自美国Invitrogen公司;Fast Quant RT Kit(with gDNase) 反转录试剂盒、SuperReal PreMix Plus(SYBR Green) 实时荧光定量试剂盒购自天根生化科技(北京)有限公司;2×Taq Master Mix(Dye Plus)购自北京全式金生物技术有限公司;其他试剂均为国产分析纯。
主要仪器:Nano Drop 2000紫外微量分光光度计,美国Thermo Fisher Scientific公司;组织振荡研磨仪,天根生化科技(北京)有限公司;Bio-Rad PCR仪、凝胶成像仪、荧光定量CFX Connect Real-Time System,美国Bio-Rad公司;DYY-6C型电泳仪,北京六一仪器厂。
1.2 方法
1.2.1 黏虫Cry2、MagR基因的序列分析及进化树构建
通过ORF Finder(http:∥www.ncbi.nlm.nih.gov/projects/gorf/)查找出黏虫Cry2、MagR基因完整的开放阅读框序列,并推导出相应的氨基酸序列;运用NCBI Blastx检测氨基酸序列的相似序列,并通过ExPASy的Computer pI/Mw工具(http:∥expasy.org/tools/pi_tool.html)推测出蛋白质的分子量和理论等电点,使用在线软件SignalP4.1 Server(www.cbs.dtu.dk/services/signalp/)进行蛋白的信号肽预测;利用Motifscan软件预测氨基酸序列结构域,从而了解Cry2、MagR蛋白的功能;运用DNAMAN软件进行序列比对,分析结果;通过Match Code进行DNA和蛋白质的比对。
构建系统进化树:首先从GenBank中获取多个物种的Cry2、MagR的蛋白序列,然后通过ClustalW软件对相应蛋白进行多重比较,最后通过MEGA6软件以邻接法(neighbor-joining,NJ)构建系统进化树。
1.2.2 引物设计与合成
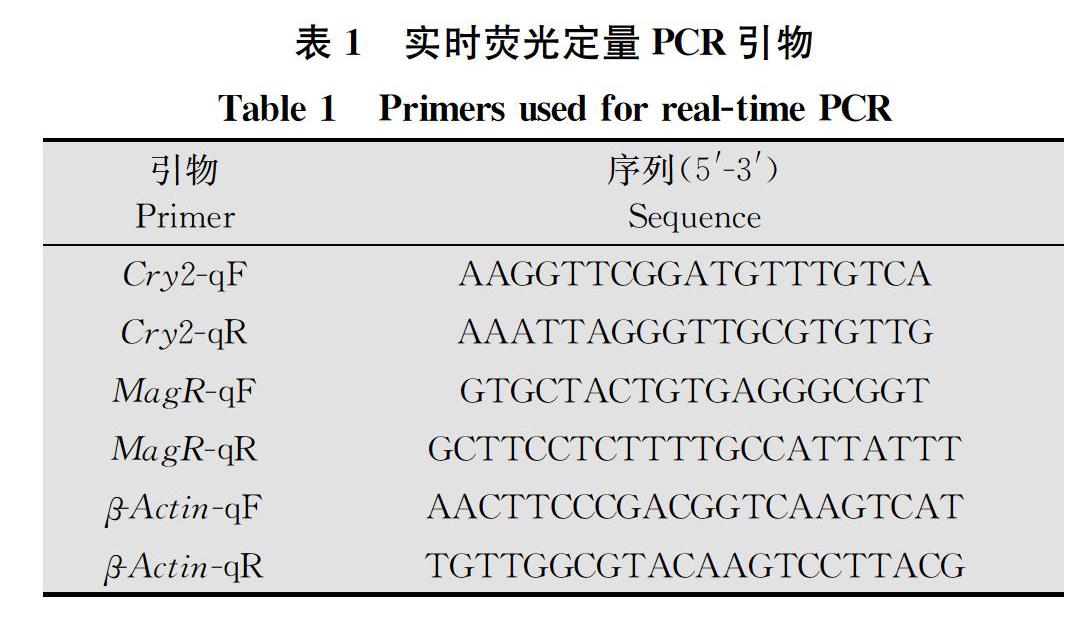
从黏虫基因组数据库及NCBI GenBank数据库搜索黏虫及已知昆虫的Cry2、MagR基因序列,通过DNAMAN软件对其基因序列进行比对,随后根据荧光定量引物设计原则在基因保守区域用Primer Premier 5软件设计Cry2、MagR基因的引物,以β-actin基因(登录号GQ856238.1)作为内参基因(表1)。本试验所用引物均由生工生物工程(上海)股份有限公司合成,用RNAase-free ddH2O稀释到所需浓度,并于-20℃保存备用。
1.2.3 黏虫Cry2、MagR基因的表达模式分析
以不同日龄(1、3、5、7 d)成虫头部、胸部、腹部相同浓度RNA反转录得来的cDNA为模板,利用实时荧光定量PCR技术检测Cry2、MagR基因的表达水平,每处理设4个生物学重复及3个技术重复。反应体系(20 μL):2×SuperReal PreMix Plus 10 μL、RNAase-free ddH2O 6 μL、10 μmol/L正、反向引物各0.8 μL、cDNA 2 μL、50×ROX Reference Dye 0.4 μL。MagR反应程序为:95℃预变性15 min;95℃ 变性10 s,55℃退火 30 s,72℃ 32 s(延伸并采集荧光信号),40个循环;Cry2反应程序:95℃预变性15 min;95℃变性10 s,54℃退火30 s,72℃ 32 s(延伸并采集荧光信号),40个循环。
1.3 数据处理与分析
用SAS 5.0软件对试验数据进行统计分析。首先对所得数据进行正态性及方差齐性检验,将不符合的数据进行ln(x+1)的对数转化。通过2-ΔΔCt法对黏虫Cry2、MagR基因的Ct值进行处理分析。试验中所有数据均进行单因素方差分析(ANOVA),并使用Tukeys HSD法对相对表达量进行多重比较。试验中的参数均用平均值±标准误来表示,差异显著性水平为α=0.05。
2 结果与分析
2.1 黏虫Cry2、MagR的序列分析与系统进化树
2.1.1 Cry2的序列分析与进化树构建
黏虫Cry2基因编码757个氨基酸,分子量为8704 kD,等电点为8.73,带负电荷残基总数(Asp+Glu)81个;带正电荷残基总数(Arg+Lys)90个,分子式为C3892H6002N1088O1128S30,亲水性为-0584,为疏水蛋白。其中有30个丝氨酸(Ser),19个苏氨酸(Thr),9个酪氨酸(Tyr)可能被磷酸化。其预测二级结构α-螺旋比例为31.97%,延展片段18.36%,无规则卷曲42.27%。信号肽分析表明该氨基酸序列无信号肽结构,跨膜结构分析表明无跨膜结构,黏虫Cry2蛋白不是跨膜蛋白和分泌蛋白。
对Cry2基因序列及氨基酸序列的分析表明,该氨基酸序列有多个保守区域,分别为213—224、421—428、530—546、555—560位點(图1)。
进化树分析显示,黏虫的Cry2蛋白与黄地老虎Agrotis segetum的亲缘关系最近,与棉铃虫Helicoverpa armigera、斜纹夜蛾Spodoptera litura的亲缘关系较近,与家蚕Bombyx mori、二化螟Chilo suppressalis的亲缘关系较远,而与冈比亚按蚊Anopheles gambiae、白纹伊蚊Aedes albopictus、美洲大蠊Periplaneta americana、大猿叶甲Colaphellus bowringi、红火蚁Solenopsis invicta、短管赤眼蜂Trichogramma pretiosum的亲缘关系最远(图2)。
2.1.2 MagR序列分析与进化树构建
黏虫MagR基因编码131个氨基酸,分子量为14.17 kD,等电点为9.3,带负电荷残基总数(Asp+Glu):
15个;带正电荷残基总数(Arg+Lys):21个,分子式为C625H1041N171O189S6,亲水性为-0.109,为疏水蛋白。其中有3个丝氨酸(Ser),5个苏氨酸(Thr),2个酪氨酸(Tyr)可能被磷酸化。其预测二级结构α-螺旋比例为42.75%,延展片段25.19%,无规则卷曲25.95%。信号肽分析表明该氨基酸序列无信号肽结构,跨膜结构分析表明无跨膜结构,黏虫MagR蛋白不是跨膜蛋白和分泌蛋白。
从黏虫基因组数据库获得MagR基因序列及氨基酸序列,分析结果表明,该氨基酸序列有SMART G5 结构域和Ribosomal-S13-N结构域,为线粒体内膜蛋白(图3)。
序列比对显示MagR蛋白具有多个铁硫簇结合位点(图4中红色方框),而铁硫簇是形成磁感应复合体magnetoreceptor的关键物质。进化树分析显示,黏虫的MagR基因与小地老虎Agrotis ipsilon的亲缘关系最近,与棉铃虫、斜纹夜蛾、草地贪夜蛾Spodoptera frugiperda的亲缘关系较近,与柑橘凤蝶Papilio xuthus、金凤蝶Papilio machaon亲缘关系较远,而与人虱Pediculus humanus corporis、萤火虫Photinus pyralis、铜绿蝇Lucilia cuprina的亲缘关系最远(图5)。
2.2 黏虫Cry2、MagR基因的表达模式分析
2.2.1 黏虫Cry2基因的表达模式分析
Cry2基因在黏虫头、胸、腹各部位中均有表达,且羽化后不同日龄成虫同一部位的Cry2基因表达量存在显著差异(头:F3,8=562.25,P<0.000 1;胸:F3,8=471.55,P<0.000 1;腹:F3,8=41.83,P<0000 1)。羽化后3 d成虫头部和胸部Cry2基因表达量显著高于其他日龄。羽化后1 d各部位Cry2基因的表达量最低;之后Cry2基因在头部和胸部的表达量快速增长,在腹部的表达量缓慢增长(图6)。相同日龄,不同部位间Cry2的表达量差异显著(1日龄:F2,6=48.36,P<0.000 2;3日龄:F2,6=1 687.84,P<0.000 1;5日龄:F2,6=240.08,P<0.000 1;7日龄:F2,6=1 009.05,P<0.000 1)。
2.2.2 黏虫MagR基因的表达模式分析
黏虫成虫羽化后同一部位在不同日龄时MagR的表达量具有显著差异(头:F3,8=388.21,P<0.000 1;胸:F3,8=225.22,P<0.000 1;腹:F3,8=209.85,P<0.000 1);羽化后1 d各部位表达量均最低,之后随着日龄的增长MagR的表达量显著升高,羽化后5 d时各部位的表达量达到最高,各日龄头部和胸部的表达量均显著高于腹部;(1日龄:F2,6=110.68,P<0000 1;3日龄:F2,6=837.12,P<0.000 1;5日龄:F2,6=210.24,P<0.000 1;7日龄:F2,6=146.79,P<0.001)(图7)。
3 讨论
对黏虫Cry2和MagR的信号肽分析和跨膜结构分析结果表明,这两个氨基酸序列无信号肽结构,无跨膜结构,不是跨膜蛋白和分泌蛋白。黏虫的MagR有典型的SMART G5 结构域和Ribosomal-S13-N结构域,为线粒体内膜蛋白。同时,MagR蛋白具有多个铁硫簇结合位点,铁硫簇蛋白具有多种功能,特别是具有较强的磁特性,并可在电子转移中起作用[2327]。铁硫簇也是形成磁感应复合体的关键物质[28],因此,在黏虫体内MagR可能与磁感应有关。
羽化后2~3 d為黏虫迁飞起飞时间[29],试验结果表明迁飞型黏虫头部及胸部Cry2基因的表达量在羽化后2~3 d显著升高。羽化后不同时间黏虫头部、胸部、腹部的Cry2基因表达量存在显著差异。1日龄黏虫成虫各部位Cry2基因的表达量较低,3日龄时头部和胸部的Cry2基因表达量达到最高,且显著高于其他日龄。鸽子定向相关的隐花色素基因(Cry)高表达于头部[16],部位上与黏虫具有一定的一致性。褐飞虱 Nilaparvata lugens长翅型成虫于羽化后24 h开始起飞,在羽化后36 h出现起飞高峰[3]。而在褐飞虱体内Cry2基因高表达于羽化后1 d的成虫头部,与迁飞高峰期一致,黏虫Cry2基因的表达模式与褐飞虱具有一定的一致性。此结果暗示Cry2基因可能与黏虫的迁飞行为有关。
羽化后不同日龄迁飞型黏虫头部、胸部、腹部的MagR基因表达量存在显著差异。其中头部和胸部的MagR基因表达量显著高于腹部。羽化后1日龄各部位MagR基因的表达量较低。褐飞虱体内MagR基因高表达于羽化后第3天的腹部[30],与黏虫有所不同。但是地磁场可以穿过生物体所有组织,理论上磁感受器可以存在于机体的任何地方[22]。因此,MagR基因作为磁感应基因在黏虫与褐飞虱体内高表达部位不同是可以理解的。而对褐飞虱体内磁性物质的检测发现磁性颗粒主要集中在腹部[3132],与黏虫检测结果不同,可能是磁性物质的检测主要对铁离子的检测,而褐飞虱的腹部组织及体液可能包含大量的铁离子,而这些铁离子的功能并不明确,还需进一步对这些铁颗粒的功能进行验证。
有研究认为隐花色素和磁感应蛋白仅在动物的眼部和脑部表达[3334]。然而,我们的研究表明Cry2与MagR基因共同高表达于黏虫头部和胸部,而腹部表达量较低,可能是由于Cry2与MagR除了磁感应外还有其他的功能。Cry2与MagR基因在表达时间上也具有一定的一致性,在黏虫迁飞起飞时其表达量急剧增加,我们推断成虫期Cry2与MagR基因表达量的增长对于感应磁场变化是必须的。Cry2与MagR的表达量在时空上的一致性说明Cry2与MagR可能在功能上具有一定的联系,可能形成类似于果蝇中由隐花色素和磁受体构成的棒状磁感应复合体[16],Cry2与MagR在黏虫体内的具体功能还需进一步的试验验证。
参考文献
[1] 李光博, 王恒祥, 胡文绣. 粘虫季节性迁飞为害假说及标记回收试验[J]. 植物保护学报, 1964, 3(2): 101110.
[2] 江幸福, 张蕾, 程云霞, 等. 我国粘虫发生危害新特点及趋势分析[J]. 应用昆虫学报, 2014, 51(6): 14441449.
[3] 陈若篪, 程遐年. 褐飞虱起飞行为与自身生物学节律、环境因素同步关系的初步研究[J]. 南京农业大学学报, 1980(2): 4249.
[4] JANDER R. Insect orientation[J]. Annual Review of Entomology, 1963, 8(1): 95114.
[5] 尹姣, 封洪强, 程登发, 等. 粘虫成虫在气流场中飞行行为的观察研究[J]. 昆虫学报, 2003, 46(6): 732738.
[6] 翟保平, 张孝羲. 迁飞过程中昆虫的行为: 对风温场的适应与选择[J]. 生态学报, 1993(4): 356363.
[7] 高月波, 胡高, 翟保平. 磁场变化对粘虫飞行定向行为的影响[J]. 应用昆虫学报, 2014, 51(4): 899905.
[8] LIU Bin, LIU Hongtao, ZHONG Dongping, et al. Searching for a photocycle of the cryptochrome photoreceptors [J]. Current Opinion in Plant Biology, 2010, 13(5): 578586.
[9] ZHU Haisun, YUAN Quan, FROY O, et al. The two CRYs of the butterfly [J]. Current Biology, 2005, 15(23): R953R954.
[10]ZHANG Luoyang, LEAR B C, SELUZICKI A, et al. The cryptochrome photoreceptor gates PDF neuropeptide signaling to set circadian network hierarchy in Drosophila [J]. Current Biology, 2009, 19(23): 20502055.
[11]XING Weiman, BUSINO L, HINDS T R, et al. SCF FBXL3 ubiquitin ligase targets cryptochromes at their cofactor pocket [J]. Nature, 2013, 496(7443): 6468.
[12]YUAN Quan, METTERVILLE D, BRISCOE A D, et al. Insect cryptochromes: gene duplication and loss define diverse ways to construct insect circadian clocks [J]. Molecular Biology and Evolution, 2007, 24(4): 948955.
[13]MIYAMOTO Y, SANCAR A. Vitamin B2-based blue-light photoreceptors in the retinohypothalamic tract as the photoactive pigments for setting the circadian clock in mammals [J]. Proceedings of the National Academy of Sciences, 1998, 95(11): 60976102.
[14]THOMPSON C L, RICKMAN C B, SHAW S J, et al. Expression of the blue-light receptor cryptochrome in the human retina [J]. Investigative Ophthalmology & Visual Science, 2003, 44(10): 45154521.
[15]FOLEY L E, GEGEAR R J, REPPERT S M. Human cryptochrome exhibits light-dependent magnetosensitivity [J/OL]. Nature Communications, 2011, 2(1): 356. DOI: 10.1038/ncomms1364.
[16]QIN Siying, YIN Hang, YANG Celi, et al. A magnetic protein biocompass [J]. Nature Materials, 2016, 15(2): 217226.
[17]LONG Xiaoyang, YE Jing, ZHAO Di, et al. Magnetogenetics: Remote non-invasive magnetic activation of neuronal activity with a magnetoreceptor [J]. Science Bulletin, 2015, 60(24): 21072119.
[18]FALKENBERG G, FLEISSER G, SCHUCHARDT K, et al. Avian magnetoreception: elaborate iron mineral containing dendrites in the upper beak seem to be a common feature of birds [J/OL]. PLoS ONE, 2010, 5(2): e9231. DOI: 10.1371/journal.pone.0009231.
[19]NESBIT R L, HILL J K, WOIWOD I P, et al. Seasonally adaptive migratory headings mediated by a sun compass in the painted lady butterfly, Vanessa cardui [J]. Animal Behaviour, 2009, 78(5): 11191125.
[20]罗礼智, 李光博, 胡毅. 粘虫飞行与产卵的关系[J]. 昆虫学报, 1995, 38(3): 284289.
[21]张蕾. 粘虫迁飞型转为居留型的关键时期和调控基础[D]. 北京:中国农业科学院, 2006.
[22]杜现礼. 鸽子隐花色素磁敏感机理研究[D]. 北京:国防科学技术大学, 2014.
[23]BEINERT H, HOLM R H, MUNCK E. Iron-sulfur clusters: natures modular, multipurpose structures [J]. Science, 1997, 277(5326): 653659.
[24]FLEISSNER G, STAHL B, THALAN P, et al. A novel concept of Fe-mineral-based magnetoreception: histological and physicochemical data from the upper beak of homing pigeons [J]. Naturwissenschaften, 2007, 94(8): 631642.
[25]WINKLHOFER M, KIRSCHVINK J L. Does avian magnetoreception rely on both magnetite and maghemite? [EB/OL]. (20080815) [20200114]. https:∥arxiv.org/abs/0805.2249v1.
[26]TREIBER C D, SALZER M C, RIEGLER J, et al. Clusters of iron-rich cells in the upper beak of pigeons are macrophages not magnetosensitive neurons [J]. Nature, 2012, 484(7394): 367370.
[27]KISHKINEV D. Sensory mechanisms of long-distance navigation in birds: a recent advance in the context of previous studies [J]. Journal of Ornithology, 2015, 156(1): 145161.
[28]JOHNSEN S, LOHMANN K J. The physics and neurobiology of magnetoreception [J]. Nature Reviews Neuroscience, 2005, 6(9): 703712.
[29]張志涛, 李光博. 粘虫飞翔生物学特性初步研究[J]. 植物保护学报, 1985, 12(2): 93100.
[30]XU Jingjing, ZHANG Yingchao, WU Jianqi, et al. Molecular characterization, spatial-temporal expression and magnetic response patterns of iron-sulfur cluster assembly1 (IscA1) in the rice planthopper, Nilaparvata lugens [J]. Insect Science, 2019, 26(3): 413423.
[31]解春兰, 李志毅, 隋贺, 等. 褐飞虱成虫体内磁性物质检测[J]. 昆虫学报, 2011, 54(10): 11891193.
[32]PAN Weidong, WAN Guijun, XU Jinging, et al. Evidence for the presence of biogenic magnetic particles in the nocturnal migratory brown planthopper, Nilaparvata lugens [J/OL]. Scientific Reports, 2016, 6(1): 18771. DOI: 10.1038/srep18771.
[33]MOLLER A, SAGASSER S, WILTSCHKO W, et al. Retinal cryptochrome in a migratory passerine bird: a possible transducer for the avian magnetic compass [J]. Naturwissenschaften, 2004, 91(12): 585588.
[34]ZHOU Zuoqiong, PENG Xiyang, CHEN Jianbin, et al. Identification of zebrafish magnetoreceptor and cryptochrome homologs [J]. Science China Life Sciences, 2016, 59(12): 13241331.
(责任编辑:杨明丽)
