电催化合成氨研究进展
2021-06-26范文龙李林哲薛志伟孟秀霞张津津于方永杨乃涛
范文龙,李林哲,薛志伟,孟秀霞,张津津,于方永,杨乃涛
(山东理工大学化学化工学院,山东淄博255049)
氨(NH3)是一种具有刺激性气味的碱性气体,广泛应用于纺织、塑料和化肥等化工生产领域,是当今最常见的工业化学品之一[1-5]。另外,液氨含氢量为17.6%(质量分数),介于甲烷(25%)和甲醇(12.5%)之间,且易于储存和运输,是一种极具开发潜力的能源载体和储氢介质[6-11]。作为能源载体,它的燃烧产物是水和氮气,对环境友好[12];作为储氢介质,氨很容易裂解产生氢气,可用于燃料电池或其他应用场所的氢气供应[1,13-15]。
传统的氨合成方法主要是Haber-Bosch工艺[16-17],化学反应如式(1)。
较高的操作温度和催化剂能够提高反应速率、降低反应活化能,高压能够确保反应向正向进行,达到合理的氨收率[18-21],因此该工艺常在高温(300~500℃)、高压(20~50MPa)及催化剂条件下进行[8,16,19,22]。从原料来看,氢的生产主要是天然气(NG)通过脱硫、甲烷蒸汽重整和水煤气变换反应转化为H2和CO2,残余的CO通过甲烷化反应去除,CO2通过变压吸附过程去除[6-7,17,23]。此过程需要500~600℃的高温,会消耗大量的化石能源,能耗高达全球能源的1%~2%[16,24-26],而且平衡转化率相对较低,仅为10%~15%[4],同时每吨氨的合成伴随着大约1.87tCO2的排放,造成了极大浪费。原料N2主要由能耗较高的深冷或变压吸附工艺空分制得,由于其分子中含有键能高达941kJ/mol的高度稳定N N结构[27],因此合成氨时需要高温活化。综上,Haber-Bosch合成氨工艺能耗较大且排放大量温室气体,探索高效、节能、环保的合成氨技术具有重要意义[24]。


图1 电催化合成氨系统电池类型
1 固体氧化物电池电催化氨合成
1.1 固体氧化物电池电解质类型与氨合成原理
用于合成氨的固体氧化物电池(SOFC)典型结构为两个多孔电极和一个致密的固体氧化物电解质层,如图2。根据材料的成型方式,可以分成平板状、管状等。无论哪种形式,电极采用多孔结构都可以增大三相界面,提高传质效率,促进电极反应的进行;致密的电解质层可以隔开阴极和阳极,阻隔气体的扩散并进行质子或离子的传导,因此固体电解质的类型决定了电催化合成的工作过程。

图2 微管SOFC的微观结构[35]
固体氧化物电池系统的电解质材料主要为钙钛矿型[2,29,36-37]、焦绿石型[38-39]和萤石型[40-41]氧化物。其中,典型的钙钛矿为ABO3结构,如图3(a)、(b),A离子位于中心,多为稀土或碱土元素离子,如Sr2+、Ba2+等,B离子与氧离子呈八面体配位,常为过渡元素离子,如Ce3+/4+、Zr4+等[1-2];经过A位与B位离子掺杂,可改变离子/电子的传导性,但为维持材料结构稳定性,要求其容限因子接近1,因此选择半径相近的其他离子部分取代是研究的热点之一[42],此时结构可以表示为AB1-xMxO3-δ,其中M是稀土或过渡元素离子(Y3+、Gd3+、Yb3+、Nd3+、Sm3+等),δ是氧化物晶格中的氧缺位数[2,37,42-44]。Iwahara等[45]率先在SrCeO3钙钛矿中掺杂Yb3+、Mg2+、Sc3+、Y3+等,发现了这类材料具有较好的质子导电性能。当用于合成氨时,工作原理如图4(a),氢气在阳极被氧化为H+的同时释放电子,H+通过电解质来到阴极,结合外电路传递的电子,与N2发生半电池反应产生NH3[29]。可见,在合成氨过程中,气体的扩散、传质效率和电解质的质子传导能力是氨产率的重要影响因素。氢气从原料侧经扩散转移至阳极表面,物理吸附在表面后解离为氢原子[46-47],电极反应产生的质子被电化学传输到阴极。同时,氮气扩散并吸附于阴极催化剂表面,通过电解,氮气分子的N N断裂,氮原子加氢形成NH3分子[12,48]。因此,多孔阳极与阴极除具有良好的电子和质子传导能力外,还要有良好的催化性能以及高的化学和机械稳定性,以促进氢的解离和氨合成。寻找具有高质子传导性的电解质和高催化性能的电极材料成为了固体氧化物电解质体系电催化合成氨的研究热点,此内容将在1.2节详细叙述。
相对于质子导体钙钛矿型电解质,O2-导体固体氧化物电解质用于合成氨的研究比较少。萤石型氧化物是传统的氧离子导体,其结构为AO2结构,如图3(c),其中A为四价阳离子。它常用作固体氧化物燃料电池的电解质,当工作电极反向工作时,即形成电解池。2009年,Skodra和Stoukides[18]以钇稳定的氧化锆(8%YSZ,摩尔分数)为电解质,Ag为阳极、Pb-Ru为阴极、水蒸气和N2在阴极侧作为原料供给,如图4(b)。此过程中,水蒸气被电解,产生的H·/H+与N2反应生成氨,而氧离子则通过YSZ电解质传递后在阳极催化剂的作用下生成O2,由惰性气体He导出。此电催化合成氨体系由于水蒸气作为氢源,代替了纯化的氢气,使安全性明显提高,成本显著降低,但由于电极催化剂Ru导电性差等问题,导致生成的H·/H+很难与N2发生反应,氨合成速率较低。

图4 质子传导固态电池反应器氨合成原理
焦绿石型氧化物的结构为A2B2O7,如图3(d),其中A和B分别为三价和四价阳离子,当暴露在高温及湿氢气环境中时具有较高的质子导电性,主要应用于电解池、燃料电池、氢传感器等领域。根据阳离子半径比r(A3+)/r(B4+)的大小,金属离子在阳离子晶格中的有序化会使材料晶体结构发生改变。当比值大于1.22时,可得到有序的焦绿石结构(如La2Zr2O7),否则可视为无序的萤石结构(如La2Ce2O7)[2,38-41]。此类材料与钙钛矿型类似,可选用变价的稀土阳离子通过掺杂改变其离子电导率,但需注意的是,变价的阳离子半径变化较大将导致半径比发生变化,要维持此类材料稳定的相结构,必须选用合适半径的阳离子。焦绿石型的氧化物在低温时(<600℃)主要表现为质子传导,用于氨合成时,其工作原理与钙钛矿型质子导体类似。随着温度升高,氧离子传导增强,在700~900℃表现为混合导电。而且,这种材料的烧结温度很高(1600℃以上)[38-39],限制了其应用。

图3 固体氧化物电池系统的电解质材料的结构
比较上述三种不同电解质组成的电催化合成氨体系,钙钛矿型电解质具有较高的离子电导率和较低的运转温度,因此受到了研究者的青睐,下文主要对钙钛矿型固体氧化物电解池合成氨性能进行综述。
1.2 钙钛矿型固体氧化物电池合成氨性能
基于上述工作原理,钙钛矿型固体氧化物电解池的合成氨产率及法拉第效率的提高主要依赖于高质子电导率的电解质以及高选择性、高催化活性的电极两个方面。1996年,Panagos等[51]基于高温质子导体电解质提出了氨合成反应模型,指出电化学合成氨的产率比常规合成氨反应器中的产率高几个数量级,此研究开启了质子导体电解池用于电催化合成氨的研究。Marnellos[52]制成了厚度为1.5mm的管式SrCe0.95Yb0.05O3-δ(SCY)电解池,采用钯(Pd)电极催化剂,实现了高温常压下氨气的合成。570℃时,氨产率为4.5×10-9mol/s,但遇到的主要问题是高温条件下氨易分解为氢和氮,导致净转化效率降低至50%。此外,SCY陶瓷导电能力较差,限制了氨产率的提高。如果使用高质子导电性的固体电解质,可能会有效提高氨产率,而且有望使电池工作温度降低,实现中低温常压电化学氨合成。
对于钙钛矿结构的质子导体,理想的立方相钙钛矿结构材料(容限因子t≈1)一般具有较低的电导活化能,而晶格畸变将会使材料的质子电导活化能提高,工作温度增加。相对于BaCeO3,由于Sr2+(1.26Å,1Å=0.1nm)的离子半径小于Ba2+(1.42Å),SrCeO3中CeO6的畸变较大,导致SrCeO3基质子导体虽然具有很高的质子迁移数,但离子电导活化能明显高于BaCeO3基质子导体,需高温活化才能提高质子电导率。BaCeO3的工作温度相对较低,但易受二氧化碳和水的侵蚀,生成BaCO3、Ba(OH)2和CeO2,引起材料不稳定,因此可以通过掺杂稳定的离子来改善其稳定性。研究发现[53-55],BaCeO3与BaZrO3可以任意比例互溶形成固溶体,使质子电导率与化学稳定性提高。Vasileiou等[50]以Zr4+掺杂的BaZr0.7Ce0.2Y0.1O2.9(BZCY72)陶瓷膜为电解质研究了氨的电催化合成,探讨了运转温度、阴极室进料组成和外加电压对电池性能的影响,电池结构如图4(c)。当在阴极上引入纯N2时,在620℃下的合成氨速率为1.7×10-9mol/(s·cm2)。将H2和N2混合物加入阴极室,合成氨速率提高到4.1×10-9mol/(s·cm2)(T=620℃,H2/N2=1.0)。此两种情况下,高合成速率却伴随着低法拉第效率,分别为2.7%和10%。
研究发现[56-59],使法拉第效率降低的原因主要是竞争的析氢反应(HER)优于NRR发生,导致只有少部分e-与H+参与了合成氨的反应。具有高选择性与高催化性的电极催化剂可以有效抑制析氢反应,促进氨合成反应,提高法拉第效率。用于固体氧化物电池合成氨的催化剂有贵金属(Pt、Au、Ru、Pd等)与非贵金属催化剂(Fe、Mo、V等金属及其氧化物)两大类[60]。金属Ru在较低温度下对N N的解离具有很高的活性,而N N解离是催化合成氨的速率决定步骤。Skodra和Stoukides[18]报道了从水蒸气和氮气中电催化合成氨,以质子导体SCY作为固体电解质,阴极和阳极侧催化剂分别为Ru-MgO和Pd。阳极侧通入水蒸气代替氢气,通过电解直接将水蒸气还原为O2和H+,降低了氢气生产及其进一步纯化的成本;H+则通过电解质传递至阴极,与活化的氮分子结合生成氨,整个过程只需要提纯氮气。虽然此研究在450~700℃下成功合成了氨,但转化率较低,可能是工作电极(Ru)的导电性较差引起的。经过改进,在SCY表面上沉积导电性较好的金属Ag膜,再将工业Ru催化剂粉末沉积在Ag膜上,明显提高了转化率。然而,这种催化剂电极设计的问题在于,蒸汽电解(质子或氢原子)产生的大量氢组分未到达Ru表面,而是在Ag膜上形成H2,因此需要调整催化剂结构提高催化效率。
从电催化合成氨的反应过程来看,H+、e-和N2之间的电化学反应主要在气相、催化剂相以及电极和电解质等导离子相的三相界面(TPB)进行,所以Ru纳米粒子在电极上的高分散性非常重要。传统的电极需要在约1000℃烧结,温度较高,容易导致Ru纳米粒子团聚,通过原位掺杂后还原形成的催化剂则可以避免这种现象。Kosaka等[61]在La1-xSrxTiO3的B位掺杂了40%Ru,还原气氛下热处理,在钙钛矿表面原位形成了分散性良好的2~5nmRu纳米粒子,图5可以明显观察到溶出的Ru纳米粒子,有效避免了团聚。虽然氨生成速率在500℃时只有3.8×10-12mol/(s·cm2),但原位还原的方法提供了一种处理催化剂的新思路。Kim等[62]以Ru掺杂的钛酸锶钛酸钡(Ba0.5Sr0.5Ti1-xRuxO3-δ,x=0、0.05、0.1) 作 为 阴 极 材 料[Ni|BaCe0.4Zr0.4Y0.2O3(BCZY)|BCZY-BSTR],由湿H2和干N2电化学合成氨。增加Ru4+对Ti4+的取代使欧姆电阻降低,改善了其电化学性能,使氨合成反应的催化活性明显提高。700℃时,最大氨生成速率为1.1×10-9mol/(s·cm2),并表现出了较高的稳定性。

图5 La0.3Sr0.6Ti1-x Ru x O3(x=0~0.4)在3%H2中900℃还原热处理3h前后的TEM图[61]
表1汇总了固体氧化物电池的组成、工作温度、氨产率及法拉第效率(FE)。可以看出,用于合成氨的固体氧化物电解质主要是质子导体,它决定了电池的最佳工作温度在中温范围(500~800℃)。此温度范围内电解质的质子电导率较高,而电子电导率较低,保证了电解池的有效运转,但从合成氨的效率来看,由于在600℃以上时,氨分子发生分解而使氨产率急剧下降[63],所以其质子电导率仍需提高,以便降低操作温度,减少氨分解,提高法拉第效率。此外,具有良好催化活性与选择性的高效催化剂有助于氮气分子的传质、解离与加氢反应,将使合成氨速率及法拉第效率大幅提高。因此提高电解质的质子电导率、降低其操作温度以及开发高选择性的电极催化剂是目前的主要研究方向。在合成氨过程中,外加电压或电流密度较高时,氨产率也会提高,但法拉第效率会很低,若再增大外加电压,可能会损坏合成氨反应器,法拉第效率与氨产率之间存在一个平衡。如前所述,合成氨是一个放热反应,低温和高压有利于反应进行,高温下氨气易分解,由于该电催化合成氨系统不用高压,所以需建立工作温度、反应稳定性、氨产率及法拉第效率的平衡,所需的高温若由热电厂或其他途径的废热提供,则既避免了热量浪费又可使整个过程更加环保。

表1 固体氧化物电池电催化合成氨
2 熔融盐电池电催化氨合成
2.1 熔融盐电池氨合成原理
熔融盐电解质一般为熔融态的含有氮化物离子的碱金属卤化物,具有较高的离子电导率[71],而且由于电解质中不含水,HER副反应在很大程度上可以避免,从而提高法拉第效率[72]。N2分子中N N键能高达941kJ/mol,需要高温将其活化,这也是传统氨合成的控制步骤之一,如果采用熔融盐电解质组成的电催化体系,则可有效降低N2分子的活化能。熔融盐电池氨合成原理如图6,电极反应为式(2)~式(4)。

图6 熔融盐电池合成氨示意图及合成氨实验装置

电极反应与扩散传质过程密切相关,H2在阳极氧化产生H+,N2在阴极还原得到N3-,相互扩散反应后产生NH3。N3-/H+产生于电极与熔融盐的界面,而后这些离子在熔融盐电解质中扩散接触后才能合成NH3,探索能够使N3-快速溶解、扩散的熔融盐是一个关键。300℃时,Li3N在LiCl-KCl-CsCl熔盐中的溶解度高达0.5%(质量分数),可以很容易地实现N3-从阴极表面到电解质中与H+的反应。有研究表明[72],加入0.5%Li3N后,法拉第效率和氨产率分别比之前高163倍和111倍。基于上述研究,Tsuneto等[73]设计了Li作为中间体的NH3合成途径:200℃时金属锂在阴极侧与N2反应形成氮化锂(Li3N);当通电进行电解时,阴极上产生的N3-通过电解质传递到阳极侧,与H2或水蒸气等氢源反应生成氨气,如图6(a)。此反应中,H2与N2在电极活性位点上发生电极反应,反应速率取决于扩散传质过程与活性位点的数量,因此高效的电极催化剂能提高氨合成反应的选择性及效率。
2.2 熔融盐电池合成氨性能
熔融碱金属氯化物(LiCl-KCl-CsCl)基电解质由于高离子电导率、热力学稳定引起了人们的持续关注,电极的选择常为多孔材料,以增加反应活性位点。2003年,Murakami等[74]报道了在LiCl、KCl和CsCl熔融盐及大气压条件下的电解合成氨工艺,其中LiCl、KCl、CsCl的摩尔比为57.5∶13.3∶29.2,电极采用的是多孔的Ni片(6mm×1.6mm,比表面积为7500m2/m3)。摩尔分数0.5%的Li3N被溶解在电解质中提供N3-,反应气体为氢气和氮气。在400℃、0.7V得到的最大氨产率为0.12mol/(h·m2)[3.33×10-9mol/(s·cm2)]。通过改进电极的结构和优化电解条件,法拉第效率提高到了72%。在此基础上,改用碳棒为阳极、水蒸气为氢源,氮气在阴极被还原为N3-,N3-在电解质中与H2O反应生成NH3。300℃、2.9V时,合成氨速率和法拉第效率分别为0.72mol/(h·m2)[2.0×10-8mol/(s·cm2)]和23%,低于H2为氢源时的法拉第效率[76]。究其原因,可能是由于多孔的Ni片催化剂在运转温度下难以将水蒸气催化分解,因此需要改进催化剂组成及结构,以提高氨合成效率。
催化剂的改进推动着合成氨工作的进步,研究发现[34,60,77],催化剂的尺寸、结构、形貌等会对催化活性产生重要影响,将催化剂尺寸降低到纳米水平会增加不饱和活性中心,从而增强N2的捕获和解离,改善氮还原反应(NRR)动力学和选择性。Licht等[78]在熔融盐电解质中加入纳米颗粒催化剂,展示了一种新的电催化氨合成途径。在200℃下使用熔融氢氧化物(NaOH/KOH)作为电解质,以不锈钢网作为阴极、镍片为阳极,在Fe2O3纳米颗粒电催化剂上通过N2和蒸汽的电解合成氨,最大氨产率和最高法拉第效率分别为6.7×10-9mol/(s·cm2)和35%。与传统的Fe2O3颗粒相比,纳米Fe2O3具有较高的表面积和丰富的活性位点,所以法拉第效率较高。但由于Fe2O3纳米颗粒在电解质中只是简单分散,随着时间的推移在静电作用下有聚集团聚的倾向,不利于电池的长期稳定运行,在200℃下运行的第4~6h,氨的产率下降到前4h平均值的85%。Cui等[57]在Licht工作的基础上使用熔融氢氧化物电解质通过两步铁基循环过程从N2和H2O中产生氨。循环过程如图7,第一步是通过电化学还原Fe2O3产生Fe;第二步是用鼓泡的N2与蒸汽生成NH3,Fe作为催化介质不被消耗,重新回到第一步。在熔融盐电解池中,两个反应步骤在250℃下等温进行,无需切换温度,也无需分离介质,因此更易于投入工业实践。该循环在1.15V时法拉第效率高达79.8%,最大氨产率为1.34×10-8mol/(s·cm2)。Kim等[75]在LiCl-KCl-CsCl(摩尔比57.5∶13.3∶29.2)电解质中加入两种纳米催化剂(纳米CoFe2O4和纳米Fe2O3)。实验装置如图6(b)所示,实验在氩气保护中进行。在327℃时合成氨速率分别为1.78×10-10mol/(s·cm2)和3.00×10-10mol/(s·cm2),分别比不使用纳米催化剂高102%和240%,证明了纳米CoFe2O4和纳米Fe2O3的催化活性,改变催化剂的尺寸和结构有效提高了氨合成效率。

图7 氨生产的两步电解-化学循环[57]
表2对熔融盐电解质体系的合成氨报道进行了总结,可见基于熔融盐电解质的电化学电池一般在200~500℃的温度范围内运行。从热力学上看,高温时氨易分解,虽然熔融盐电池的运转温度不高,但仍存在NH3向N2分解的问题,因此需要进一步优化操作温度以提高氨生成效率。另外,纳米尺度的催化剂具有更多的活性位点,能促进氮还原反应(NRR),是一个重要的研究方向,但长期运行的稳定性问题是一个需要克服的难题。
表2 熔融盐电解质电池合成氨
3 聚合物膜电池合成氨
3.1 聚合物膜电池合成氨原理
该体系的电解质为质子交换膜,在低温时能传导质子而对电子绝缘,具有选择透过性。聚合物膜作电解质,工作温度一般不超过100℃,因为整个合成氨反应是放热的,低温下反应变得自发,可以有效避免氨高温分解。而且,在低温时,质子交换膜的质子传导速率要高于中高温质子导体,比如,Nafion膜在室温下的质子传导率最高约0.1S/cm[80]。聚合物膜电池氨合成过程中,阳极上通入燃料气(氢气或水蒸气),产生质子;阴极上发生N2还原的电化学反应,其反应式为式(5)~式(7)。

3.2 聚合物膜电池合成氨性能
2000年,Kordali等[81]首次在低于100℃的温度和大气压下,以Nafion膜为电解质进行电催化合成氨。沉积在碳纸上的Ru作为阴极催化剂,Pt作为阳极,2mol/L KOH溶液作为电解液与Nafion膜接触,在阴极通入氮气。虽然产氨速率较低[2.78×10-12mol/(s·cm2)],但这是首次在聚合物膜电池中实现了电化学合成氨。刘瑞泉教授课题组[82]以Nafion膜和磺化聚砜(SPSF)膜为电解质组成电化学合成氨电池,研究了在常压和低温(25~100℃)下氨合成性能。通过溶胶凝胶法制得Sm1.5Sr0.5NiO4(SSN)和Ce0.8Sm0.2O2-δ(SDC)粉体,SSN粉体压制成陶瓷片作阴极,NiO与SDC混合均匀后压制成陶瓷片作阳极,Ag-Pt膜作电流收集器,电池结构如图8。分别在阳极和阴极通入湿氢气和干燥的氮气,在80℃、2.5V时,最高合成氨速率分别为1.05×10-8mol/(s·cm2)和1.03×10-8mol/(s·cm2),可 以 发 现Nafion膜与SPSF膜的氨合成速率非常接近,都可用于电催化合成氨。但金属Ni与Nafion膜的化学相容性并不好,两者反应会使Nafion膜失去质子传导性,所以反应不能持续进行。

图8 质子交换膜电池结构示意[82]
空气中氮气的体积分数为78%,如果省略N2的纯化过程,直接从空气中合成氨无疑是一个更好的选择。2013年Lan等[83]在室温环境下使用Nafion膜传递质子,以空气代替氮气、水蒸气代替氢气作为原料,电催化直接合成氨。H+型Nafion膜在氨存在下转化为NH+4型,具有较好的质子传导特性,并且可用于氨的连续合成。在常压下,以氮气和水为原料,当外加电压为1.6V时,最大氨产率为1.14×10-9mol/(s·cm2)。这项工作为在温和条件下生产氨提供了新的途径。
表3对部分聚合物膜电解质体系的合成氨报道进行了总结。该体系的工作温度一般为20~100℃,聚合物膜电解质在低温下具有较高的质子传导性,能在低温常压下实现氨的电催化合成,并且降低氨的分解速率,避免了高温下设备与材料的维护问题。但是随着工作时间的增加,聚合物膜的结构与功能发生改变,如在碱性条件下酸性膜(如Nafion膜)的降解,如何提高膜的使用寿命是一个重要的课题。在合成氨系统中,相对来说,质子的浓度是过量的,往往是溶解性氮气的不足限制了合成氨反应的进行,提高N2的溶解性,增强其扩散传质过程有助于提高氨产率和法拉第效率。在催化剂方面,Pt等贵金属是较好的选择,但由于成本等方面的考量,非贵金属催化剂的研究与使用将成为一个趋势,相信在未来会有选择催化性质更为优异的低成本催化剂用于氨的合成。

表3 聚合物膜电解质电池合成氨
4 液体电解质电池电催化合成氨
4.1 液体电池合成氨原理
液体电解质中的氮还原反应是目前在环境条件下合成氨最现实的方法之一。该方法可以在接近室温甚至是常温常压下合成氨,避免了高耗能、高温运行以及使用昂贵的耐高温材料等缺点。液体电解质主要包括水溶液电解质、有机溶剂电解质及离子液体电解质三类。
水溶液电解质体系中,阴极的进料气体为氮气,具体反应取决于水溶液的类型,具体如式(8)~式(15)。
(1)酸性溶液中

(2)碱性溶液中

(3)有机溶剂电解质中,水或者其他溶剂为氢源,例如

(4)离子液体电解质中,Li3N作为中间介质,由N2与Li+反应生成。

4.2 液体电解池合成氨性能
在水溶液电解质中进行氮还原反应是一种简单且具有成本效益的方法,它不需要像固体电解质和熔融盐电解质那样的高温环境,不用考虑能量的损耗以及材料在高温下的耐受度。但该体系也存在一些问题,如常温常压下N2在水溶液中的溶解度低。而且电解水的理论电压为1.23V,小于N2的分解电压(3.4V),在热力学上HER更容易进行,它是NRR的主要竞争反应,也是NRR合成氨的法拉第效率普遍较低的主要原因之一[84-85]。
N2在水溶液中溶解扩散并扩散到催化剂表面,然后才能进行下一步还原反应。而N2在水溶液体系中溶解度极低、扩散系数小,限制了电催化合成氨反应的进行。适当增加氮气分压可以增强氮气的溶解、扩散、传质过程,提高合成氨的选择性和氮气还原性能。为克服N2在水溶液体系中溶解度低的难题,有机溶剂作为电解质也是一种有希望的方法[29,48,86-88]。Kim等[87-88]采用2-丙醇/去离子水(体积比9∶1)的混合物为电解质,阴阳极分别为Pt和多孔镍,以H2SO4作为支撑电解液,如图9(a),氨产率为1.54×10-11mol/(s·cm2)。与纯水相比,混合电解质使NH3合成显著增强:2-丙醇/水和去离子水的法拉第效率分别为0.89%和0.07%。尽管2-丙醇有更高的N2溶解度,但在还原环境中不稳定且合成氨的法拉第效率仍然太低,还需要进一步改进。乙二胺(EDA)的稳定性较高,LiCl/EDA电解质系统在Li+开始还原为Li的情况下也能保持稳定。因此,LiCl/EDA被作为阴极电解质加入到一个新型的双室电解槽中,如图9(b)。电化学合成氨过程包括以下反应:①H2O在阳极上被氧化生成O2和H+;②H+或质子化胺(—NH2+)向阴极移动;③N2与e-和H+反应生成NH3。经过改进后,氨产率有了很大提高,达到3.58×10-10mol/(s·cm2),法拉第效率为17.2%。但是有机溶剂的导电能力差,限制了氨产率的提高。

图9 2-丙醇基氨合成的原理及乙二胺(EDA)基氨合成示意
离子液体是指在室温或接近室温时全部由离子组成的液体,也称为低温熔融盐,具有高离子导电性和化学稳定性等特点。Pappenfus等[89]使用疏水性离子液体C2H5OH/1-乙基-3-甲基咪唑(EMITFSI)/LiClO4作为电解质,其中LiClO4作为合成氨用锂离子的来源,以乙醇为质子源,以Pt片为阳极,在面积为2cm2的Ni片阴极上进行氨合成反应。在环境温度和大气压条件下,得到了3%~5%的法拉第效率。在不同的实验条件下(如高压),法拉第效率会提高,但在实验中观察到离子液体电解质的击穿,表明该体系长期运行的稳定性存在问题。
影响合成氨法拉第效率和氨产率的另一个因素是存在水被电解还原成氢气的副反应[90-92],采用合适的氨合成催化剂抑制水分解反应,提高氨合成的选择性,是有效提高氨产率和法拉第效率的方式之一[58]。Chen等[33]用碳纳米管负载的氧化铁(Fe2O3/CNT)作电催化剂,在室温、常压及2.0V的电位下,获得了2.2×10-3gNH3/(m2·h)的氨生成速率,该产率高于贵金属型电催化剂(Ru/C)在20℃、常压下的氨合成速率[81]。这是因为在此过程中,NH3电催化合成的活性中心是铁颗粒与CNT界面形成的特定碳位能激活N2,使其对加氢反应更强。Chen等[93]继续探究Fe2O3/CNT的催化性能,对Fe2O3/CNT进行电化学活化3h后发现合成氨的性能提高,氨产 率 和 法 拉 第 效 率 分 别 为41.6μgNH3/(mgcat·h)和17%。Han等[94]设计并合成了非贵金属氮还原反应催化剂——Nb2O5纳米纤维,用于环境条件下NH3的合成。如图10(a),N2分子以端接方式吸附在Nb2O5表面,Nb2O5表面的铌边缘原子在N2分子的极化和活化中起关键作用。如图10(b)所示,电荷交换和转移主要发生在表面的铌原子和N2之间,相邻铌原子上的电子向后转移至吸附的N2。由于电子注入,吸附的N2(NN*)可以被强烈地削弱,并且对于随后的加氢步骤表现出高的活化,这是NRR过程中的关键步骤。将0.1mol/LHCl电解液用N2鼓泡30min,在室温(25℃)下测试,平均氨产量为43.6μg/(h·mgcat),FE为9.26%。在Xian等[95]的工作中,8%(摩尔分数)Y2O3掺杂的ZrO2纳米粒子(8YSZ-NPs)被用作非贵金属催化剂,碳纸(CP)为电极,进行氮还原。在0.1mol/LNa2SO4电解液中得到10.84μg/(h·mgcat)的NH3产率和12.3%的法拉第效率。
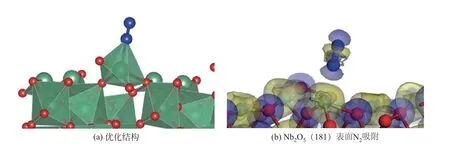
图10 DFT计算的优化结构和Nb2O5(181)表面N2吸附构型的电荷密度差[94]
单原子催化剂是近年来得到广泛关注的一种新型高效电催化剂,它能够有效地减少贵金属的使用。由于其原子水平的分散增加了活性中心的数量[59,96-97],但单个的原子容易聚集形成团簇,所以需要具有大量缺陷、孔洞的载体材料锚定单原子以防止聚集[56]。自然界中N2的固定是通过固氮酶来实现的,而固氮酶的活性中心是一种Mo基结构,单个Mo原子很可能是一种有前途的催化剂[98],Xin等[77]从中得到灵感,设计了固定在氮掺杂三维多孔碳上的Mo单原子(SA-Mo/NPC)催化剂(图11),并在室温常压下进行了电催化合成氨,氨产率为34.0μg/(h·mgcat),法拉第效率为14.6%(-0.3Vvs.RHE)。这种非贵金属单原子由于其原子水平的分散、独特的催化性能和不饱和金属配位环境保证了单原子催化效率和运行稳定性,在0.1mol/L KOH和0.1mol/LHCl中实现了较高的活性和耐久性。另外,作为载体的氮掺杂三维多孔碳也促进了气体扩散和催化反应的进行,Brunauer-Emmett-Teller(BET)分析其比表面积为302.3m2/g,三维多孔结构有利于电催化过程中的传质。
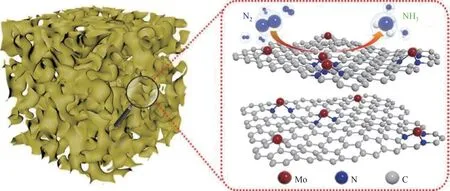
图11 SA-Mo/NPC及其相应的原子结构模型[77]
表4对部分液体电解质体系的合成氨报道进行了总结,包括电解质、电极、催化剂、操作温度、最大氨产率及法拉第效率。液体电解质合成氨的操作温度低,多在室温下进行,避免了高温下NH3的分解。但水溶液电解质的N2溶解度低且有严重的竞争析氢反应,导致法拉第效率难以提高。适当增加氮气分压、选用合适的溶剂等方法均可增强氮气的传质过程,提高合成氨效率。想要提高法拉第效率和氨产率,还有待于催化剂的发展,例如,近些年,单原子催化剂就是一个热点。有机溶剂和离子液体电解质分别存在导电性差和不稳定性的问题,限制了它们的应用。

表4 液体电解质电池合成氨
5 结语
本文针对基于固体氧化物电解质、熔融盐电解质、聚合物膜电解质以及液体电解质的电催化合成氨研究进行了系统性的综述。通过文献对比分析,电催化合成氨产率通常分布在10-13~10-8mol/(s·cm2)范围,法拉第效率不高于17%,尚面临着许多科学和技术问题,如:①高质子传导率的固体氧化物电解质材料的开发;②熔融盐电解质电池长期运行的稳定性不足;③聚合物膜的使用寿命问题;④液体电解质的氮气溶解度低以及竞争的析氢副反应等;⑤电解质/电极界面相容性及离子、电子传递扩散性能等。
从节能环保与商业化生产的角度出发,耗费的能源、产生的污染物以及投入的成本越少越好,如固体氧化物电池和熔盐电解质电池的高温操作对设备及材料的要求较高,增加了相应的成本,但电极催化剂的效率相对较高;而聚合物膜和液体电解质电池在低温或常温合成氨更具优势,但法拉第效率和氨收率仍需提高。因此需要建立电池体系、运转温度、气体分布/吸脱附、离子扩散传递等与氨产率、法拉第效率以及电池稳定性之间的构效关系,以指导电催化合成氨研究。为此,还需深入开展以下方面的探索。①反应机理的解析。目前大多数机理研究仍停留在材料层面,缺乏系统性,很少从理论层面进行研究,因此建议实验研究的同时,结合DFT、流场模拟等手段从理论上分析NRR或HER反应机理,解析气体扩散和吸脱附过程以及反应控制步骤等,以提高反应效率。②积极寻找和开发用于合成氨的高效电极催化剂。合成氨电极催化剂材料种类日渐丰富,催化性能与稳定性也在提高,尤其是极具潜力的高性能非贵金属催化剂或单原子催化剂的开发与利用,已将催化效能大大提高,还可结合仿生、理论模拟等方式对其进行改性、表面修饰等,以期提高长期稳定性。③气体在电极上扩散、吸脱附以及离子的传递规律。N2或H2在电极上的扩散和吸脱附是反应的第一步,因此探索气体分布规律将利于促进合成氨反应;H+或N3-的传递将影响合成氨速率,因此需进一步研究离子传递过程,抑制析氢反应,以提高氨产率和法拉第效率。
