MiR-149通过PHGDH对慢性髓系白血病细胞葡萄糖代谢的影响*
2021-06-25尹石红徐修才
尹石红 徐修才
慢性髓系白血病(Chronic myeloid leukemia,CML)是一种以髓系细胞恶性增殖为主要特征的干细胞疾病。大约95%的CML患者由于9号和22号染色体相互易位而产生染色体异常t(9;22)(q34;q11),产生一种致癌融合蛋白,称为BCRABL。其具有持续激活的酪氨酸激酶活性,通过异常激活下游存活信号通路PI3K(phosphatidylino sitol3 kinase)、STAT5(signal transducer and activator of transcription 5)等来转化髓系祖细胞[1,2]。目前,CML一线治疗主要依赖于酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs),其可以通过竞争性抑制ATP与ABL激酶催化中心的结合,阻断酪氨酸激酶的活化,从而达到治疗目的,具有良好的治疗效果[3]。然而,在接受TKIs治疗的CML患者中,仍有部分CML患者对TKIs具有原发性或继发性耐药,且耐药呈多样化和个体化特点,其具体机制尚未完全明晰[4]。
miRNA是一类长度约为22个核苷酸的小分子,近年来越来越多的研究证实miRNA参与调控慢性髓细胞白血病的发病,甚至与TKIs耐药机制密切相关[5]。有研究发现,过表达的miR-202通过靶向己糖激酶2增强伊马替尼耐药的CML细胞对TKIs的敏感性,从而促进耐药细胞凋亡[6]。同时还有研究表明异常表达的miR-149可以通过靶向调控下游JunB mRNA的表达,进而激活细胞内凋亡相关的信号通路,参与急性淋巴细胞白血病的发生发展[7]。但是miR-149在CML中的表达情况及临床意义则报道较少。
3-磷酸甘油酸脱氢酶(3-Phosphoglycerate dehydrogenase,PHGDH)是催化丝氨酸合成途径的第一个关键酶,催化糖酵解中间产物3-磷酸甘油酸生成3-磷酸羟基丙酮酸,将糖酵解中间产物引入丝氨酸生物合成途径(Serine synthesis pathway,SSP),控制着由糖酵解进入SSP的代谢流量[8]。研究证实,PHGDH在大肠癌、黑色素瘤等多种实体瘤中异常表达,与肿瘤的发生和增殖密切相关,并可能成为肿瘤治疗的新靶点[9,10]。有文献报道转录因子特化蛋白1(Specificity protein1,Sp1)是miR-149-5p的下游靶基因。Sp1是一般转录因子家族的成员,与肿瘤细胞的生长、凋亡密切相关,它还可以调控下游基因PHGDH的表达[11,12]。所以PHGDH可能为miR-149的下游靶点。但是在恶性血液病,包括慢性髓系白血病中的PHGDH表达情况尚不清楚。
本课题检测了CML细胞株K562和K562G细胞中miR-149-5p及PHGDH的表达情况,同时分析细胞葡萄糖摄取量的变化。通过过表达miR-149-5p的细胞模型,进一步探讨miR-149-5p相关通路与CML细胞糖酵解活性,以及伊马替尼耐药产生的相关性,为CML的临床治疗提供新的研究方向。
技术与方法
1 试剂与仪器 IMDM培养基(Gibco,美国),胎牛血清(FBS)( Gibco,美国),伊马替尼(大连美仑生物,中国),CCK-8细胞增殖试剂盒(同仁公司,日本),葡萄糖检测试剂盒(Abbkine,美国),SpectraMAX i3x酶标仪(MolecuLar Devices,美国),qRT-PCR试剂盒(TaKaRa生物公司,日本),慢病毒试剂(上海吉凯基因,中国),miR-149、U6引物(上海吉玛,中国),PHGDH、GAPDH引物(合肥俊安生物,中国),PHGDH抗体(Cell Signaling Technology (CST),美国),GAPDH抗体(proteintech,美国)。细胞培养箱(37 ℃、5%CO2)(Thermo Scientific,美国),逆转录仪器Gene Amp PCR system 9700(Thermo Scientific,美国),荧光定量PCR仪(ABI 7500,美国),FUSION-FX5凝胶成像系统(VILBER LOURMAT,法国)。
2 构建伊马替尼耐药的CML细胞株 K562G人来源的慢性髓系白血病细胞株K562从上海生命科学研究所获得。K562细胞用含1%青霉素链霉素和10%FBS的IMDM培养基,置于37 ℃、5%CO2培养箱中培养。采用浓度梯度诱导法构建伊马替尼耐药的细胞株K562G,从0.1 μmol/L伊马替尼开始,每3天传代一次,浓度每6天增加0.2 μmol/L,直至增加至5 μmol/L后,保持并传代3次,CCK8实验鉴定耐药倍数。
3 CCK8实验检测K562和K562G细胞的IC50 取对数生长期的K562和K562G细胞,150×g离心5 min,弃去上清,用含10%FBS的IMDM培养基重悬细胞,按1×104个/孔的密度调整细胞数接种于96孔板,每孔总体积100 μL。5个实验分组如下:空白组(IMDM培养基)、K562对照组(细胞悬液)、K562G对照组(细胞悬液),K562+IM处理组(IM浓度为3 μmol/L,2.5 μmol/L,1.5 μmol/L,1 μmol/L,0.5 μmol/L)、K562G+IM处理组(IM浓度为200 μmol/L,150 μmol/L,100 μmol/L,50 μmol/L,10 μmol/L),以上每组设5个复孔,均培养24 h后,K562+IM处理组及K562G+IM处理组每孔加入相应浓度的IM试剂10 μL,培养24 h后,每孔再加入CCK8试剂10 μL,37 ℃培养箱孵育1.5 h,于酶标仪上测定450 nm波长吸光度值。IC50(K562G)/IC50 (K562)在20倍以上才可以进行后续实验。
4 慢病毒转染实验 采用耐药伊马替尼的K562G细胞株进行mir-149-5p的慢病毒过表达包装,具体操作步骤如下:约1×105个细胞加200 μL的IMDM完全培养基铺于48孔板,放于37 ℃和5%CO2的培养箱中培养过夜。次日显微镜下观察细胞密度,约为30%~40%(感染时细胞数约为2×105个细胞/孔)左右可以进行下一步实验。从冰箱取出慢病毒OE(过表达)和NC(阴性对照)置于冰上融化。预实验发现病毒感染MOI值为80的时候感染效率最佳,OE组每孔加入16 μL病毒用量,NC组加入20 μL病毒用量,并加IMDM完全培养基补足至200 μL。感染后16 h可换液一次。一般感染后72 h于荧光显微镜下观察GFP荧光。感染效率=荧光蛋白表达的细胞数/同一视野明场总细胞数×100%。慢病毒感染72 h后,传代1次,可向培养基中加入嘌呤霉素用于筛选带GFP荧光的目的细胞株,嘌呤霉素的工作浓度为2 μg/mL时最佳。后期可用qRT-PCR实验方法检测mir-149-5p的表达情况。
5 RT-qPCR 根据TAKARA-RR036A试剂盒的操作说明进行逆转录实验,取400 ng总RNA加入5×PrimeScript RT Master Mix试剂2 μL,补足无Rnase水至反应总体积10 μL。逆转反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃冷却保存。根据TAKARARR820A荧光定量PCR试剂盒的说明进行基因扩增。按照说明书取2 μL的逆转录产物,分别加入Taq酶10 μL,引物1.6 μL,ROX染料0.4 μL,补足无Rnase水至反应总体积20 μL,进行PCR反应。扩增条件为:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 30 s,共进行40个循环。引物序列如下(见表1)。

表1 用于实时荧光定量PCR反应的引物
6 Western blot实验 取约1×106个目的细胞,150×g离心5 min,弃去上清加入RIPA裂解液及PMSF和磷酸酶抑制混合液,充分混匀后将蛋白质样品放在冰盒中,摇床上剧烈摇晃30 min,4 ℃ 1500×g离心15 min后,取上清至新的EP管中。按照说明书用BCA法测蛋白浓度,剩下的蛋白样品加入5×SDS上样缓冲液充分混匀,100 ℃加热15 min后将蛋白拿出,保存至-80 ℃冰箱中。取50 μg蛋白质样品进行10% SDSPAGE 电泳,100 V 90 min转膜至PVDF膜上,5%脱脂奶室温封闭1 h,分别加入一抗PHGDH抗体1∶1 000(Cell Signaling Technology,美国),GAPDH抗体1∶20 000(proteintech,美国)。4 ℃摇床过夜。TBST室温洗3次,每次10 min。加入相应的由HRP标记的二抗1∶50 000(Abbkine,美国),室温孵育1 h,TBST 洗3次,每次10 min,ECL化学发光显色系统显色。GAPDH作为内参。
7 检测K562、K562G、149G和149N细胞葡萄糖摄取量。
7.1 样本制备:取对数生长期的149G、149N细胞(约1×106个细胞),用预冷PBS洗涤细胞。500×g离心3 min,弃去PBS。分别加入200 μL预冷PBS,进行超声波破碎1 min(冰浴,强度20%或200 W,超声2 s,停1 s) ,使细胞迅速匀浆。4 ℃,12 000×g离心5 min,收集上清液并转移到新的EP管中。
7.2 标准品制备:将300 mg/dL Glucose标准品按说明书稀释为300、200、100、50、20、10、4、0 mg/dL,并计算出标准品线性回归方程。
7.3 步骤:将25 μL稀释标准品和样品转移到适当标记的试管中,每管加入500 μL邻甲苯胺试剂。置于金属加热槽100 ℃加热8 min后,在冷水浴中冷却4 min。将200 μL一式两份转移到透明的底部96孔板中,读取630 nm吸光度,最后根据公式计算出细胞样品的葡萄糖摄取量浓度。每次至少2个复孔,至少进行3次生物学重复实验。
8 LC-MS/MS样本制备 取对数生长期的K562及K562G细胞约1×107/mL,800×g离心10 min收集细胞,弃上清。用预冷的PBS洗涤2次,置于冰上,弃上清。液氮速冻2 h,-80 ℃冻存备用。每组各6个细胞和1个QC样品。样本分别加入1 mL甲醇/乙腈/水(2∶2∶1,v/v/v),涡旋混匀,冰浴中超声20 min,-20 ℃孵育1 h沉淀蛋白,14 000 rcf 4 ℃离心20 min,取上清,真空干燥。质谱检测时加入100 μL乙腈-水溶液(1∶1,v/v)复溶,14 000 rcf 4 ℃离心20 min,取上清进样分析。
9 统计学处理 使用GraphPad Prism 7.0进行作图,细胞系实验数据经过SPSS17.0处理,两样本的比较采用独立样本的t检验分析,P<0.05被认为具有统计学意义。
结 果
1 伊马替尼耐药的CML细胞株K562G中miR-149-5p的表达明显低于伊马替尼敏感的CML细胞株K562 通过CCK8实验检测出K562细胞株IC50为0.28 μmol/L(见图1A),K562G细胞株的IC50是14.6 μmol/L(见图1B),K562G细胞与K562细胞株的IC50比值为52,IM耐药的CML细胞株构建成功。miRNA芯片结果提示,K562和K562G细胞中mir-149-5p的表达存在明显差异(见图1C)。运用qRT-PCR方法检测K562和K562G细胞株中mir-149-5p的表达(见图1D)。
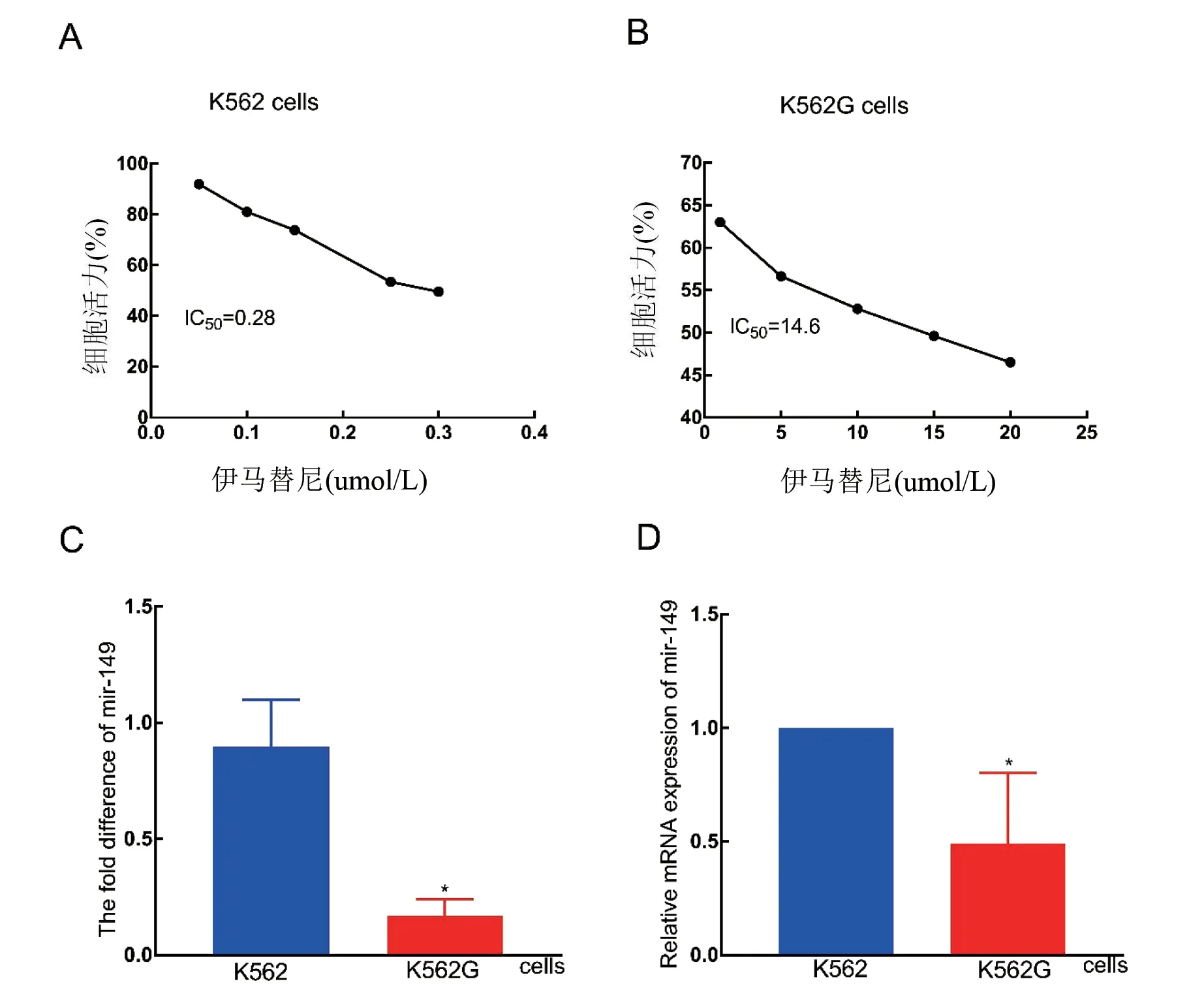
图1 CML细胞miRNA-149-5p的表达情况
2 K562和K562G,149G和149N细胞中葡萄糖摄取量的表达 IM耐药的K562G细胞株与IM敏感的K562细胞相比,葡萄糖摄取量明显升高(见图2A)。与149N细胞相比,149G细胞葡萄糖摄取量明显降低(见图2B)。
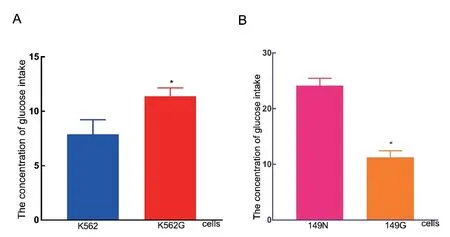
图2 不同CML细胞中葡萄糖摄取量
3 PHGDH是miR-149-5p的下游靶点 为了进一步研究mir-149-5p在CML中的作用,通过慢病毒转染技术在IM耐药的K562G细胞中过表达mir-149-5p,运用qRT-PCR检测149G细胞株中miR-149-5p的感染效率,结果显示149G细胞比149N细胞高表达miR-149-5p(见图3A)。运用qRT-PCR和WB实验,我们发现与IM敏感的K562细胞相比,PHGDH在IM耐药的K562G细胞中高表达。而149G细胞比149N细胞低表达PHGDH(见图3B&C)。miR-149-5p与PHGDH表达呈负相关。
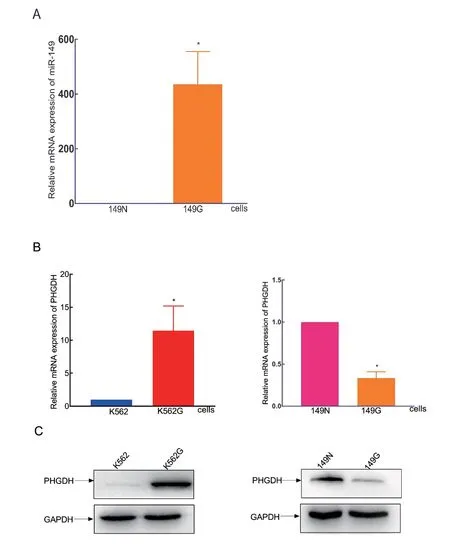
图3 PHGDH在CML细胞中的表达情况
4 基于LC-MS/MS技术对慢性髓系白血病细胞进行靶向代谢组学分析 为了进一步研究CML中miR-149相关通路与糖酵解活性的联系,我们通过LCMS/MS技术对K562细胞及K562G细胞进行三羧酸循环、糖酵解途径和氧化磷酸化过程中的30个重要代谢物靶向代谢组学分析,结果发现IM敏感的K562细胞株与IM耐药的K562G相比有9种代谢物表现出差异(*P<0.05)(见图4A)。如Fumarate (延胡索酸),L-Malic acid(苹果酸),Succinate(琥珀酸),Oxaloacetate(草酰乙酸),NADH(还原型辅酶Ⅰ),Flavin mononucleotide(黄素单核苷酸,FMN),cAMP(环磷酸腺苷),NADP(氧化型辅酶Ⅱ)在K562细胞株中升高更为明显,而Dihydroxyacetone phosphate(磷酸二羟丙酮)在K562G细胞株中升高更为显著。进一步分析数据发现这9种差异性代谢物主要涉及Tricarboxylic acid cycle(三羧酸循环)、Pyruvate metabolism(丙酮酸代谢)、Alanine,aspartate and glutamate metabolism(丙氨酸,天冬氨酸和谷氨酸代谢)、Glycolysis /Gluconeogenesis(糖酵解/糖异生)、Glyoxylate and dicarboxylate metabolism(二羧酸代谢)、Tyrosine metabolism(酪氨酸代谢) (见图4B)。

图4 CML细胞代谢组学分析
讨 论
目前CML的治疗药物主要是酪氨酸激酶抑制剂TKIs,如第一代TKIs伊马替尼等。虽然一些CML患者在服用伊马替尼等药物治疗后能够达到完全细胞遗传学缓解,但是仍有部分患者不能耐受伊马替尼药物毒性或者对伊马替尼产生耐药而必须更换其他药物[13,14]。近年来有研究表明[15],糖酵解的失衡可能利于肿瘤进展及耐药性产生,主要是源于原癌基因直接导致的代谢重编程,满足了肿瘤细胞的高合成代谢所需。这种代谢模式改变不仅见于实体瘤,也同样见于恶性血液病。
本研究首次发现IM耐药的K562G细胞中miR-149-5p的表达明显低于IM敏感的K562细胞。同时,K562G细胞较K562细胞高表达PHGDH及葡萄糖摄取量。但是通过进一步在IM耐药的K562G细胞株中过表达mir-149-5p后,发现149G细胞中的葡萄糖摄取量和PHGDH表达明显降低。提示IM耐药的CML细胞与葡萄糖代谢和PHGDH的高度表达密切相关,而miR-149可以负向调控其表达。为了进一步探究CML中miR-149相关通路的代谢特征,我们通过LC-MS/MS技术进一步对K562和K562G细胞进行代谢组学分析,结果发现Dihydroxyacetone phosphate(磷酸二羟丙酮)在IM耐药的K562G细胞中高度表达。而磷酸二羟丙酮是糖酵解途径的代谢产物,由1,6-二磷酸果糖在醛缩酶的作用下形成,可以通过磷酸丙糖异构酶的作用和3-磷酸甘油醛相互转化而进入糖酵解途径,也可以被还原为3-磷酸甘油,其主要涉及α-磷酸甘油穿梭机制。当IM敏感的CML细胞胞液中NADH浓度升高时,胞液中的磷酸二羟丙酮首先被NADH还原成3-磷酸甘油(α-磷酸甘油),反应是由细胞质的NAD有关的α-磷酸甘油脱氢酶所催化生成的。所以,CML细胞中磷酸二羟丙酮的表达与其NADH的表达呈负相关,可能与CML细胞IM耐药机制密切相关,为CML疾病判定疗效及预后的提供了新的研究方向。
以上实验结果表示miR-149-5p靶向PHGDH相关通路参与调控CML细胞伊马替尼耐药和葡萄糖代谢。过表达的miR-149可能通过降低CML细胞的高糖酵解活性,抑制CML细胞增殖,增加其对伊马替尼的敏感性促进细胞凋亡。所以,糖酵解抑制剂联合TKIs可能对CML耐药细胞展现出化疗增敏作用,使CML细胞因能量供应缺乏而死亡。其机制可能涉及三羧酸循环、丙酮酸代谢、丙氨酸,天冬氨酸和谷氨酸代谢、糖酵解/糖异生、二羧酸代谢、酪氨酸代谢等通路,这为研究CML耐药机制提供了新的方向。但miR-149-5p与PHGDH之间的具体调控机制尚未明确,这需要我们未来去进一步研究。
利益冲突所有作者均声明不存在利益冲突
