酮病奶牛血液极低密度脂蛋白(VLDL)的分泌特征
2021-06-21郭行健刘禄情张冰冰赵莹莹麻芯茹
王 爽,任 捷,郭行健,刘禄情,张冰冰,赵莹莹,麻芯茹,李 铭,徐 闯*,杨 威*
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学 生命科学技术学院,黑龙江 大庆 163319)
近年来,随着我国奶牛产业的高速发展,奶牛泌乳性能不断提高,奶牛相关营养代谢类疾病的发病率也持续增长,酮病是高产奶牛营养代谢类疾病中最常见的一种。酮病多发于奶牛围产期,临床上常出现低血糖、高酮血、酮尿、酮乳,消化功能紊乱,产奶量下降,体质量减轻等症状,个别奶牛甚至可能出现神经症状,且增大患其他围产期疾病的风险[1]。
奶牛酮病的发生与能量负平衡(NEB)及体脂动员有关,常于妊娠期最后2周和泌乳早期(产后0~70 d) 发病[2]。当奶牛发生能量代谢负平衡时,会引起血液中葡萄糖含量的降低,体脂开始动员,产生大量的非酯化脂肪酸(NEFAs),经过血液循环进入肝脏,而当肝脏内出现大量的NEFAs时,超出肝脏的氧化分解能力,则会进行不完全β-氧化,产生β-羟丁酸(BHBA)、丙酮、乙酰乙酸等酮体在体内大量堆积,最终引发酮病[3]。同时在肝脏吸收过量的游离脂肪酸后,线粒体对其氧化的能力不足,就会增加肝细胞中甘油酸三酯(TAG)的合成,高尔基体内载脂蛋白B(ApoB)与TAG结合,形成极低密度脂蛋白(VLDL)并以VLDL颗粒的形式向肝外组织转运进入血液中循环利用。
VLDL是内源性TAG由肝脏向肝外组织转运的主要形式,其合成和分泌是一个复杂且受到严密调控的过程,对机体的脂质稳态起重要作用。VLDL主要由TAG、胆固醇、胆固醇酯(TC)、磷脂(PL)及ApoB100、载脂蛋白AⅠ(ApoA Ⅰ)、载脂蛋白A Ⅳ(ApoA Ⅳ)、载脂蛋白C(ApoC)及载脂蛋白E(ApoE)等脂蛋白质构成[4]。肝脏VLDL合成过程分为两步,首先微粒体甘油三酯转运蛋白(MTP)催化部分内质网合成的TAG使其转移到粗糙内质网膜上发生易位的新生ApoB100上,在此过程中,新生ApoB100被部分脂化从而形成一个低脂的原始VLDL颗粒,在第二步中,原始VLDL出芽易位于平滑内质网和/或高尔基体腔与富含TAG的脂质小滴以及PL、TC及游离胆固醇结合,进而最终形成可以向肝外组织转运的成熟VLDL颗粒[5]。
研究显示NEB所致的酮病奶牛存在肝脏VLDL的组装原料不足,VLDL合成分泌障碍,最终导致奶牛酮病的发生,而其致病机制目前尚不清晰。本试验旨在明确酮病奶牛血液VLDL组成特征,为深入探究围产期酮病奶牛肝脏VLDL合成和分泌失衡机制提供理论依据及新的思路。
1 材料与方法
1.1 实验动物本试验在黑龙江省某千头集约化奶牛场进行,实验奶牛均为自由卧栏饲养,采食全混合日粮(TMR)。根据体况、年龄及胎次相近原则,随机选取产后7~14 d奶牛,检测其血液中酮体含量以及根据临床症状选取健康奶牛(BHBA<1.2 mmol/L)、临床型酮症奶牛(BHBA≥3.0 mmol/L)各6头作为实验动物。在清晨奶牛进食前,尾静脉采集30 mL血液备用。
1.2 VLDL颗粒分离血液样品室温下静止2 h,以2 000 r/min离心20 min,取血清加入乙二胺四乙酸二钠(EDTA)至1%,用1.006 kg/L的NaCl + NaBr溶液2 mL覆盖6 mL的血清,60 000×g离心30 min以从血清中去除乳糜微粒(CM)。再加入1.006 kg/L 的NaCl + NaBr溶液至8 mL,10℃、70 000 r/min 离心18 h分离VLDL。
1.3 VLDL颗粒负染色及颗粒特征观察通过超速离心分离得到的VLDL颗粒用PBS稀释后滴到经过辉光放电的铜网上,使其在铜网上停留1 min,该过程在冰上操作。然后将铜网用3滴去离子水快速清洗,每次清洗前后用滤纸将多余液体吸除。再滴加3滴甲酸双氧铀对铜网进行快速染色,每次染色前后用滤纸将多余液体吸除,最后1次滴加甲酸双氧铀要求其在铜网上停留5 min后吸除,甲酸双氧铀同样置于冰基底上以保持低温并遮光。染色后的铜网用滤纸从背面将多余液体吸除干净,于常温下自然风干后通过透射电镜观察VLDL颗粒特征情况。
1.4 VLDL-ApoB含量测定根据试验分组要求,按照1.1方法获取血清,按试剂盒说明书步骤测定不同疾病状态下奶牛血液中VLDL-ApoB的含量。
1.5 VLDL颗粒组成中PL、TC含量测定根据试验分组要求,分别采集不同疾病状态下的奶牛血液超速离心得到VLDL颗粒,按照 ELISA试剂盒说明书步骤检测健康奶牛、亚临床酮病奶牛及酮病奶牛VLDL的主要组成成分中PL、TC的含量变化情况并比较。
1.6 VLDL颗粒代谢组学特征研究按照1.2方法获得不同疾病状态下奶牛血液VLDL颗粒,利用LC-MS组学技术对奶牛血液VLDL颗粒进行脂质组学检测,分析比较其主要差异脂质。

2 结果
2.1 奶牛血液VLDL-ApoB含量检测对不同疾病状态下奶牛血液VLDL-ApoB含量测定结果如图1所示。结果表明,奶牛血液中VLDL-ApoB的含量随奶牛酮病的发病程度呈趋势性降低,且临床型酮病奶牛血液中VLDL-ApoB的含量显著低于健康对照组。
2.2 奶牛血液VLDL颗粒大小观察对不同疾病状态下奶牛血液VLDL颗粒特征观察结果显示,临床型酮病奶牛血液中VLDL颗粒均较大于健康奶牛,且临床型酮病奶牛血液VLDL颗粒中较大颗粒占据较大比例(图2)。
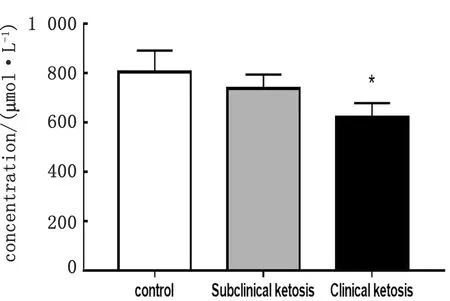
注:*.与健康对照组相比差异显著 (P<0.05);**.与健康对照组相比差异极显著 (P<0.01) 。下同
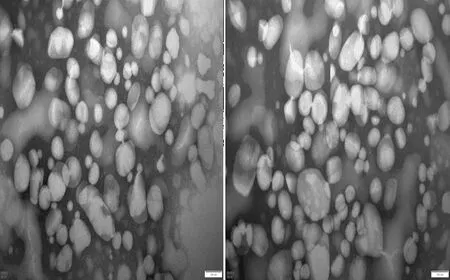
图2 健康(左)及临床型酮病(右)奶牛VLDL颗粒特征
2.3 奶牛血液VLDL颗粒组成中PL、TC含量测定对不同疾病状态下奶牛血液VLDL颗粒组成中PL和TC含量测定结果如图3所示。结果表明,奶牛血液VLDL颗粒组成中PL的含量随奶牛酮病发生程度呈趋势性降低,临床型酮病奶牛血液VLDL中PL含量显著低于健康奶牛。而对照组、亚临床型酮病组和临床型酮病奶牛组中TC含量差异不显著。
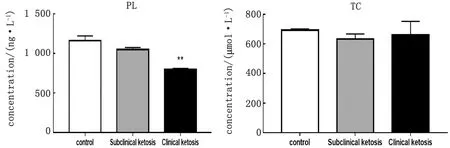
图3 VLDL颗粒组成特征
2.4 奶牛血液VLDL颗粒代谢组学分析对健康对照组奶牛及临床型酮病奶牛血液中VLDL颗粒代谢组学检测及分析结果如图4所示。结果表明,临床型酮病奶牛血液VLDL颗粒中不同TAG相关脂质与健康对照组无明显差异,但磷脂相关脂质如PE-NMe(22∶0/24∶1(15Z))、PE(22∶2(13Z)/24∶1(15Z))和PE (22∶5(4Z))均显著或极显著低于健康对照组。
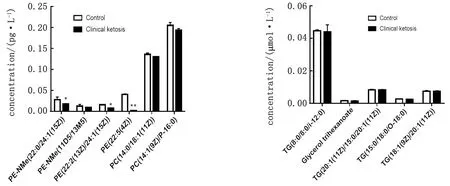
图4 奶牛血液VLDL颗粒代谢组学分析
3 讨论
围产期奶牛健康对整个泌乳周期都至关重要,是奶牛饲养管理中最具挑战性的时期之一。围产期奶牛由于经历妊娠-分娩-泌乳启动等生理应激,以及低能饲喂到高能饲喂转化的应激,导致奶牛由于干物质摄入减少但能量需求增加而出现NEB[6]。NEB是围产期奶牛普遍存在的一种亚健康状态,其会加剧围产期其他代谢疾病酮症、乳腺炎、乳热、子宫内膜炎等的发生,给奶牛业带来严重的经济损失。尤其奶牛等反刍动物较单胃动物相比,其代谢过程有极大不同,虽然反刍动物与单胃动物肝脏合成TAG的速率大致相同,但反刍动物分泌VLDL的速率却远低于单胃动物[7]。本试验通过采集酮病不同状态下奶牛血液并检测其血清中VLDL-ApoB的含量进一步证明了奶牛酮病的发生会进一步抑制VLDL的合成、组装及分泌过程。
研究表明,ApoB决定了VLDL从肝脏分泌的颗粒大小,但并不影响其分泌数量[8],而异常大的VLDL颗粒会降低其向肝外组织转运的速率,进而导致更多的TAG在肝细胞内沉积。本研究结果证实奶牛酮病的发生会抑制VLDL-ApoB分泌的同时,进一步证明了奶牛酮病的发生会促使肝脏组织向血液中分泌更大的VLDL颗粒,从而说明了ApoB与VLDL颗粒大小两者之间的相互作用关系对奶牛体内TAG的转运及沉积的影响。TAG、PL以及TC作为VLDL颗粒合成的重要原材料,其含量变化对VLDL颗粒的合成、组装以及分泌的影响尚不明确,但在本试验中ELISA试剂盒以及LC-MS组学检测结果显示,临床型酮病奶牛血液VLDL颗粒其组成中PL以及不同亚型的PL含量均较健康奶牛出现显著或极显著降低,表明在疾病状态下PL含量的缺失可能是影响VLDL合成及组装异常的重要因素,从而导致酮病的进一步加重,甚至促进奶牛脂肪肝的发生。
综上所述,VLDL-ApoB分泌在奶牛酮病发生时受到抑制,同时促进了异常大小的VLDL颗粒的分泌,PL作为VLDL合成组装的重要脂质部分,也在疾病过程中表现出了明显异常。因此,本试验结果表明,可以通过调控ApoB以及增加PL合成的途径来促进VLDL颗粒的正常合成、组装和转运过程,从而减少TAG在肝脏内的沉积而进一步保证奶牛机体健康。
