表达细胞色素b562及分子改造L-氨基酸脱氨酶提高全细胞转化法合成丙酮酸效率
2021-06-21习朝文刘延峰李江华堵国成
习朝文,刘延峰,李江华*,堵国成,陈 坚,刘 龙
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 糖化学生物技术教育部重点实验室,江苏 无锡214122)
关键字:L-氨基酸脱氨酶;饱和突变;丙酮酸;全细胞转化
丙酮酸是一种有广泛应用的有机物中间体[1],在医药、农业、食品及化工方面有重要用途[2-4]。目前,市场上丙酮酸主要由化工法和发酵法合成。在化工合成中,丙酮酸主要由酒石酸脱水和脱羧基合成。对于微生物发酵法,丙酮酸主要由2大类微生物(光滑球属酵母和大肠杆菌)合成[5]。目前,发酵法在合成丙酮酸过程中占主导地位,但是该方法的缺点是底物对丙酮酸的转化率比较低。本研究中,作者采用了一种新的用于合成丙酮酸的生物转化法。在之前的研究中,作者已用生物转化法合成了酮戊二酸、酮异己酸、苯丙氨酸和酮异戊酸等多种酮酸[6-10]。
该生物转化法中,L-氨基酸脱氨酶(pm1)发挥关键作用。pm1是一种依赖于黄素腺嘌呤二核苷酸(FAD)的膜蛋白,能催化L-型氨基酸生成对应的酮酸及氨[11-13],其反应机理见图1。在之前的工作中,作者已经构建好表达pm1的大肠杆菌菌株,其能催化丙氨酸生成丙酮酸,产量为14.57 g/L[14]。本研究中,作者通过2种策略进一步提高丙酮酸的合成效率。其一是通过表达细胞色素b562(cybC,14 100)来提高FAD在催化过程中的合成效率,该细胞色素能将H原子由FADH2通过电子传递链传递给氧气[15-16]。其二是通过饱和突变技术对pm1定向进化提高其催化能力。
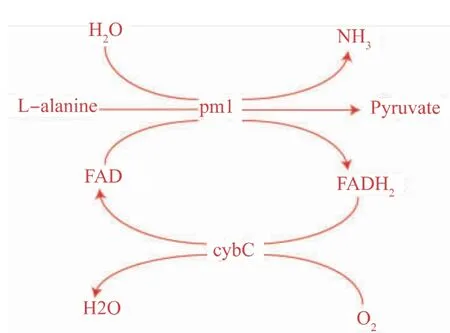
图1 L-氨基酸脱氨酶催化丙氨酸生成丙酮酸反应机理图Fig.1 Reaction mechanism diagram for pyruvate production from L-alanine by L-amino acid
1 材料与方法
1.1 相关试剂
Prime STAR HS DNA polymerase,2×Taq PCR mix,SanPrep柱式质粒小提试剂盒,Ezup柱式细菌基因组DNA抽提试剂盒,DNA纯化试剂盒和细菌感受态制备试剂盒:均购自TAKARA公司(中国大连);丙酮酸钠标样和FAD分析试剂盒:购自Sigma-Aldrich有限公司;限制性内切酶NdeI和XhoI,T4-DNA连接酶:购自赛默飞世尔科技(中国)有限公司;IPTG和氨苄青霉素:购自生物工程(上海)股份有限公司。
1.2 菌株和培养基
作者所用菌株和质粒均在表1中列出。种子培养基为液体LB,配方为:10 g/L蛋白胨,5 g/L酵母提取物,10 g/L氯化钠。发酵培养基为TB,配方为:12 g/L蛋白胨,24 g/L酵母提取物,5 g/L甘油,17 mmol/L磷酸二氢钾,72 mmol/L磷酸氢二钾。LB固体培养基:10 g/L蛋白胨,5 g/L酵母提取物,10 g/L氯化钠,20 g/L琼脂粉,100μg/mL氨苄青霉素。
1.3 重组质粒的构建及表达
cybC的基因序列扩增自大肠杆菌基因组,pm1的基因序列扩增自质粒(pET20b(+)-pm1),所用引物在表2中列出。PCR产物通过1 g/dL琼脂糖核酸电泳分离,之后通过DNA纯化试剂盒进行纯化。cybC的基因片段和pm1的基因片段通过融合PCR进行融合,融合PCR产物纯化步骤同上。纯化后的融合片段和空质粒pET20b(+)分别用限制性内切酶NdeI和XhoI于37℃处理3 h,之后酶切产物通过DNA纯化试剂盒进行纯化,最后用T4-DNA连接酶进行连接,连接24 h后转化至大肠杆菌感受态细胞BL21(DE3)中。涂布于LB固体平板,挑选单菌落进行菌落PCR验证和测序验证。
将保存在甘油管中的菌液按1%的接种体积分数接种到液体LB培养基中进行种子培养,培养条件为:250 mL三角瓶装液量为25 mL,37℃,12 h,100μg/mL氨苄青霉素。将种子液转接到TB培养基中进行发酵培养,培养条件:250 mL三角瓶装液量25 mL,100μg/mL氨苄青霉,OD600nm值为2.0时,加入终浓度0.04 mmol/L IPTG开始诱导,同时将温度降低至25℃,诱导12 h。菌体通过离心收集(7 000g、4℃、10 min),最终用0.2 mol/L磷酸钠缓冲液(pH 7.0)悬浮,并于4℃条件下保存。细胞干重DCW(g/L)和OD600nm值由如下公式(1)进行换算[17]:


表1 研究中所用菌株和质粒Table 1 Strains and plasmids used in this study

表2 本研究中所用引物Table 2 Primers used in this study
1.4 SDS-PAGE分析蛋白质表达情况
cybC表达情况通过聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分析。样品处理步骤为:用去离子水将细胞稀释至5 g/L,30μL样品与10μL缓冲液(NuPAGETMLDSSample Buffer(4×))混合,之后进行热处理(100℃、15 min)。最后进行凝胶电泳,上样量10μL。结束后用考马斯亮蓝染色,用水洗脱。
1.5 表达细胞色素对催化合成丙酮酸的影响
为研究表达细胞色素对催化合成丙酮酸的影响,我们对大肠杆菌BL21(DE3)-pET20b(+)-pm1和大肠杆菌BL21(DE3)-pET20b(+)-pm1-cybC分别进行发酵培养,诱导时间为6、8、10、12 h及14 h。发酵结束后收集细胞进行催化反应,催化反应按照1.6中优化结果进行。
1.6 pH值及细胞质量浓度优化
催化反应条件为:250 mL摇瓶装液量为20 mL,反应温度为37℃,底物质量浓度为80 g/L D,L-丙氨酸。对于pH值及细胞质量浓度优化,所用菌株为大肠杆菌BL21(DE3)-pET20b(+)-pm1。在pH值优化实验中,细胞质量浓度1.5 g/L,用0.2 mol/L磷酸钠盐缓冲液及0.1 mol/L Tris-HCl缓冲液调节初始pH值,其梯度为6.5、7.0、7.5、8.0、8.5。在细胞质量浓度优化实验中,初始pH值为前面优化结果,细胞质量浓度梯度为0.5、1.5、2.5、3.5、4.5 g/L。
1.7 同源酶晶体结构分析及饱和突变、筛选
从Swiss Model在线网站得到pm1同源性为88.58%晶体模型,该晶体模型来源于Proteus myxofaciens[16]。通过分析该模型活性中心关键氨基酸,选取4个位点对其进行饱和突变。突变建库方法为一步法全质粒扩增,所用引物在表2中列出。用牙签在每个突变点库中随机挑选大概100个单克隆到48孔板进行发酵培养及初筛。每孔装液量为600μL液体LB,37℃孔板摇床培养12 h,之后转接至每孔含有300μL液体TB培养基的48孔板进行发酵培养,转接体积分数为50%,同时加入终浓度0.08 mmol/L IPTG于37℃进行诱导,诱导6 h后发酵结束,离心(4 200g、5 min、4℃)弃上清液。
底物浓度为500 mmol/L L-丙氨酸,溶解到0.2 mol/L磷酸钠缓冲液中(pH值7.0),将50μL底物加入到含有细胞的48孔板中进行催化反应,37℃,30 min后离心,停止反应。通过显色法测量上清液中丙酮酸含量,上清液中丙酮酸产量较高的突变菌株为目标菌株。显色测量方法为:取50μL上清液与50μL 0.1 g/dL 2,4-二硝基苯肼混合,室温放置5 min,最后加入1 mL 1.5 mol/L氢氧化钠溶液,待颜色稳定后吸取200μL液体,在酶标仪中检测其在520 nm下的吸收值。突变、筛选流程如图2所示。

图2 饱和突变及高通量筛选Fig.2 Saturation mutation and high-throughput screening
1.8 膜蛋白提取及其酶学性质分析
用50 mmol/L磷酸钠缓冲液(pH值7.0)使对照组和突变体细胞悬浮,再通过超声将其破碎。将破碎液通过10 000g离心1 h使未破碎细胞和上清液分离,取上清液进行超高速离心(100 000g、1 h),产生沉淀为细胞膜成分,用磷酸钠盐缓冲液将沉淀溶解。通过BCA蛋白质浓度分析试剂盒(TianGen,北京,中国)测量其蛋白质浓度。在酶学性质测量试验中,底物L-丙氨酸浓度为1、10、20、30、40、50、60、70、80、90、100、125、150 mmol/L和200 mmol/L,蛋白质质量为1.5 mg,于37℃条件下进行,30 min后通过显示法检测反应液中丙酮酸浓度。Km值和Vmax值通过如下公式(2)进行计算:

V表示反应速率(丙酮酸生成量;μmol/min),Vmax表示最大反应速率,Km表示米式常数(mmol/L),cs表示底物L-丙氨酸浓度。
1.9 丙酮酸、丙氨酸及FAD含量分析
采用高效液相色谱法(HPLC)检测丙酮酸含量。取0.2 mL离心后的反应上清液,稀释一定倍数后用0.22μm孔径滤膜过滤,滤液即为待测样品。色谱柱为:Agilent 1260型高效液相色谱仪,伯乐Aminex PHX-87H色谱柱(300 mm×7.8 mm,9μm),流动相为5 mmol/L稀硫酸,进样量10μL,流量为0.6 mL/min,紫外检测波长210 nm,柱温40℃,洗脱时间15 min。
细胞内辅酶FAD浓度通过FAD分析试剂盒(Sigma–Aldrich)测定[18]。将细胞从反应体系中离心取出,用水洗涤一遍,离心后用FAD分析试剂缓冲液使之悬浮,14 000g离心10 min,去除不容物质。通过使用高氯酸(8 g/dL)使FAD从蛋白质中释放出来。反应体系含92μL FAD分析缓冲液,4μL荧光过氧化物酶,4μL FAD酶混合物,50μL待测样品。通过加入反应终止试剂终止反应,最后检测其在570 nm下的吸光值。
采用临苯二甲醛-氯甲酸芴基甲酯(OPAFMOC)柱前衍生反相高效液相色谱法来测定样品中的丙氨酸含量。将转化液上清部分稀释合适倍数,用0.45μm孔径滤膜过滤,滤液即为待测样品。色谱条件为:Agilent 1260型高效液相色谱仪,依利特Hypersil ODS2色谱柱(250 mm×4.6 mm,5μm),使用流动相A和流动相B,进样量10μL,流量为1.0 mL/min,紫外检测波长为338 nm,柱温40℃,采用梯度洗脱,洗脱时间38 min,梯度洗脱表见表3。
2 结果与分析
2.1 表达cybC与pm1
细胞色素b562是大肠杆菌有氧呼吸链上的一种氧化酶。在电子传递链中,它将2个H原子从FADH2传递给氧气[19-20]。本研究中,作者在大肠杆菌中共表达cybC与pm1,之后验证表达细胞色素b562后对菌株的生长影响,结果见图3,表达该细胞色素后会降低宿主的生长速率,原因可能是过量表达该细胞色素对宿主细胞膜通透性影响较大。为验证细胞色素b562的表达情况,我们将样品按照1.4中的方法处理后,通过聚丙烯酰胺凝胶电泳进行分析,其结果见图4。

表3 丙氨酸分析梯度洗脱表Table 3 Gradient elution of alanine analysis

图3 表达cybC对宿主生长的影响Fig.3 Effects of cybC expression on the growth of host cells
最后,作者研究表达细胞色素对催化合成丙酮酸的影响。结果见图5(a)、(b)所示,细胞色素并不会影响最适诱导时间,2株菌最适诱导时间在12~14 h左右,最终丙酮酸产量相差不大。然而,表达细胞色素后,见图5(a),催化合成丙酮酸的速率较对照菌高,同时胞内FAD的含量也较对照菌高。因此作者推测,表达细胞色素b562能提高FAD合成速率,从而提高丙酮酸合成速率。

图4 蛋白电泳分析Fig.4 Whole-cell SDS-PAGE analysis

图5 表达细胞色素对催化合成丙酮酸影响Fig.5 Effects of cybC expression on pyruvate production
2.2 最适pH值及细胞浓度
pH值对酶的功能影响较大,为此,作者研究了不同pH值对催化反应的影响。如图6(a)所示,pH值为7.0时,丙酮酸最高产量为17.10 g/L。过高的pH值对丙酮酸积累不利,原因之一是过高pH值使酶的活性损失比较大,导致最终产量降低。同时,我们在催化过程中各时间点取样测量其pH值,发现pH值基本可以保持稳定,这说明随着催化进行,缓冲液可以维持pH值稳定,使酶可以持续发挥催化能力。

图6 最适pH值及细胞质量浓度Fig.6 Optimal pH and cell density
催化体系中酶的量直接由加入的细胞量决定。为此,作者研究了不同细胞量对酶催化的影响。结果如图6(b)所示,细胞质量浓度为1.5 g/L时,产量达到最高为17.15 g/L,然而细胞质量浓度更高时,产量反而降低。为此,作者进一步设计实验,验证细胞对丙氨酸和丙酮酸的消耗情况,结果见图6(c)、(d)。该结果表明在催化过程中细胞会消耗一定量的丙酮酸,但几乎不消耗丙氨酸。本实验结果证明了利用大肠杆菌发酵生产丙酮酸时,弱化或消除这类消耗丙酮酸的途径的必要性[21-22]。因此,作者选择细胞质量浓度为1.5 g/L作为催化反应的条件,产量为17.15 g/L,转化率达42.75%。同时,作者在催化过程中各时间点取样检测细胞质量浓度、丙酮酸及丙氨酸含量。其结果如图7所示,细胞质量浓度在催化过程中会降低,可能是由于在高离子浓度的溶液中细胞破裂导致的。催化结束,丙氨酸与丙酮酸的总量为65 g/L,与初始底物80 g/L有一定的差值,根据作者所在实验室之前的结论,这部分差值是细胞消耗丙酮酸导致的。
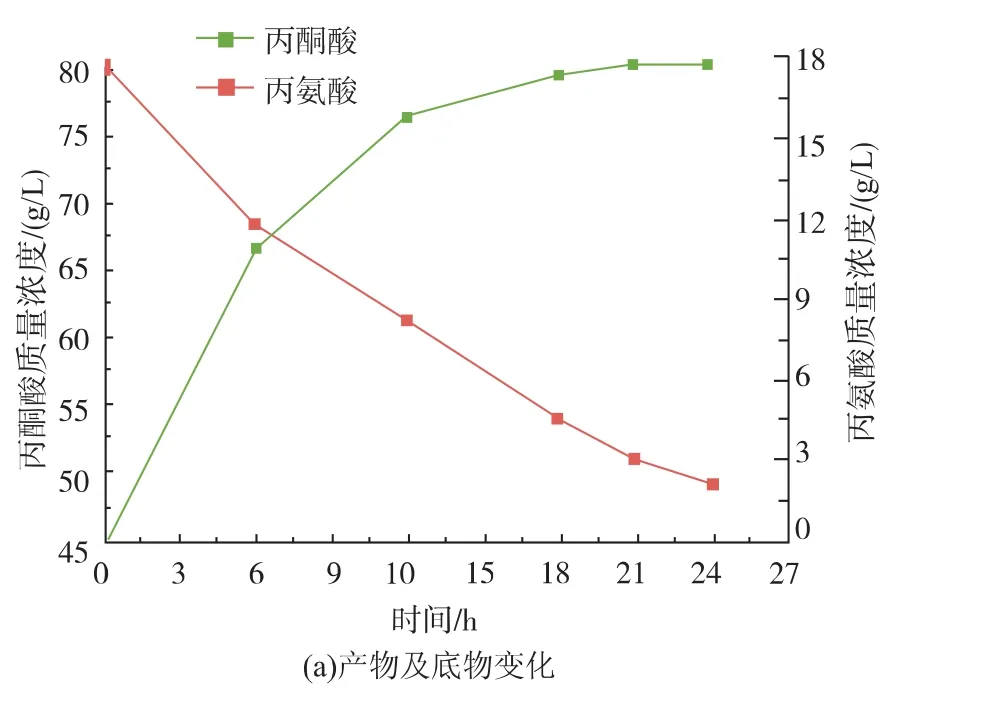
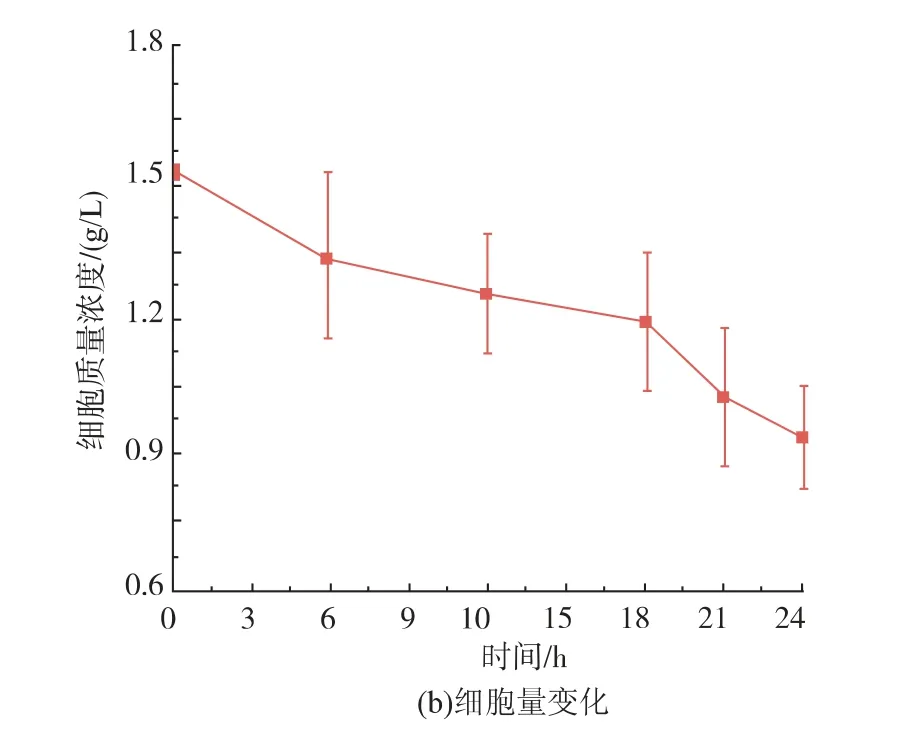
图7 催化过程中底物、产物及细胞量变化Fig.7 Changes of substrate concentration,product concentration and cell density during the biocatalyst process
2.3 pm1突变体对合成丙酮酸的影响及其酶学性质分析
饱和突变是研究蛋白酶的结构与功能关系的一种非常有用的手段。该技术可以确定每个位点最适合的氨基酸[23]。然而,选择合适的位点进行饱和突变至关重要。本研究中,作者通过分析同源酶晶体结构,见图8(a),寻找合适的位点进行饱和突变。如图8(b)所示,FAD位于底物口袋中心,选择周围4个关键位点(279、341、418和438)作为饱和突变的位点。经过一轮筛选,从279、418和438位点突变库中各筛选出丙酮酸产量较对照菌有提高的菌株。经过测序验证,它们分别是L279I、E418A和V438I。在341位点突变库中,并没有获得较好的突变菌株,这说明谷氨酸是341位点最合理的氨基酸。之后作者验证了这3株菌催化生产丙酮酸的能力,其结果见图9,三突变体L279I/V438I/E418A丙酮酸产量最大,为25.58 g/L,相比对照菌17.69 g/L,提高44.6%。
最后作者对L-氨基酸脱氨酶突变体及野生型进行酶学性质检测及分析。如表4所示,突变体E418A对提高底物亲和性较明显,Km值由(42.75±0.51)mmol/L降低至(30.28±0.67)mmol/L。如图8(c)所示,418位点位于丙酮酸离开活性中心的路径[9],将该位点的谷氨酸替换成丙氨酸后,其侧链长度降低,使得丙氨酸更容易离开活性中心。突变体L279I和V438I,其Km值相对于野生型变化不大,Kcat值相比野生型提高1.75和1.60倍。如图8(d)所示,279和438位点分别位于L-氨基酸脱氨酶底物口袋内,该两个位点替换成异亮氨酸后,能增加底物口袋内的疏水性,从而提高其对底物的催化能力。

图8 L-氨基酸脱氨酶同源模型晶体结构及关键氨基酸位点Fig.8 L-amino acid deaminase crystal structure and key residues inside the substrate-binding pocket

图9 不同突变菌株催化合成丙酮酸产量Fig.9 Pyruvate concentration of different mutant strains
3 结语
作者通过表达pm1伴侣蛋白(细胞色素b562)及应用饱和突变技术对pm1进行分子改造这两种策略来提高生物转化法合成丙酮酸的能力。通过表达细胞色素b562使催化反应周期减少6 h左右,但不利于发酵过程中细胞量的积累,对于工业化应用具有一定的缺点。
分子改造采用的筛选方案为:催化反应一定时间,通过显色法检测丙酮酸含量的高低来衡量突变体的催化能力。该方法能高效检测出催化速率较高的突变体。然而,实际过程中,产物对酶的抑制是一个对丙酮酸最终产量有较大影响的因素,筛选出产物抑制能力较弱的突变体对提高丙酮酸产量至关重要。由于在反应过程中细胞会消耗一定量的产物,故通过该筛选方案不能准确的筛选出产物抑制能力较弱的突变体。未来的研究中,期望寻找一种能快速检测底物丙氨酸剩余量的方法,建立更加准确的筛选方案。

表4 对照菌及突变菌酶学性质Table 4 Comparison of kinetic parameters of the wild type pm1 and its mutants
此外,由于细胞在催化过程中会消耗一定量的丙酮酸,不利于产物的积累。因此,在之后的研究中,可以通过基因敲除技术和宿主诱变来弱化细胞对丙酮酸的消耗,期望获得一株消耗丙酮酸较弱的宿主。
