小鼠出生后早期心脏成纤维细胞数量及性状变化研究
2021-06-17刘维静王玉瑶
刘维静,聂 宇,廉 虹*,王玉瑶*
(1.山西医科大学基础医学院生物化学与分子生物学教研室,太原 030001; 2.中国医学科学院北京协和医学院国家心血管病中心阜外医院心血管疾病国家重点实验室,北京 100037)
心血管疾病(心肌梗死、心衰等)最终的结局均会导致心肌细胞的丢失,大量研究表明,成年哺乳动物心肌细胞处于终末期分化状态而不能通过有丝分裂进行增殖,再生能力非常有限[1-2]。 因此,心肌再生的机制研究一直是心血管疾病领域的研究热点。 小鼠是心血管疾病领域研究中使用最为广泛的哺乳动物模型之一[3]。 2011 年,Porrello 课题组在新生小鼠出生后第1 天切除约15%的心尖部分,21 天后心脏可以完全再生,但在出生后第7 天进行心尖切除后心脏却失去再生能力,只能出现疤痕修复[4]。 1 d 和7 d 心脏组织再生能力改变的原因一直是近年来研究的热点[5-7]。 心脏成纤维细胞占整个心脏组织的50%以上,在心脏中起到分泌胶原和生长因子等作用,是构成细胞外基质的一类重要细胞类型,在维持心脏结构和功能中发挥重要作用[8]。 近年研究表明,心脏成纤维细胞在心肌再生领域中发挥了重要作用[9-11]。 本文通过比较小鼠出生后1 d 和7 d 的心脏组织中成纤维细胞数量的变化以及对这两个时间点的成纤维细胞标志蛋白在转录水平的分析,探究了小鼠出生1 d 和7 d 心肌成纤维细胞的比例和性状变化,为研究心肌成纤维细胞在再生领域的研究提供基础性研究数据。
1 材料和方法
1.1 实验动物
80 只出生 1 d(1.2 ~1.5 g,误差小于 10%)和60 只出生7 d(4.5 ~4.8 g,误差小于 10%)的 SPF级别C57BL/6 J 小鼠购买自北京维通利华实验动物技术有限公司[SCXK(京)2016-0011],不区分雌雄。 小鼠的模型制作以及取材均在中国医学科学院阜外医院国家心血管病中心E 座屏障设施内进行[SYXK(京)2017-0015]。 动物实验中涉及的动物所有操作程序符合3R 原则,已得到中国医学科学院阜外医院实验动物管理和使用委员会的批准(FW-2019-0005)。
1.2 主要试剂与仪器
BD Aria II 流式细胞仪(FACSAria 2,美国);体式显微镜(Zeiss,德国);全自动组织脱水机(Leica,德国);展片机(Leica,德国);烤片机(Leica,德国);荧光共聚焦显微镜(Zeiss,德国);全自动扫片机(Zeiss,德国);普通 PCR 仪(Bio-Rad,美国);实时荧光定量 PCR 仪(Bio-Rad,美国);DMEM(Gibco,美国);胎牛血清(Gibco,美国);含 EDTA 的胰酶(Gibco,美国);Masson 染色试剂盒(Sigma);antisarcomeric alpha actinin (1 ∶200,ab9465,Abcam,英国),anti-Vimentin (1 ∶100,ab92547,Abcam,英国);Neonatal Heart Dissociation Kit(Miltenyi 公司, 德国);Gentle MACS Octo Dissociator 仪器(Miltenyi 公司,德国);Neonatal Cardiac Fibroblast Isolation Kit(Miltenyi 公 司, 德 国);SYBR Green qPCR Master Mix(A25742,美国 Applied Biosystems)。
1.3 实验方法
1.3.1 流式细胞分选
流式细胞仪对细胞进行自动分析和分选,检测悬浮在液体中的单个分散细胞以及其它微粒信号,一般先将待测样本荧光染色后制备为悬液标本,在周围气体压力下待测样本流入流动室,鞘液从鞘液管中流出,包裹着待测样本高速流动,形成鞘流,待测细胞分开为单个细胞依次通过检测区域,达到细胞分选的目的[12]。
(1)样本制备
①小鼠心脏的获取
出生1 d 的小鼠40 只,出生7 d 的小鼠20 只,使用75%乙醇对小鼠进行消毒,快速取出心脏,剪掉连带血管组织,PBS 冲洗3 次,将心脏中血液冲洗干净备用,此过程在冰上操作。
②剪碎,消化心脏组织,收集细胞
将取出的心脏组织置于10 cm 直径的培养皿中,剪碎至大约每小块1 mm3,置于带有自制转子的三角烧瓶中,加入10 mL 0.08%的胰酶的消化液,放入磁力搅拌的水浴锅中,调节温度30℃,消化 8 min,弃掉上清(首次消化除去血细胞)。 继续加入10 mL 0.08%的胰酶进行消化8 min,吸取上清经40 μm 的筛子过滤后,置于 10 mL 含 10% FBS 的DMEM 中,此过程重复操作7 ~8 次后,组织块成絮状,说明细胞基本无残留,终止消化过程,将收集到的细胞悬液,室温 1200 r/min,5 min 离心,收集细胞。
(2)细胞分选
①制备上机悬液
将收集好的细胞使用PBS 冲洗一次,1×106细胞量为一个反应,成纤维细胞表面标志物Thy1-APC抗体以1 ∶100 的比例稀释,同时做好阴性对照和同型对照(Isotype control)。 混匀后冰浴 30 min,后1200 r/min,5 min 离心,弃上清,再次使用PBS 清洗一次,最后40 μm 细胞过滤筛子过滤至流式管中,待上机。
②流式上机分选
细胞悬液上机前5 min 加入活性染料7-AAD,混匀,上机,收集分选后的心肌成纤维细胞,分选结束后,将分选出的阳性细胞管进行回测实验,验证细胞纯度。 所有流式细胞术均在BD Aria II 流式细胞仪上进行,分选目的细胞的电压分别为,FSC: 100 V, SSC: 250 V, APC: 181 V。
1.3.2 心尖切除
出生1 d 和7 d 的小鼠分别埋于碎冰中冰冻麻醉2 min 和5 min,医用胶带将小鼠四肢固定在预冷的微型金属手术台上,将其置于体式显微镜下,75%乙醇对小鼠胸前皮肤进行消毒。 用显微剪于小鼠第4~5 肋间隙剪开长约1 cm 的切口,随后利用眼科镊撑开胸腔,轻轻撕掉心包膜,采用显微镊在切口外端轻微按压挤出心脏,之后使用虹膜剪剪去心脏部分左心室心肌组织,左心室轻微渗血即可,随后将心脏送回胸腔。 8-0 涤纶线缝合小鼠皮肤后,将小鼠置于37℃恒温台数分钟,待小鼠完全恢复呼吸、活动自由后放回母鼠笼中。
1.3.3 组织学检测
对出生1 d 和7 d 的小鼠分别进行心尖切除(AR, Apical resection),术后21 d 取完整心脏,4%多聚甲醛固定48 h,脱水后进行石蜡包埋,以5 μm的厚度切片。 按照之前研究操作[13],将石蜡切片放在烤片机上68℃烘烤45 min 防止脱片,随后将玻片依次放入二甲苯Ⅰ、Ⅱ各10 min,100%、95%、80%、75%、50%梯度乙醇中各5 min 进行脱蜡、水化,之后在重铬酸钾中过夜,使用Masson 染色试剂盒进行染色,根据Masson 染色方法,苯胺蓝染液将胶原纤维染为蓝色即为组织纤维化。 若心尖处无蓝色纤维化组织则可视作心脏完全再生,若心尖处存在纤维化组织则为心脏不完全再生,再生率是指术后完全再生小鼠只数占所有手术小鼠只数百之比。 对于HE 染色,则需将玻片在烤片机上68℃烘烤45 min后直接进行染色。
1.3.4 免疫荧光染色
取1 d 和7 d 小鼠完整心脏,4%多聚甲醛固定24 h,脱水后进行石蜡包埋,以5 μm 的厚度切片。根据之前研究[13],脱蜡水化之后使用EDTA 修复法高温修复2 min,使用含Triton-X 100 的山羊血清封闭液封闭1 h,在4℃孵育一抗过夜:anti-sarcomeric alpha actinin (1 ∶200; ab9465, Abcam, UK),anti-Vimentin (1 ∶100; ab92547, Abcam, UK)。 室温复温1 h,使用PBS 将玻片洗涤5 次,每次5 min,在室温与荧光标记二抗避光孵育1 h,PBS 洗涤玻片5次,每次5 min,然后使用含DAPI 的封片剂封片。我们使用蔡司LSM800 共聚焦激光扫描显微镜(Carl Zeiss, Inc., Jena, Germany)检测荧光强度。
1.3.5 心脏组织成纤维细胞分离
取1 d 和7 d 小鼠完整心脏各20 只,剪掉血管连带组织,在PBS 缓冲液中冲洗3 遍,放入含有酶液(含酶 A:12.5 μL、酶 P:62.5 μL、酶 D: 100 μL、缓冲液 Y:25 μL、缓冲液 X:2300 μL)的 C 管中,利用Neonatal Heart Dissociation Kit 及 Gentle MACS Octo Dissociator 仪器消化心脏;消化结束后立即用含10% 胎牛血清(FBS)的DMEM 终止消化,70 μm滤网过滤,1000 r/min 离心5 min,弃上清,使用红细胞裂解液裂解红细胞,3 min 后使用PBS 缓冲液终止裂解,1000 r/min 离心5 min;使用含有稳定剂和0.05%叠氮化钠的缓冲液重悬,30 μm 滤网过滤,使用Count Star 进行细胞计数,按照5×106细胞量为一个体系,使用Neonatal Cardiac Fibroblast Isolation Kit 分离成纤维细胞。
1.3.6 qRT-PCR
使用TRIzol 试剂(Invitrogen)提取分离的心脏成纤维细胞中的 RNA,然后使用 PrimeScript RT Master Mix(TaKaRa,RR036A)将其转化为 cDNA。使用SYBR Green qPCR Master Mix 进行qRT-PCR,并在Vii7 Real-Time PCR System 上扩增,扩增条件为95℃预变性2 min,后95℃运行15 s 进行变性,60℃运行15 s 进行退火,72℃运行1 min 进行延伸,变性、退火、延伸过程共进行40 个循环。 下面列出了 该 反 应 的 所 有 引 物。Thy1 正 向: 5′-GGAACTCTTGGCACCATGAAC-3′, 反 向: 5′-TTATTCTCATGGCGGCAGTC-3′;Fsp-1 正 向: 5′-GGAGGCCCTGGATGTAATTGTG - 3′, 反 向: 5′-CAACTTCATTGTCCCTGTTGCTG-3′;Periostin正向:5′-ACTGAATGCCTTACACAGCCACA-3′, 反 向:5′-TCGAGCACAGTTCACAGTGACAA-3′;Pdgfα正向:5′-GGCAGGCACATTTACATCTATG - 3′, 反 向: 5′-CATCCTCTTCCACGATGACTAA-3′;Col1a1 正向:5′-TGAACGTGGTGTACAAGGTC-3′, 反 向: 5′-CCATCTTTACCAGGAGAACCAT-3′;Tcf21 正 向:5′-GCGATGTAGAAGACCTTCAAGA - 3′, 反 向: 5′-GAAGTTCCAAACTCCTTGTTGG-3′;Gapdh正向:5′-GCAGTGGCAAAGTGGAGAATTG - 3′, 反 向: 5′-AGAGATGATGACCCTTTTGGCTCC-3′。
1.4 统计学方法
使用 GraphPad Prism(7.0 版,GraphPad 软件)分析所有结果。 所有数据均表示为平均数±标准差()。 组间差异通过未配对的t检验进行评估。显著性水平由Prism 软件得出,*P<0.05 被认为是有统计学差异。
2 结果
2.1 小鼠出生1 d 和7 d 心脏组织的变化
按照之前报道的心尖切除操作方法[14],我们对出生1 d 和出生 7 d 的小鼠分别进行了 AR(图1A),石蜡切片进行HE 染色观察切口处病理结构(图1B),与之前研究相一致,术后21 d 发现出生1 d 进行 AR 的小鼠可以完全再生(再生率为87.67%),而出生7 d 进行 AR 的小鼠术后21 d 无法再生(再生率为0)(图1C、1D)。 为了解小鼠出生后7 d 心脏组织的变化情况,我们分别取1 d 和7 d 小鼠完整心脏,称取小鼠心脏湿重,同时对两个时间点小鼠心脏进行拍照比较小鼠心脏大小(图1E),石蜡切片进行HE 染色观察其病理结构(图1F),发现小鼠出生后7 d 心脏组织平均比1 d 心脏湿重重 13.13 mg(3.11 倍)(1 d:(6.22 ± 0.19),7 d:(19.35 ± 0.56),P< 0.0001;n=6)(图 1G)。 心脏成纤维细胞免疫荧光染色证明,7 d 心脏成纤维细胞数量明显高于1 d 心脏(图1H、1I)。 以上结果说明,小鼠出生早期心脏体积随着心脏发育增大的同时,心脏成纤维细胞数量也随之增加。
2.2 流式细胞术分选心脏成纤维细胞
2.2.1 流式细胞术分选心脏成纤维细胞的圈门策略
为了分析小鼠出生后7 d 心脏成纤维细胞数量的变化情况,我们使用成纤维细胞表面标志蛋白Thy1 标记出生1 d 和7 d 的小鼠心肌成纤维细胞,通过流式细胞术进行细胞分选。 首先,我们通过正向散射(FSC)和侧向散射(SSC)散点图,去除细胞碎片以及黏连细胞圈出P1 门(图2A),P1 门中的细胞开展后续分析。 为了避免背景荧光及自发荧光的影响,收集分离后未染色的细胞作为空白对照(Blank,图2B);收集加入无荧光染料的单个抗体的细胞作为同型对照(图2C),以此判断抗原抗体的特异性结合;使用APC 标记抗体收集所有APC+细胞(图 2D),最后,加入活性染料 7-AAD,收集APC+、7-AAD-的所有细胞即为Thy1+的活的心肌成纤维细胞,即为Q4(图2E),收集Q4 门中的所有细胞,收集5000 个细胞后记录阳性细胞占总细胞的比例。

图1 小鼠出生1 d 和7 d 心脏组织的变化Note, A, Apical resection was performed on day 1 and day 7 mice respectively, the heart was photographed immediately. B,Apical resection was performed on day 1 and day 7 mice respectively, the heart section of the mouse was stained with HE. C, Apical resection was performed on day 1 and day 7 mice respectively,and Masson staining was performed at 21 days after the operation. D,Apical resection was performed on day 1 and day 7 mice,and regeneration rate was counted at 21 day after operation. E,The whole heart of the mouse was photographed on day 1 and day 7. F, The heart section of the mouse was stained with HE on day 1 and day 7. G, The heart weight of the mouse was compared on day 1 and day 7. H,Cardiomyocytes and fibroblasts co-stained in 1 day and 7 days of mouse heart sections. I,Immunofluorescence staining of fibroblasts in 1 day and 7 days of mouse heart sections.Figure 1 Changes of heart tissue in mice on day 1 and day 7
2.2.2 小鼠出生1 d 和7 d 心肌成纤维细胞比例变化的比较
为明确小鼠出生1 d 和7 d 心脏成纤维细胞的比例变化,我们在分选的同时对心脏组织中成纤维细胞所占比例进行了统计。 按图1 所示,收集Q4门中细胞,收集5000 个细胞后记录阳性细胞占总细胞的比例,我们共进行了3 次重复实验,出生后1 d小鼠的心脏组织细胞中,Thy1+细胞所占比例分别为6.9%、7.6%、8.7%,7 d 的小鼠心脏组织细胞中,Thy1+细胞所占比例分别为9.5%、11.8%、10.4%,因此,小鼠出生后7 d 心脏组织中心肌成纤维细胞占总细胞比例比出生后1 d 时高2.9%(1.38 倍)(1 d: (7.7 ± 0.74),7 d: (10.6 ± 0.95)),P=0.029,t=3.334,差异具有统计学意义(表1)。
2.3 小鼠出生1 d 和7 d 心脏组织中成纤维细胞蛋白标志物的表达变化比较
小鼠出生后7 d 心脏组织中成纤维细胞比例明显高于出生后1 d 小鼠心脏组织。 为了验证成纤维细胞在小鼠出生后的性状变化,我们分别分离了1 d和7 d 的心脏成纤维细胞,通过qRT-PCR 检测心脏组织中成纤维细胞标志蛋白Thy1、Fsp-1、Periostin、Pdgfrα、Col1a1、Tcf21 在转录水平上的表达变化。以出生1 d 小鼠心脏成纤维细胞中标志蛋白的转录水平表达为对照,比较分析出生后7 d 小鼠心脏成纤维细胞中标志蛋白Thy1、Fsp-1、Periostin、Pdgfrα、Col1a1、Tcf21 的表达,反映心脏中成纤维细胞的性状变化。 结果显示,与出生后1 d 相比,出生后7 d心脏成纤维细胞中Thy1、Fsp-1、Periostin的表达显著高于1 d 成纤维细胞(Thy1: 1 d: (1.01± 0.12),7 d: (2.71 ± 0.27),P=0.0288;Fsp-1: 1 d: (1.04± 0.27),7 d: (5.28 ± 0.10),P=0.0046;Periostin:1 d: (0.91 ± 0.01),7 d: (1.13 ± 0.05),P=0.0119;n=3)(图 3A、3B、3C);而Pdgfrα、Col1a1、Tcf21 的表达显著低于1 d 成纤维细胞(Pdgfrα: 1 d: (1.09 ± 0.04),7 d: (0.62 ± 0.01),P=0.0068;Col1a1: 1 d: (1.00 ± 0.09),7 d: (0.57 ± 0.02),P=0.0433;Tcf21: 1 d: (1.00 ± 0.03),7 d: (0.54± 0.02),P=0.0054;n=3)(图 3D、3E、3F),由此证明小鼠出生后1 d 到7 d 心脏中成纤维细胞性状发生了改变。
综上我们发现:小鼠出生早期(1 ~7 d)心脏成纤维比例不断增加的同时,成纤维细胞的性状也发生了改变,为心脏再生机制研究提供一定的线索。
3 讨论
成纤维细胞起源于胚胎时期的间充质干细胞,广泛分布于心脏、肾、肝、皮肤等器官间质中,其细胞体积大且形态多样多变,随外界微环境改变而改变[15-16]。 心脏成纤维细胞是心脏的主要组成细胞,占整个心脏组织总细胞的50%以上[12,17-18],在心脏中发挥维持心脏结构和功能的作用。 本研究主要针对小鼠出生1 d 和7 d 两个时间点成纤维细胞的数量及性状的变化情况,发现小鼠出生后7 d 心脏组织中成纤维细胞比例明显高于出生后1 d 小鼠心脏组织;在成纤维细胞转录水平,成纤维细胞标志物Thy1、Fsp-1、Periostin在小鼠出生后 7 d 表达高于出生后 1 d 的成纤维细胞,而Pdgfrα、Col1a1、Tcf21三种成纤维细胞标志蛋白表达则低于出生后1 d 的小鼠心脏中的成纤维细胞,提示在小鼠出生后7 d心脏组织中成纤维细胞性状发生了变化。

表1 小鼠出生后1 d 和7 d 心肌成纤维细胞比例变化比较Table 1 Comparison of the ratio of cardiac fibroblasts in mouse at 1 day and 7 days after birth

图2 流式细胞术分选心脏成纤维细胞的圈门方法Note, A, All cells were collected without cell debris and adhesion cells. B, Unstained cells were collected as blank control. C, Cell labeled with single antibody without fluorescent dyes were collected as isotype controls. D, The APC+ cells among total cells were collected. E, The APC+,7-ADD- cells among total cells were collected.Figure 2 The ring gate method of sorting cardiac fibroblasts by flow cytometry
成纤维细胞具有强大的多向分化潜能[19-20],增殖能力强且代谢旺盛,可体外培养、多次传代[21-22]。在未受伤的成年心脏中,成纤维细胞主要作用于营养因子的分泌、ECM 监测、传导系统绝缘、心肌细胞电偶联和血管维护;在损伤的心脏中,成纤维细胞增殖,沉积ECM,招募炎症细胞,是体外机制探索的重要细胞类型[23]。 成年哺乳动物心脏受损后丧失心肌细胞增殖能力导致无法进行有意义的自我恢复[1-2],2011 年,Porrello 研究组发现新生小鼠出生后1 d 切除约15%的心尖部分,21 d 后心脏可以完全再生,但在出生后第7 d 进行心尖切除后只能出现疤痕修复[4],其中的原理机制尚不清楚,但是小鼠出生后7 d 成为心脏组织是否可以再生的时间转折点是确定的。 有研究表明,心脏中成纤维细胞可以重编程为心肌细胞,2010 年leda 等[24]将小鼠心肌成纤维细胞直接重编程为心肌样细胞,首次报道了成纤维细胞向心肌细胞的直接重编程。 近几年,Qian 等[10]、Song[25]等在小鼠心肌梗死部位注射GHMT(Gata4、Hand2、Mef2c、Tbx5)也可引起心脏成纤维细胞重编程为心肌细胞,为再生医学研究奠定了扎实基础。
心脏成纤维细胞异质性很强,没有特异性表达的标志蛋白,在发育过程的不同阶段成纤维细胞表达的蛋白发生变化,因此,目前研究者通常使用多种标志蛋白组合标记的方法对成纤维细胞进行标识。Thy1 是目前为止研究最为详细的一种细胞表面糖蛋白,在所有成纤维细胞中均表达,该糖蛋白通过糖基磷脂酰肌醇部分固定在细胞表面,编码的蛋白经过进一步的处理,生成成熟的蛋白,介导细胞与细胞的相互作用,从而触发下游信号通路,参与细胞增殖、细胞凋亡等过程[26-27];Fsp-1 为成纤维细胞分泌因子,在体外培养的成纤维细胞中高度表达,对维持细胞生物学功能起着重要作用[28-29];Periostin是肌成纤维细胞分泌的细胞外基质中的非结构性基质蛋白,在正常心脏中几乎不表达,但是在受损的心脏中高度表达,是一种相对较新的潜在标志物,可用于鉴定心肌成纤维细胞,促进肌成纤维细胞的募集并增加胶原蛋白的产生[30]。Col1a1是Ⅰ型胶原的主要成分,可用于鉴定心脏成纤维细胞,并与pdgfrα共同表达[31];pdgfrα是酪氨酸蛋白激酶家族成员,具有促进细胞趋化分裂增殖、细胞趋化、血管收缩及参与组织器官的生成分化等生物效应;Tcf21 在心脏成纤维细胞中表达,与其他标志物一起鉴别心脏成纤维细胞[32]。 我们的结果显示,小鼠出生后7 d 成纤维细胞占整个心脏组织的比例较出生后1 d 心脏组织升高了2.9%,成纤维细胞的标志物Thy1、Fsp-1、Periostin、Pdgfrα、Col1a1、Tcf21表达水平也发生了显著改变,提示此过程中成纤维细胞细胞性状发生了一定程度的改变,可能与小鼠出生7 d 后再生能力丢失相关,进一步探讨小鼠出生7 d 心脏成纤维细胞的变化与心肌再生关系和机制,有可能为寻找出心肌再生关键的靶点提供新的研究方向。
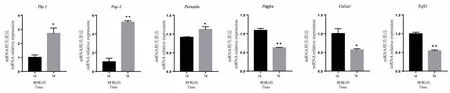
图3 小鼠出生1 d 和7 d 心脏成纤维细胞标志的变化Note.Compared with 1 day group, *P<0.05,**P<0.01.Figure 3 Changes of cardiac fibroblast markers in mouse at 1 day and 7 days after birth
随着科学界对心肌成纤维细胞功能的不断深入研究,发现心肌成纤维细胞在心脏生理及病理条件下的作用越来越重要,成为心血管领域的重要研究对象。 本研究主要着眼于小鼠出生后1 d 和出生后7 d 心脏成纤维细胞的数量和心脏成纤维细胞中标志物的表达分析,为心肌再生领域的研究提供一定的实验数据和理论线索。
