术前血小板/淋巴细胞比值和淋巴细胞/单核细胞比值对胃癌患者预后的影响分析*
2021-06-17刘海鹏
郭 梁,陈 康,刘海鹏,陈 晓
兰州大学第二医院普外三科,甘肃兰州 730000
胃癌全球每年新发病例超过100万,是导致癌症相关死亡的第3大原因[1]。目前临床以外科手术、放化疗为主的治疗可有效改善患者转归,但整体预后不佳,5年生存率仅为30%~50%[2]。因此,寻找便捷有效的预后指标辅助胃癌患者预后预测十分必要。炎症微环境甚至已被提出作为癌症的第7个影响因素[2-3]。中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、淋巴细胞与单核细胞比值(LMR)等反映全身性炎性反应的血常规指标,在肿瘤临床诊断预测和预后评估中得到广泛关注。治疗前NLR可作为胃癌、结直肠癌、肺癌等多种恶性肿瘤的独立预后因子[4-6],但目前关于PLR、LMR对胃癌的预后评估的研究较少。本研究旨在探讨术前外周血PLR和LMR与胃癌患者临床病理特征及预后的相关性,评估其对胃癌预后的预测效能。
1 资料与方法
1.1一般资料 选取2013年1月至2014年7月兰州大学第二医院普外科住院行胃癌根治术的患者565例作为研究对象。纳入标准:(1)术前胃恶性肿瘤诊断明确且无其他肿瘤病史;(2)术后组织病理学诊断为胃癌;(3)术后行规律辅助化疗;(4)近期无其他脏器感染影响血象指标;(5)近期无输血史;(6)术前未接受放化疗。排除标准:(1)临床病理学诊断资料不全者;(2)围术期死亡者;(3)无随访资料、随访资料不全或失访者。最终符合标准纳入研究的胃癌患者共458例。
1.2研究方法 收集患者临床资料,包括性别、年龄、肿瘤最大径、肿瘤位置、淋巴结转移、肿瘤分化程度、脉管浸润、神经浸润、TNM分期[根据国际抗癌联盟/美国癌症联合会(UICC/AJCC)第八版胃癌TNM分期标准评定]等。收集术前1周内血常规指标,包括淋巴细胞计数、血小板计数、单核细胞计数,计算PLR、LMR。通过门诊复查、住院或电话随访等方式随访获取患者生存资料,术后2年内每3个月至半年随访1次,2年后每年随访1次。生存结局事件为胃癌相关死亡,总体生存期(OS)定义为手术当天至死亡日期或随访截止日期,单位为个月。截至最后随访日期(2019年7月)。所有患者随访时间为10~76个月,中位随访时间29个月。
1.3统计学处理 应用Excel2016和SPSS22.0软件对数据进行整理和统计分析。计数资料以频数、率表示,组间比较采用χ2检验。根据受试者工作特征曲线(ROC曲线)、ROC曲线下面积(AUC)和约登指数(灵敏度+特异度-1)最大原则确定PLR和LMR的最佳临界值。采用Kaplan-Meier法计算生存率,采用Log-rank检验组间生存率显著性,采用单因素和多因素Cox比例风险回归模型分析胃癌的预后影响因素。以P<0.05为差异有统计学意义。
2 结 果
2.1PLR、LMR最佳临界值的确定 分别绘制PLR、LMR预测胃癌预后的ROC曲线显示,当PLR最佳临界值为126时,约登指数最大为0.195 8,此时PLR预测胃癌预后的AUC为0.570(95%CI:0.523~0.616),灵敏度为55.65%,特异度为63.93%;当LMR最佳临界值为4.59时,约登指数最大为0.217 6,此时LMR预测胃癌预后的AUC为0.619(95%CI:0.573~0.664),灵敏度为54.55%,特异度为67.21%。见图1、图2。

图2 LMR预测胃癌预后的ROC曲线
2.2不同PLR、LMR胃癌患者临床病理特征比较 根据PLR、LMR的最佳临界值,将458例胃癌患者分为高PLR组(PLR>126)、低PLR组(PLR≤126),高LMR组(LMR>4.59)、低LMR组(LMR≤4.59)。高PLR组、低PLR组在性别、肿瘤最大径、淋巴结转移、T分期、N分期、TNM分期及脉管浸润方面比较,差异均有统计学意义(P<0.05),在年龄、肿瘤位置、肿瘤分化程度和神经浸润方面比较,差异均无统计学意义(P>0.05);而高LMR组、低LMR组仅在年龄、性别、肿瘤最大径方面比较,差异有统计学意义(P<0.05),在肿瘤位置、淋巴结转移、T分期、N分期、TNM分期、肿瘤分化程度、脉管浸润及神经浸润方面比较,差异均无统计学意义(P>0.05)。见表1。
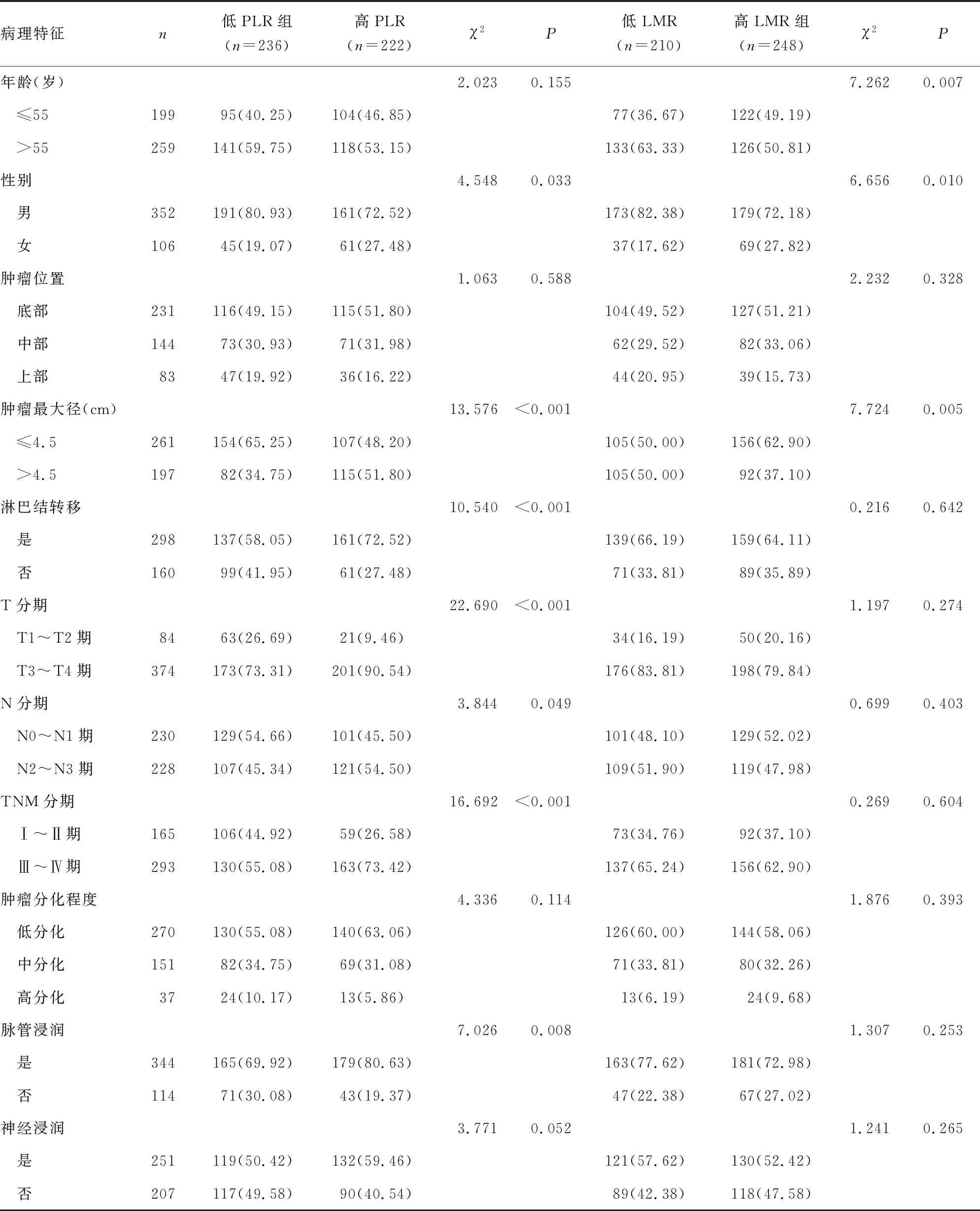
表1 不同临床病理特征在不同PLR、LMR胃癌患者间的比较[n(%)]
2.3不同PLR、LMR胃癌患者预后比较 对458例随访患者利用Kaplan-Meier法计算生存率,并绘制生存曲线,结果显示,术前高PLR组1年、3年生存率分别为66.6%、38.0%,低于低PLR组的73.5%、55.5%(HR=1.534,P<0.05);高LMR组1年、3年生存率分别为73.9%、54.8%,高于低LMR组的66.0%、37.8%(HR=1.554,P<0.05)。见图3、图4。

图3 不同PLR胃癌患者生存时间比较

图4 不同LMR胃癌患者生存时间比较
2.4影响胃癌患者预后的因素分析 将胃癌患者的上述临床病理特征与预后进行单因素Cox回归分析,结果显示,除性别和肿瘤分化程度外,其余指标均与胃癌患者预后有关,见表2。多因素Cox回归分析结果发现,在所有纳入的自变量中,年龄、淋巴结转移、N分期、脉管浸润、LMR 5个变量差异均有统计学意义(HR为1.331、1.582、1.395、1.539、1.645,P<0.05),提示年龄>55岁、有淋巴结转移、N分期为N2~N3期、有脉管浸润、LMR≤4.59是影响胃癌患者预后的独立危险因素,见表3。

表2 影响胃癌患者预后的单因素Cox分析
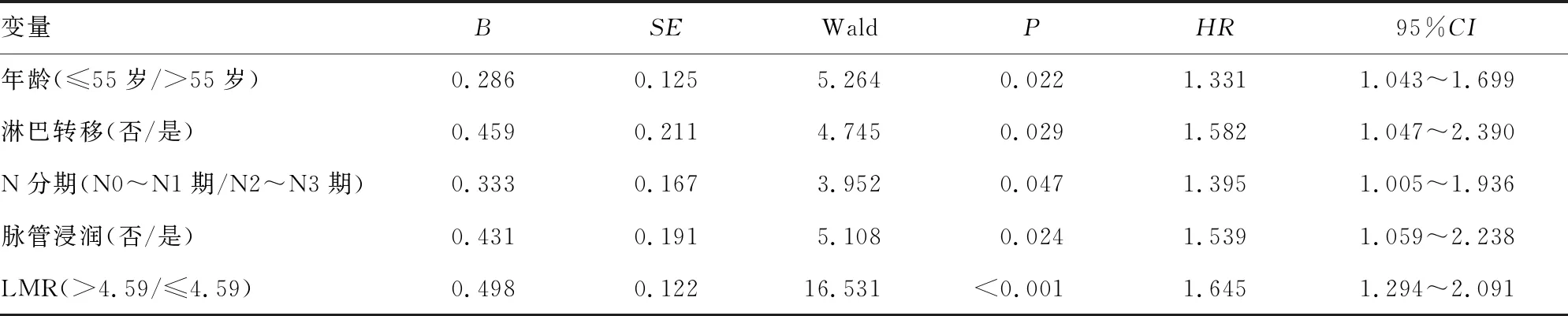
表3 影响胃癌患者预后的多因素Cox分析
3 讨 论
肿瘤的发生、发展是多因素、多环境共同作用的结果,炎症因子在促进肿瘤增殖、分化和迁移过程中扮演重要角色,多项研究已证实,炎性反应与肿瘤术后生存率密切相关[4-6]。临床上常用的系统性炎性反应指标外周血中性粒细胞、血小板、淋巴细胞等,由于经济易测,常用作肿瘤预后预测因子。但作为非特异性指标,其水平易受感染、药物、免疫反应等多种因素影响而表现出不稳定性,而NLR、PLR和LMR等综合指标,能够较好的平衡机体炎症状态和免疫水平的相对关系,及时掌握患者肿瘤进展状况,对肿瘤预后评估和优化治疗策略提供参考。
PLR对预测恶性肿瘤复发及转移有重要意义[7],PLR在一定程度上可反映机体在促肿瘤炎性反应与抗肿瘤免疫反应间是否存在平衡,高PLR往往提示炎性反应指标朝向利于肿瘤增殖转移的方向。有研究表明,肿瘤患者外周血中的循环肿瘤细胞能刺激血小板活化,活化的血小板产生转化生长因子-β、血小板生长因子、血管内皮生长因子等促肿瘤生长因子,可通过协助肿瘤细胞逃避免疫系统监视,加速肿瘤血管生成等多种形式促进肿瘤局部进展与转移[8-10]。淋巴细胞有识别肿瘤细胞并拮抗肿瘤活性的作用,可通过免疫监视和杀灭肿瘤细胞,间接参与阻止肿瘤细胞增殖和转移的过程。而肿瘤患者机体内肿瘤区域处于免疫抑制状态,由恶性肿瘤引起的非特异性炎性反应能导致患者体内血小板升高和淋巴细胞降低,已有研究证实,较高的PLR与乳腺癌、肾透明细胞癌等患者的预后不良有关[10-12]。一项针对6 865例中国消化道癌术后患者炎性反应相关指标预后价值的研究发现,与NLR和PLR同时降低的癌症患者相比,高NLR和高PLR患者癌症死亡风险增加1.69倍,这种关联性在胃癌中尤其突出[13]。本研究发现,高PLR组胃癌患者1年、3年生存率明显低于低PLR组(P<0.05),单因素分析显示,高PLR是影响胃癌预后的危险因素(HR=1.592,P<0.05),与ALDEMIR等[14]研究结果一致。但对于PLR是否能作为胃癌预后的独立危险因素,目前尚未有一致性结论[15-16]。本研究也发现,术前PLR升高与胃癌预后不良无独立相关性,这与KIM等[17]的研究中高PLR对胃癌患者总生存率和无病生存期无影响的结论一致。TANG等[18]对104例接受新辅助化疗的晚期胃癌患者的研究发现,低PLR患者对化疗的反应性更高且有更好的病理缓解率。而本研究也提示,低PLR组患者在肿瘤最大径、淋巴转移、TNM分期、脉管浸润等方面的表现均优于高PLR组(P<0.05)。提示术前PLR可作为早期评估指标用于胃癌患者术前预判,以指导选择合理治疗方案,改善预后。
低LMR也被证实与结肠癌、肾透明细胞癌、胰腺神经内分泌肿瘤等多种肿瘤预后不良相关[19-20]。LMR的降低反映促肿瘤炎性反应与抗肿瘤免疫反应的一种失衡状态[21],其影响肿瘤患者预后的具体机制可能为:一方面,肿瘤患者淋巴细胞减少,导致其拮抗肿瘤活性下降,免疫应答不足,为恶性肿瘤细胞增殖、转移提供了良好的微环境,促进了肿瘤发展;另一方面,外周血单核细胞在肿瘤微环境中基质细胞和肿瘤细胞分泌的趋化因子的作用下,被招募至肿瘤局部并进一步分化为肿瘤相关巨噬细胞(TAMs)[22],TAMs可产生炎症细胞因子IL-23和IL-17促进肿瘤生长[23],并参与抑制细胞毒性T淋巴细胞的抗肿瘤效应,通过建立癌前转移微环境及促进肿瘤血管生成等机制使肿瘤扩散和转移[24-26]。PAN等[27]对870例行根治性肿瘤切除术的胃癌患者5年随访证实,低LMR与患者预后不良有关,与NLR、PLR相比,低LMR是唯一独立预测生存率的血液学因素。本研究以4.59为LMR最佳临界值对458例胃癌患者进行分组并随访,生存分析结果提示,术前低LMR组患者3年生存率为37.8%,明显低于高LMR组的54.8%(HR=1.554,P<0.05),且与PLR相比,LMR在胃癌患者预后评估中的预测效能要优于PLR,单因素和多因素Cox回归分析均支持低LMR是影响胃癌预后的独立危险因素(P<0.05)。
此外,本研究还发现,淋巴结转移、N分期、脉管浸润也可作为影响胃癌患者预后的独立预测因子,目前临床上T分期、N分期和TNM分期是确定手术方式的主要依据,主要通过术前影像学检查进行预判,脉管浸润主要以术后病理检查为主,也可辅助评估肿瘤风险及判断预后。相比而言,PLR、LMR来源于术前外周血检查,经济易得,结果稳定可靠,容易被患者接受,可作为临床预后评估和术后常规随访的重要监测指标。随着肿瘤细胞不断复制,其产生和释放的促炎细胞因子和趋化因子等也会随之变化,且近年来C反应蛋白、血清清蛋白及多种复合标记物也逐渐被作为肿瘤预测因子而应用,因此,以PLR和LMR等为代表的炎症相关指标监测应该是动态、规律、长期并结合临床的。
本研究也存在不足之处。首先,本研究属于回顾性分析,研究对象选取和数据资料收集有限,其他混杂因素可能对预后评估的价值产生影响;其次,PLR、LMR最佳临界值的确定尚无统一方法,不同临界值确定方法可能对结果产生偏倚;最后,PLR、LMR与不同分期胃癌患者预后的关系尚未在本研究中作进一步分析,后续还有待大样本、多中心的前瞻性分析进一步论证。
综上所述,术前PLR和LMR与胃癌患者预后相关,低LMR可作为胃癌预后评估的独立预测因子,对术前低LMR患者应加强术后随访和监测,以期改善预后。
