chi-miR-128-3p和chi-miR-218对Nr1d2基因的靶向调控研究
2021-06-09王世杰张薇依王建芳贾存灵
王世杰,张薇依,王建芳,毛 潮,隋 洁,贾存灵
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
在哺乳动物中,有节律的生理和行为功能的组织受控于位于下丘脑视交叉上核(SCN)。控制节律的组织不限于SCN,而在大多数外周组织中也有分子钟表达和作用[1]。哺乳动物体内大约5%到10%的转录本呈现节律性[2],蛋白质组分析显示,大约有20%的蛋白呈周期性表达,其中一些具有相应的mRNA表达[3]。此外,呈周期性表达的mRNA比前体RNA更丰富[4],这些差异表示转录后和翻译后修饰机制在调节生物节律中的重要性。
microRNA(miRNA)是一类小的单链RNA分子,长度约为18~25nt,由基因组非编码区域转录[5]。通过与靶基因mRNA的3'端非翻译区(3'untranslational region,3'UTR)内的互补位点结合来使mRNA翻译抑制或转录降解来调节基因的表达,进行转录水平或转录后水平调控靶基因mRNA的表达[6]。从胚胎发育开始,到细胞凋亡,乃至肿瘤生长,miRNA在一系列生理和病理过程中发挥着重要的作用。研究表明,miRNA与生物节律存在联系,miRNA可参与到中枢和外周生物节律的调控中[7],如脑特异性的miR-132参与生物节律的光调控,可抑制光诱导的时相延迟,以达到节律同步作用[8]。在大鼠的研究中,钟基因Bmal1与miR-103的表达相关,在转录后水平对昼夜节律进行调节[9]。在小鼠上利用基因芯片技术,研究以12L:12D的光照下肝脏上miRNA和mRNA之间的表达关系,发现205个miRNA靶向Clock、Bmal1、per1-3等钟基因,说明miRNA在生物节律调控中发挥重要作用[10]。
在生物钟基因中,Rev-erbβ(Nr1d2)基因是编码核激素受体家族的一员,其编码的蛋白能作为转录抑制因子参与昼夜节律变化,及碳水化合物和脂代谢过程[11]。Nr1d2基因在绒山羊毛囊的周期生长中存在表达差异[12]。据报道,安哥拉兔的miR-218能够激活Wnt信号通路,在皮肤和毛囊发育过程中起动态调节作用[13];miR-128通过靶向TGF-1的主要转录调控因子Smad2来调控人的毛囊间充质干细胞的分化[14]。因此,本研究通过对miR-218和miR-128与Nr1d2基因靶向关系进行初步的探究,以期为研究Nr1d2基因可能参与的毛囊发育等生物节律现象机制的研究提供依据。
1 材料与方法
1.1 miRNA的预测和筛选
根据miRNA与基因存在相互作用调控的关系,利用Target Scan网站对目标Nr1d2基因进行miRNA预测[15]。
1.2 双荧光素酶报告载体的构建
用Premier 5软件设计包含结合位点片段的引物,并插入限制性XhoI或NotI酶切位点(引物见表1),以全基因组DNA为模板,扩增出包含靶点的目的片段,利用胶回收试剂盒Gel Extraction Kit(Omega)纯化回收目的片段。将回收纯化的目的片段和骨架载体psiCHECHETM-2,用限制性内切酶Xho1和Not1切割,连接回收纯化后的切割产物,并转化到DH5a感受态细胞中,用AMP培养基筛选阳性菌落,挑取单克隆,摇菌,将菌液送去测序;测序结果比对正确的菌液进行扩繁,用无内毒素质粒提取试剂盒Endo-Free Plasmid Midi Kit(Omega)提取质粒,以备后续细胞转染试验使用。

表1 PCR扩增引物Table 1 PCR primers
1.3 突变型双荧光素酶报告载体的构建
根据点突变原理(图1A),用Premier 5软件设计结合位点突变的引物(图1B),以上述连接成功的质粒为模板,扩增出包含突变靶点的质粒,PCR产物用DpnI酶处理,切除模板质粒。将产物转化到DMT感受态(TransGen Biotech),用AMP培养基筛选阳性菌落,挑取单克隆,摇菌,测序;测序结果正确的菌液提取质粒,以备后续细胞转染实验使用。

图1 突变型载体的构建A.点突变原理(Trans Gen Biotech);B.突变引物Fig.1 Construction of mutant vectorsA.Point mutation principle(TransGen Biotech);B.Mutation primer
1.4 细胞分离培养和转染

1.5 双荧光素酶活性的检测
为了验证chi-miR-128-3p和chi-miR-218与Nr1d2基因的靶向关系,将上述构建好的野生型和突变型双荧光素酶报告载体,通过mimics+WT,mimics NC+WT,mimics+MUT,mimics NC+MUT的方式进行共转染在24孔板中,转染后24~48 h检测检测细胞内相对RLU值(Relative lucifcrase activity)。
1.6 统计分析
使用SPSS 18.0(IBM)软件进行t检验。每组结果数据均用平均值±标准差(Mean±SD)表示。“*”P<0.05为差异显著,“**”P<0.01为差异极显著。
2 结果与分析
2.1 Nr1d2基因的miRNA的预测和筛选结果
Nr1d2基因的3'UTR区域与chi-miR-128-3p和chi-miR-218的结合位置如图2A所示,其结合种子序列均为7 bp,chi-miR-128-3p与Nr1d2基因 3'UTR的结合位点为mRNA的2678-2685 bp处,chi-miR-218的结合位点为4114-4121 bp处。使用在线软件BiBiServ[16]中的RNA hybrid功能对Nr1d2 mRNA 3'UTR与chi-miR-128-3p和chi-miR-218结合位点和结合自由能进行预测,并分析其二级结构(图2B)。Nr1d2 mRNA的3'UTR与chi-miR-128-3p结合的自由能为-25 kcal/mol,Nr1d2 mRNA的3'UTR与chi-miR-218结合的自由能为-24 kcal/mol,相对而言,Nr1d2 mRNA 3'UTR与chi-miR-218可能更容易结合。

图2 生物信息学分析A.Nr1d2 3'UTR结合区域;B.chi-miR-128-3p和chi-miR-218的二级结构Fig.2 Bioinformatics analysisA.Nr1d2 3'UTR binding region;B.Secondary structures of chi-miR-128-3p and chi-miR-218
2.2 构建出的野生型和突变型双荧光素酶报告载体
PCR扩增得到Nr1d2 mRNA 3'UTR两个片段克隆(图3A),对PCR产物进行琼脂糖凝胶电泳,条带大小如图3C所示,与目标序列大小相符,之后利用XhoI和NotI内切酶对psiCHECKTM-2和目的片段双酶切并连接,构建野生型双荧光素酶报告载体psiCHECKTM-2-Nr1d2-3'UTR-WT,并对chi-miR-128-3p和chi-miR-218结合位点进行突变,构建突变型双荧光素酶报告载体psiCHECKTM-2-Nr1d2-3'UTR-MUT,经公司测序显示,结果与目标序列完全一致(图3D),表明成功构建了野生型和突变型双荧光素酶报告载体。

图3 双荧光素酶报告载体的构建A.包含靶点的目的片段(Maker左侧为包含chi-miR-128-3p靶点的3'UTR;Maker右侧为包含chi-miR-218靶点的3'UTR);B.psiCHECKTM-2载体;C.凝胶电泳图;D.野生型和突变型载体部分测序结果Fig.3 Construction of a dual luciferase reporter vectorA.contains the target fragment of interest (The left side of the Maker was the 3'UTR containing chi-miR-128-3p target;the right side of the Maker was the 3'UTR containing chi-miR-218 target);B.psiCHECKTM-2 vector;C.Gel electrophoresis;D.partial sequencing results of wild-type and mutant vectors
2.3 双荧光素酶活性分析
构建成功的psiCHECKTM-2-Nr1d2-3'UTR-WT、psiCHECKTM-2-Nr1d2-3'UTR-MUT与chi-miR-128-3p mimics、chi-miR-218 mimics、mimics NC分别共转染到293 A细胞,转染后24~48 h后检测细胞内RLU值。结果表明,转染chi-miR-128-3p mimics对野生型和突变型载体的荧光素酶活性无显著影响(图4A)。而转染chi-miR-218 mimics能使野生型荧光素酶活性极显著下降(P<0.01),而对突变型荧光素酶活性无影响(图4B),试验结果表明chi-miR-128-3p和Nr1d2的关系有待探究,但可以证明chi-miR-218通过靶向Nr1d2-3'UTR区域,抑制了双荧光素酶的活性,初步确定Nr1d2是chi-miR-218的靶基因。
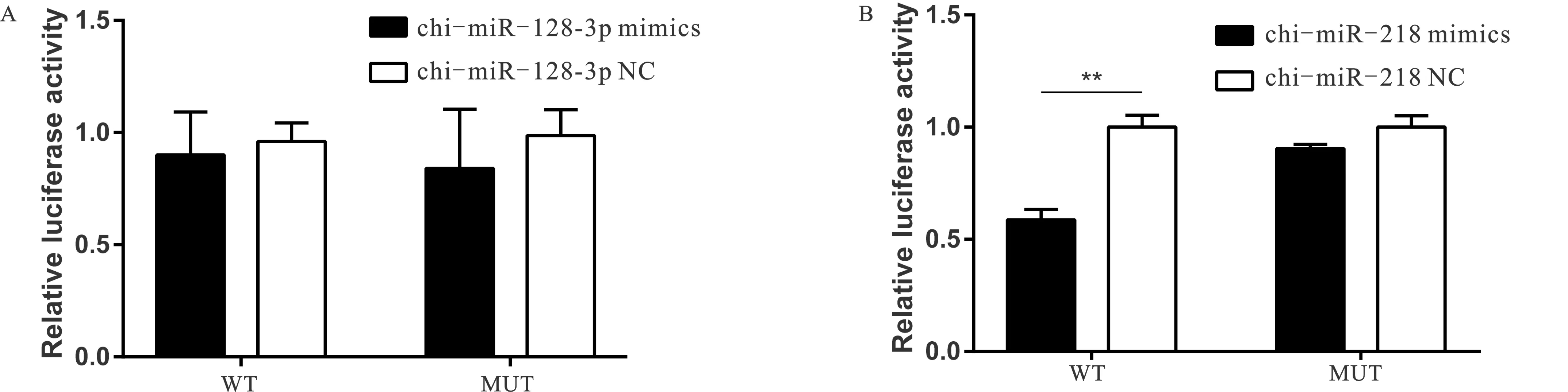
图4 双荧光素酶活性检测A.chi-miR-128-3p双荧光素酶活性检测;B.chi-miR-218双荧光素酶活性检测;**表示P<0.01Fig.4 Dual luciferase assaysA.Dual luciferase assays of chi-miR-128-3p;B.Dual luciferase assays of chi-miR-218;** means P<0.01
3 讨 论
生物节律驱使许多细胞功能呈现时间变化,包括基因表达、代谢以及细胞周期。生物钟是由一组特定的转录因子组成的,这些转录因子构成了生物钟的分子结构。许多环境因素如食物、光照和温度等会影响生物节律及相关生物钟基因的表达变化[17],这些变化常常受表观遗传的调控。miRNA是其中一种表观遗传修饰,它广泛存在于动物中,在生物体内的功能作用和调控机制已有大量研究报道[18],其参与生物节律的调控日益受到研究者的重视。研究发现,Nr1d2在调节饮食行为和能量消耗方面的起到关键作用,Nr1d2基因敲除后,小鼠表现出饮食依赖性的代谢失调[19];Nr1d2也参与毛囊的发育[12]。但有关该基因可能与哪些miRNA有关鲜有报道。因此本研究用双荧光素酶检测系统确定miRNA与预测靶基因调控关系。
通过用Target Scan网站进行初步筛选,最终确定了chi-miR-128-3p和chi-miR-218,并成功构建了野生型以及突变型双荧光素酶报告载体。将chi-miR-128-3p和chi-miR-218的mimics以及mimics NC分别与构建的双荧光素酶报告载体共转染到293A细胞系中进行培养,结果显示chi-miR-128-3p对细胞RLU值无显著影响,说明chi-miR-128-3p与Nr1d2不存在靶向关系。chi-miR-218对细胞RLU值有显著的影响(P<0.01),因此,初步判定chi-miR-218与Nr1d2存在靶向关系。研究显示,miR-218通过靶向Wnt抑制剂,从而促进Wnt/β-catenin信号通路的转录调控[20],从而影响细胞增殖[21]。研究miRNA在生物节律中的具体靶点和调节网络,将有助于更好地理解生物节律的调控机制。
4 结 论
本研究成功构建野生型和突变型双荧光素酶报告载体,用双荧光素酶检测系统确定了miR-218靶向Nr1d2基因的3'UTR区域。
