5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶-4(3H)-酮类查尔酮的设计、合成及体外抗肿瘤活性
2021-06-04陈慧琼
王 璇, 李 慧, 韩 潇*, 毛 婷, 陈慧琼
(1. 武汉城市学院 医学部,湖北 武汉 430083; 2. 长江职业学院 医药护理学院,湖北 武汉 430074; 3. 武汉爱民制药股份有限公司,湖北 鄂州 436070)
氮杂环化合物因具有良好的生物活性现已在农药和医药等领域对人类的健康发挥着重要的作用[1]。四氢苯并噻吩并嘧啶类衍生物作为一类重要的氮杂环化合物,近年来被发现具有抗炎[2]、抗菌[3]、抗结核[4]、抗病毒[5]等广泛生物活性。尤其是,近年来四氢苯并噻吩并嘧啶骨架常用于抗肿瘤药物的设计,目前已经有数十个不同的衍生物被报道出来,具有良好的抗肿瘤活性[6-8](Chart 1)。通过Wittig 反应合成的一系列四氢苯并噻吩并嘧啶衍生物对乳腺癌细胞展现出了有效的抑制活性[9]。近期还有其他几个课题组也报道了四氢苯并噻吩并嘧啶类化合物具有良好的抗乳腺癌活性[10-11]。
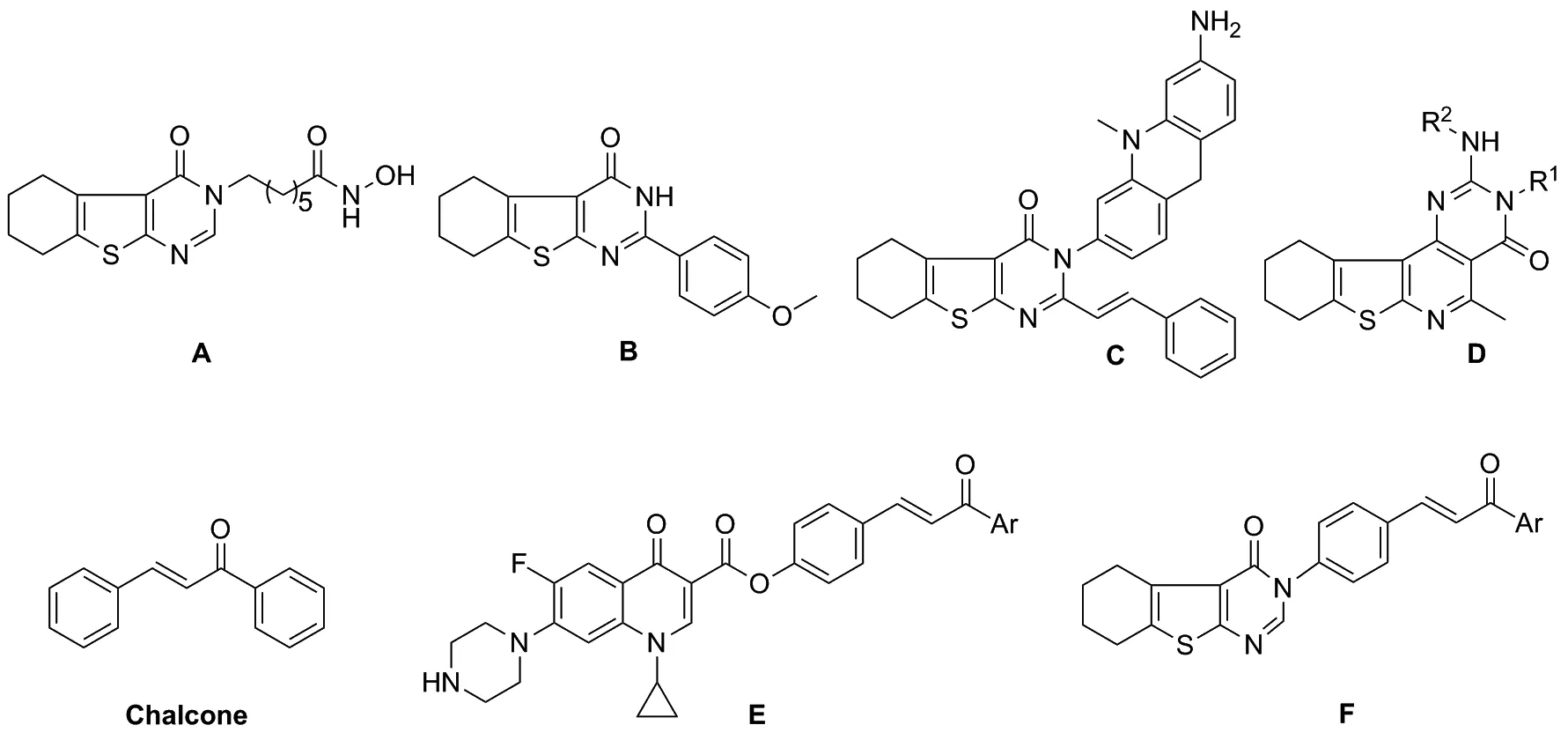
Chart 1

Scheme 1
查尔酮是一类具有1,3-二苯基丙烯骨架的重要天然产物,广泛的分布在自然界多种植物中[12]。由于其结构中具有α,β-不饱和酮结构,该官能团具有较好的柔性,能与细胞中的多种酶相互作用,近年来被发现具有抗菌[13]、抗炎[14]、抗疟疾[15]、抗肿瘤[16]等广泛生物活性,尤其是最近来其抗肿瘤活性被广泛的研究[17-19]。此外,查尔酮是植物体内黄酮的合成前体,毒性较低,同时其α,β-不饱和酮结构可修饰性强。因此,查尔酮也常常被作为抗肿瘤的药效团引入到其他活性结构中来提高母体药物的抗肿瘤活性[20]。
乳腺癌是女性最常患的恶性肿瘤,发病率和致死率在女性患的所有癌症中排第一位,而近年来发病率呈逐年增加并更趋年青化[21]。鉴于四氢苯并噻吩并嘧啶和查尔酮均为具有潜在抗肿瘤活性的药效团,在本研究根据活性亚结构拼接原理,合成了18个四氢苯并噻吩并嘧啶并查尔酮类杂合物(Scheme 1),并测试了其体外抗乳腺的癌活性。
1 实验部分
1.1 仪器与试剂
XT4型显微熔点测定仪(温度未校正);Bruker AM-400 MHz型核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标);Agilent- 6120型液质联用仪;ELx800型酶标仪。
环己酮、氰乙酸乙酯、吗啉、硫粉、甲酰胺、4-甲酰基苯硼酸、醋酸铜、1,2-二氯乙烷、芳香酮,均购自北京伊诺凯科技有限公司;其余所用试剂均为分析纯。
1.2 合成
(1) 2-氨基-4,5,6,7-四氢苯并[4,5]噻吩-3-甲酸乙酯(2)的合成
将环己酮2.462 g(25 mmol)、氰乙酸乙酯2.828 g(25 mmol)和硫粉0.8 g(25 mmol)溶解于60 mL乙醇中,滴加4 mL吗啉,60 ℃反应16 h。减压除去溶剂,残余物经硅胶柱层析(洗脱剂:A=石油醚/乙酸乙酯=4/1,V/V)纯化得淡黄色固体(2) 4.889 g,产率86.8%;1H NMR(400 MHz, CDCl3)δ: 6.01(s, 2H), 4.22(q,J=7.2 Hz, 2H), 2.68~2.65(m, 2H), 2.47~2.44(m, 2H), 1.76~1.65(m, 4H), 1.32(t,J=7.5 Hz, 3H)。
(2) 5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶-4(3H)-酮(3)的合成
将24.715 g(21 mmol)溶解于30 mL甲酰胺中,加热回流2 h,待反应液冷却至室温后加入100 mL水,析出沉淀,过滤,滤饼用水洗(3× 30 mL),真空干燥过夜得淡黄色固体(3) 3.141 g,产率72.5%;1H NMR(400 MHz, CDCl3)δ: 7.95(s, 1H), 3.01~2.99(m, 2H), 2.79~2.74(m, 2H), 2.03~1.82(m, 4H)。
(3) 3-(4-甲酰基苯基)-5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶-4(3H)-酮(4)的合成
将33.102 g(15 mmol)、4-甲酰基苯硼酸3.448 g(23 mmol)、醋酸铜2.725 g(15 mmol)和Et3N 4.2 mL(30 mmol)溶解于50 mL 1,2-二氯乙烷中,室温反应2 h,过滤,浓缩滤液,残余物经硅胶柱层析(洗脱剂:A=3/2,V/V)纯化得白色固体(4) 3.804 g,产率81.7%;1H NMR(400 MHz, CDCl3)δ: 10.12(s, 1H), 7.94(s, 1H), 3.02(t,J=6.4 Hz, 2H), 2.82~2.75(m, 2H), 2.00~1.81(m, 4H)。
(4) 5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶-4(3H)-酮类查尔酮(5a~5r)的合成
将4310 mg(1 mmol)和芳香酮(1 mmol)溶解于10 mL乙醇中,加入1 mL 10% NaOH溶液,室温反应8 h,加入60 mL水,析出沉淀,4 ℃下静置过夜,过滤,滤饼用水洗(3× 20 mL),真空干燥即得目标产物;若加水不能析出沉淀,则先用1 mol/L的盐酸调节pH=5,用乙酸乙酯(3× 25 mL)萃取,饱和的NaHCO3溶液洗涤,无水Na2SO4干燥,减压浓缩,残余物经硅胶柱层析(洗脱剂:A=4/1~2/3,V/V)纯化得目标化合物。
5a: 黄色固体,收率75.4%, m.p.196~198 ℃;1H NMR(CDCl3, 400 MHz)δ: 8.02(d,J=8.4 Hz, 2H), 7.97(s, 1H), 7.82(d,J=16.0 Hz, 1H), 7.56(d,J=8.0 Hz, 2H), 7.52(d,J=16.0 Hz, 1H), 7.49~7.43(m, 3H), 7.39(d,J=8.0 Hz, 2H), 3.01(t,J=5.6 Hz, 2H), 2.81~2.76(m, 2H), 1.96~1.85(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 190.4, 162.0, 157.7, 143.8, 143.2, 136.5, 134.2, 132.7, 132.3, 130.1, 129.6, 129.3, 128.4, 125.3, 122.6, 121.9, 121.5, 25.7, 25.4, 22.8, 22.3; EI-MSm/z: 412 {[M]+}。
5b: 黄色固体,收率65.4%, m.p.196~198 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.95(s, 1H), 7.78(d,J=16.0 Hz, 1H), 7.57(d,J=7.6 Hz, 2H), 7.41(d,J=16.0 Hz, 1H), 7.38(d,J=8.0 Hz, 2H), 7.07(t,J=7.2 Hz, 1H), 7.04~7.00(m, 2H), 6.93~6.87(m, 1H), 3.06~3.02(m, 2H), 2.80(t,J=5.6 Hz, 2H), 2.21(s, 3H), 1.93~1.82(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.8, 162.1, 157.6, 143.2, 144.2, 140.1, 136.1, 134.5, 132.8, 131.0, 129.8, 129.5, 129.4, 128.6, 124.7, 122.6, 120.3, 25.7, 25.2, 22.9, 22.1, 18.9; EI-MSm/z: 426 {[M]+}。
5c: 黄色固体,收率70.6%, m.p.204~206 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.97(s, 1H), 7.79(d,J=16.4 Hz, 1H), 7.61(t,J=7.6 Hz, 1H), 7.59(d,J=8.0 Hz, 2H), 7.57(d,J=16.0 Hz, 1H), 7.48(s, 1H), 7.43(d,J=8.0 Hz, 2H), 6.98(d,J=8.0 Hz, 1H), 6.85~6.82(m, 1H), 3.02(t,J=5.6 Hz, 2H), 2.81(t,J=5.6 Hz, 2H), 2.31(s, 3H), 1.94~1.84(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.6, 162.6, 157.9, 144.5, 143.7, 138.9, 138.2, 136.6, 132.7, 132.3, 130.8, 130.5, 129.6, 129.5, 129.1, 125.1, 124.9, 121.9, 121.4, 25.6, 25.3, 22.8, 22.2, 21.7; EI-MSm/z: 426 {[M]+}。
5d: 黄色固体,收率71.1%, m.p.184~186 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.96(s, 1H), 7.87(d,J=8.4 Hz, 2H), 7.73(d,J=16.0 Hz, 1H), 7.55(d,J=7.6 Hz, 2H), 7.51(d,J=15.6 Hz, 1H), 7.41(d,J=7.6 Hz, 2H), 7.35(d,J=8.0 Hz, 2H), 3.05~3.01(m, 2H), 2.82~2.78(m, 2H), 2.34(s, 3H), 1.93~1.86(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.8, 162.1, 157.6, 144.2, 143.2, 141.1, 136.1, 134.5, 132.8, 131.0, 129.8, 129.5, 129.4, 128.6, 124.7, 122.6, 120.6, 25.7, 25.2, 22.9, 22.1, 21.5; EI-MSm/z: 426 {[M]+}。
5e: 黄色固体,收率68.3%, m.p.191~193 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.97(s, 1H), 7.72(d,J=15.6 Hz, 1H), 7.68(t,J=6.8 Hz, 1H), 7.61(d,J=8.0 Hz, 2H), 7.45(d,J=15.6 Hz, 1H), 7.40(d,J=8.0 Hz, 2H), 7.36~7.31(m, 2H), 7.05~7.01(m, 1H), 3.75(s, 3H), 3.05~3.01(m, 2H), 2.83~2.77(m, 2H), 1.89~1.84(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 190.6, 162.2, 157.4, 156.4, 145.2, 144.2, 135.9, 133.6, 131.7, 131.2, 130.7, 130.4, 129.8, 129.6, 126.8, 123.5, 121.9, 121.7, 118.9, 25.5, 25.1, 23.1, 22.4, 55.7; EI-MSm/z: 443 {[M + H]+}。
5f: 黄色固体,收率62.4%, m.p.172~174 ℃;1HNMR(CDCl3, 400 MHz)δ: 7.92(s, 1H), 7.77(d,J=15.6 Hz, 1H), 7.73(t,J=6.8 Hz, 1H), 7.56(d,J=7.6 Hz, 2H), 7.50(d,J=15.2 Hz, 1H), 7.48(s, 1H), 7.39(d,J=7.6 Hz, 2H), 7.37~7.34(m, 2H), 3.81(s, 3H), 3.03(t,J=6.0 Hz, 2H), 2.81~2.85(m, 2H), 1.98~1.86(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.4, 162.5, 158.8, 156.5, 144.1, 143.9, 136.1, 132.6, 132.3, 131.6, 129.8, 129.3, 124.7, 122.6, 122.2, 121.8, 121.6, 121.2, 120.3, 25.6, 25.3, 22.8, 22.4, 55.4; EI-MSm/z: 443 {[M + H]+}。
5g: 黄色固体,收率66.6%, m.p.189~191 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.94(s, 1H), 7.82(d,J=8.4 Hz, 2H), 7.80(d,J=16.0 Hz, 1H), 7.60(d,J=8.0 Hz, 2H), 7.49(d,J=15.2 Hz, 1H), 7.39(d,J=8.0 Hz, 2H), 7.15(d,J=8.0 Hz, 2H), 3.79(s, 3H), 3.02(t,J=5.6 Hz, 2H), 2.82~2.78(m, 2H), 1.90~1.82(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 188.9, 162.4, 161.5, 158.1, 144.6, 144.1, 135.7, 134.3, 130.7, 129.9, 129.5, 128.2, 127.4, 122.1, 121.7, 119.7, 114.4, 25.7, 25.3, 23.1, 22.5, 55.8; EI-MSm/z: 443 {[M + H]+}。
5h: 黄色固体,收率46.4%, m.p.199~201 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.92(s, 1H), 7.68(d,J=16.0 Hz, 1H), 7.58(d,J=7.6 Hz, 2H), 7.45(d,J=7.6 Hz, 2H), 7.29(d,J=15.2 Hz, 1H), 7.23(d,J=8.0 Hz, 2H), 6.91(d,J=8.0 Hz, 2H), 3.01(t,J=5.2 Hz, 2H), 2.81~2.75(m, 2H), 1.92~1.83(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.7, 163.7, 162.1, 157.6, 144.1, 143.5, 135.8, 132.5, 131.2, 130.8, 130.2, 129.5, 129.1, 124.8, 121.6, 121.2, 116.9, 25.6 25.3, 22.8, 22.1; EI-MSm/z: 429 {[M + H]+}。
5i: 黄色固体,收率68.1%, m.p.196~199 ℃;1HNMR(CDCl3, 400 MHz)δ: 7.91(s, 1H), 7.74(d,J=16.4 Hz, 1H), 7.60(d,J=8.0 Hz, 2H), 7.56(d,J=8.4 Hz, 2H), 7.42(d,J=8.4 Hz, 2H), 7.39(d,J=8.0 Hz, 2H), 7.21(d,J=15.6 Hz, 1H), 3.00~2.97(m, 2H), 2.79~2.74(m, 2H), 1.89~1.81(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 190.4, 165.4(d,JCF=252.2 Hz), 162.4, 157.9, 144.5, 144.1, 136.2, 133.6(d,JCF=3.3 Hz), 132.2, 130.7(d,JCF=8.7 Hz), 130.5, 130.2, 129.9, 129.6, 122.2, 121.3, 116.1(d,JCF=22.4 Hz), 25.8, 25.2, 22.7, 22.2; EI-MSm/z: 430 {[M]+}。
5j: 黄色固体,收率64.8%, m.p.188~190 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.93(s, 1H), 7.91~7.85(1H, m), 7.81(d,J=16.0 Hz, 1H), 7.59(d,J=8.0 Hz, 2H), 7.52~7.44(1H, m), 7.39(d,J=8.0 Hz, 2H), 7.24~7.21(1H, m), 7.138~7.08(1H, m), 3.02(t,J=5.6 Hz, 2H), 2.82~2.76(m, 2H), 1.90~1.83(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.6(d,JCF=8.5 Hz), 162.4(d,JCF=252.4 Hz), 162.1, 158.2, 143.6, 143.2, 135.7(d,JCF=8.5 Hz), 135.2, 132.5, 131.4(d,JCF=8.7 Hz), 130.6, 130.4, 129.7, 129.2, 124.6(d,JCF=3.3 Hz), 123.5(d,JCF=22.0 Hz), 122.3, 121.9, 116.7(d,JCF=22.0 Hz), 25.7, 25.3, 22.8, 22.4; EI-MS,m/z: 430 {[M]+}。
5k: 黄色固体,收率67.1%, m.p.211~213 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.96(s, 1H), 7.77(d,J=15.2 Hz, 1H), 7.62(d,J=8.0 Hz, 2H), 7.51(d,J=8.0 Hz, 2H), 7.44(d,J=8.4 Hz, 2H), 7.32(d,J=8.0 Hz, 2H), 7.16(d,J=15.6 Hz, 1H), 3.01(t,J=5.2 Hz, 2H), 2.82~2.76(m, 2H), 1.93~1.84(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 191.2, 162.2, 158.2, 144.7, 144.3, 138.8, 136.7, 134.8, 132.6, 131.2, 129.8, 129.5, 129.1, 128.9, 128.3, 122.4, 121.4, 25.7, 25.3, 22.8, 22.2; EI-MSm/z: 447 {[M]+}。
5l: 黄色固体,收率61.8%, m.p.117~119 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.96(s, 1H), 7.78(d,J=15.6 Hz, 1H), 7.55(d,J=8.0 Hz, 2H), 7.51~7.43(m, 1H), 7.41(d,J=8.0 Hz, 2H), 7.39(d,J=15.6 Hz, 1H), 7.35(t,J=8.0 Hz, 1H), 7.19~7.11(m, 2H), 3.01(t,J=5.6 Hz, 2H), 2.81(t,J=5.2 Hz, 2H), 1.92~1.85(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.6, 162.7, 158.5, 144.6, 144.2, 135.9, 134.7, 133.6, 132.4, 131.6, 130.8, 130.5, 130.0, 129.6, 129.3, 128.2, 127.4, 121.9, 121.6, 25.8, 25.3, 22.7, 22.2; EI-MSm/z: 447 {[M]+}。
5m: 黄色固体,收率72.3%, m.p.208~210 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.91(s, 1H), 7.82(d,J=8.0 Hz, 2H), 7.76(d,J=15.6 Hz, 1H), 7.58(d,J=8.0 Hz, 2H), 7.55(d,J=8.0 Hz, 2H), 7.51(d,J=16.0 Hz, 1H), 7.39(d,J= 8.0 Hz, 2H), 3.04~2.95(m, 2H), 2.80~2.75(m, 2H), 1.91~1.82(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.6, 162.5, 157.4, 143.9, 143.6, 135.8, 134.7, 132.9, 132.2, 130.8, 130.2, 129.8, 129.4, 128.9, 122.2, 121.8, 120.6, 25.6, 25.2, 22.7, 22.2; EI-MSm/z: 491 {[M]+}。
5n: 黄色固体,收率75.3%, m.p.188~190 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.92(s, 1H), 7.75(d,J=16.0 Hz, 1H), 7.59(d,J=8.0 Hz, 2H), 7.37(d,J=8.0 Hz, 2H), 7.33(d,J=15.6 Hz, 1H), 7.12(t,J=7.6 Hz, 2H), 6.71~6.53(m, 1H), 3.00~2.94(m, 2H), 2.80~2.73(m, 2H), 2.30(s, 6H), 1.91~1.84(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 189.5, 162.8, 157.8, 144.4, 144.1, 139.2, 137.3, 134.9, 132.3, 131.5, 131.2, 129.5, 129.1, 128.6, 128.2, 121.7, 120.4, 25.6, 25.2, 22.7, 22.1, 19.2; EI-MSm/z: 440 {[M]+}。
5o: 黄色固体,收率70.6%, m.p.214~216 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.97(s, 1H), 7.93(d,J=7.6 Hz, 1H), 7.80(d,J=15.6 Hz, 1H), 7.65(d,J=8.0 Hz, 1H), 7.57(d,J=7.6 Hz, 2H), 7.55~7.48(m, 3H), 7.49(d,J=8.0 Hz, 1H), 7.40(d,J=7.6 Hz, 2H), 7.37(d,J=15.6 Hz, 1H), 6.78~6.75(m, 1H), 3.02(t,J=5.6 Hz, 2H), 2.83~2.77(m, 2H), 1.90~1.82(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 190.3, 162.4, 157.5, 143.8, 143.1, 134.6, 134.2, 133.6, 133.3, 132.8, 132.6, 130.6, 130.2, 129.8, 129.3, 128.7, 128.4, 128.1, 127.8, 126.8, 123.7, 122.2, 121.9, 25.9, 25.5, 22.8, 22.3; EI-MSm/z: 463 {[M + H]+}。
5p: 黄色固体,收率71.4%, m.p.181~183 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.91(s, 1H), 7.59(d,J=15.6 Hz, 1H), 7.57(d,J=8.4 Hz, 2H), 7.50(d,J=1.2 Hz, 1H), 7.44(d,J=15.2 Hz, 1H), 7.40(d,J=8.0 Hz, 2H), 6.72(d,J=3.6 Hz, 1H), 6.58~6.51(m, 1H), 3.02~2.94(m, 2H), 2.81~2.74(m, 2H), 1.90~1.82(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 186.5, 162.7, 157.4, 153.2, 146.7, 144.1, 134.8, 133.2, 131.4, 130.5, 129.6, 128.9, 122.6, 121.3, 117.7, 112.3, 25.6, 24.9, 22.3, 21.9; EI-MSm/z: 403 {[M + H]+}。
5q: 黄色固体,收率79.5%, m.p.192~194 ℃;1H NMR(CDCl3, 400 MHz)δ: 7.97(s, 1H), 7.89(d,J=3.2 Hz, 1H), 7.74(d,J=15.6 Hz, 1H), 7.68(d,J=5.2 Hz, 1H), 7.57(d,J=8.0 Hz, 2H), 7.41(d,J=8.0 Hz, 2H), 7.39(d,J=15.6 Hz, 1H), 7.16~7.12(m, 1H), 3.00(t,J=5.6 Hz, 2H), 2.80(t,J=5.2 Hz, 2H), 1.91~1.83(m, 4H);13C NMR(CDCl3, 100 MHz)δ: 187.4, 162.5, 157.8, 143.6, 143.2, 140.3, 135.2, 132.7, 132.5, 130.9, 130.4, 129.7, 128.8, 128.5, 127.6, 123.1, 121.8, 25.7, 25.4, 22.8, 22.3; EI-MSm/z: 419 {[M + H]+}。
5r: 黄色固体,收率76.6%, m.p.196~198 ℃;1H NMR(DMSO-d6, 400 MHz)δ: 12.04(s, 1H), 7.96(s, 1H), 7.72(d,J=15.2 Hz, 1H), 7.60(d,J=15.2 Hz, 1H), 7.60(d,J=7.6 Hz, 2H), 7.42~7.37(m, 3H), 7.19~7.14(m, 1H), 6.29~6.24(m, 1H), 3.01~2.95(m, 2H), 2.80~2.75(m, 2H), 1.90~1.82(m, 4H);13C NMR(DMSO-d6, 100 MHz)δ: 179.7, 162.6, 158.2, 143.8, 143.4, 134.8, 132.7, 132.4, 130.6, 129.4, 128.7, 128.1, 127.5, 122.3, 121.7, 117.5, 111.8, 25.7, 24.6, 22.4, 22.1; EI-MSm/z: 402 {[M + H]+}。
1.3 抗肿瘤活性测试
取对数生长期的细胞接种于96孔板中,细胞密度约为0.8× 104个/每孔,在5% CO237 ℃的培养箱中孵育24 h,弃去培养基,加入200 μL不同浓度的待测化合物5a~5r,并以5-氟尿嘧啶(5-FU)和他莫昔芬(TAM)为阳性对照,而空白组加入等体积的培养基,继续孵育3 d,加入25 μL MTS溶液,继续孵育4 h,在波长为490 nm处用酶标仪测定每孔吸光度(OD)值,计算测试化合物的IC50值。
2 结果与讨论
2.1 合成
以商业廉价的环己酮、氰乙酸乙酯、硫粉和吗啉为原料,首先通过Gewald反应制得2收率86.8%,然后与甲酰胺发生关环反应得到3收率72.5%,再与对甲醛苯硼酸发生Chan-Lam偶联反应生成4收率81.7%,最后与芳香酮发生Claisen-Schmidt缩合反应制得目标化合物5a~5r,总收率23.9%~40.9%。
2.2 抗肿瘤活性
采用MTS法测试了目标化合物的体外抗肿瘤活性,以荷尔蒙依赖型乳腺癌MCF-7和三阴性乳腺癌MDA-MB-231细胞为测试细胞,正常的乳腺上皮细胞MCF-10A为对照细胞。表1的实验结果表明,目标化合物5a~5r对MCF-7和MDA-MB-231这两种乳腺癌细胞具有明显的抑制活性,其IC50值均在30 μmol·L-1以内。这些结果表明,四氢苯并噻吩并嘧啶酮类查尔酮具有抗乳腺癌活性。进一步分析这些化合物的构效关系发现,化合物5a~5r对MDA-MB-231细胞的抑制活性要强于MCF-7细胞,其中化合物查尔酮单元上的取代基对活性影响较大。当查尔酮单元苯环上没有取代基(化合物5a)时,其对MCF-7和MDA-MB-231细胞展现出了中等的抑制活性,而用给电子基团甲基(化合物5b~5d)、甲氧基(化合物5e, 5d~5g)、羟基(化合物5h)或者空间位阻较大的2,6-二甲基苯基(化合物5n)和1-萘基 (化合物5o)取代后没有明显地提高抗肿瘤活性;但是,当用吸电子基团卤素取代(化合物5i~5m)或者用呋喃、噻吩、吡咯五元杂环取代(化合物5p~5r)后抗肿瘤活性显著地提高。尤其是5p~5r这3个杂环查尔酮化合物对MDA-MB-231的抑制活性较化合物5a提高了至少两倍,并强于阳性药物5-氟尿嘧啶(5-FU)和他莫昔芬(TAM)。
随后,为了评价这些目标化合物的毒性,测试了其对正常MCF-10A的抑制活性。表1的结果显示,目标化合物5a~5r抑制MCF-10A的IC50值均大于100 μmol·L-1,表明这些化合物基本没有毒性,而阳性药物5-FU和TAM却展现出了一定的毒性;同时,化合物5a~5r的体外治疗指数(ITVI > 3)也大于5-FU和TAM,而IVTI值越高,安全性也就越高[22],这表明目标化合物5a~5r的生物安全性高于5-FU和TAM。

表1 化合物5a~5r的抗增殖活性(n=3)
根据活性亚结构拼接原理构建了四氢苯并噻吩并嘧啶并查尔酮类杂合物。以环己酮、硫和氰乙酸乙酯为起始原料,经过Gewald反应、Chan-Lam偶联反应和Claisen-Schmidt缩合反应合成了18个新型5,6,7,8-四氢苯并[4,5]噻吩并[2,3-d]嘧啶-4(3H)-酮并查尔酮化合物。初步的体外抗肿瘤活性表明,这些化合物对乳腺癌MCF-7和MDA-MB-231细胞展现出了良好的抑制活性,尤其是化合物查尔酮单元的苯环以对位吸电子基或杂环取代有更好的抗三阴性乳腺癌活性,其中2-噻吩基取代化合物5q(IC50=5.1 μmol·L-1)对MDA-MB-231细胞展现出了最强的抑制活性,分别是阳性药物5-FU(IC50=9.6 μmol·L-1)和他莫昔芬(IC50=17.8 μmol·L-1)的1.8和3.4倍。此外,目标化合物对正常的MCF-10A无明显细胞毒性,并低于参考药物5-FU和他莫昔芬。这些研究结果表明,将四氢苯并噻吩并嘧啶酮和查尔酮活性单元拼接能够得到新的抗乳腺癌杂合物,这为今后探索新型抗肿瘤化合物积累了宝贵的经验。
