TaqMan-rRT-PCR检测猪霍乱沙门菌方法的建立和实验室评价
2021-06-03张景山闫梅英樊粉霞
张景山,李 旭,闫梅英,阚 飙,樊粉霞
猪霍乱沙门氏菌是非伤寒沙门菌的一种,是引起仔猪副伤寒的主要病原菌[1-2],也容易侵染人[3],人感染后主要表现为高热及菌血症等全身性感染症状[2-4],但临床症状不典型,很难与伤寒及副伤寒沙门菌引起的肠热症及其他非沙门菌引起的人类发热症状区分,如布鲁氏菌病、钩端螺旋体病、斑疹伤寒及侵袭性金黄色葡萄球菌感染等。在发达国家,沙门菌引起的腹泻仍是公共卫生问题,但血液感染伤寒及非伤寒沙门菌的病例很少;在非洲,非伤寒沙门菌感染引起发热病例很常见[5];在我国,也有猪霍乱沙门菌引起败血症的报道[6-8]。
利用沙门菌增菌液进行细菌分离培养是传统鉴定猪霍乱沙门菌的方法[9-11]。对分离得到的疑似菌落进行生化及血清型凝集鉴定,需要3~5 d,耗时费力,同时血清凝集反应及酶联免疫吸附试验(ELISA)等存在交叉反应、特异性不高及敏感性低等一些问题,这样很容易引起病例漏诊、误诊而延误治疗。ELISA法诊断猪霍乱沙门菌比传统的方法时间短[12],但猪霍乱沙门菌与丙型副伤寒沙门菌两者的抗原式相同,均可引起血液感染,且利用血清凝集试验以及ELISA诊断疑似样本时会出现交叉[13],最终准确鉴别还需要特殊生化反应[14]。沙门菌血清分型鉴别主要基于细菌细胞壁脂多糖(O抗原)和鞭毛抗原(H抗原)[15],鞭毛抗原的编码基因两端在不同血清型沙门菌间高度保守,中间区域高度变异,有时能够根据变异区基因序列找到特异引物用于区分不同的血清型[16],但高度变异的特性作为分子检测靶标时也存在结果不准确的隐患。寻找简单、特异的单基因分子诊断方法对猪霍乱沙门菌的快速灵敏诊断以及鉴别排除十分必要,也是传染病检测、监测和应急中亟待解决的关键问题。
已有研究利用核酸扩增(PCR)检测猪霍乱沙门菌的报道[17-18],但一般是用样本DNA为模板进行扩增。由于DNA可能是来源于处于感染状态的活细菌,也有可能是来源于死亡细菌的DNA残留,如果检测标本是原始样本,在不能培养出菌株的情况下,无法最终判断阳性样本中细菌处于活的状态还是死亡细菌残留的DNA,导致假阳性结果。另外,PCR检测不同血清型沙门菌,也需要以特异基因片段作为靶标。本研究经过不同血清型沙门菌基因组序列分析,筛选到猪霍乱沙门菌的保守、特异基因SC0358,根据SC0358的基因序列,设计基于TaqMan方法的逆转录实时聚合酶链反应(reverse transcriptional real-time polymerase chain reaction, rRT-PCR)所用引物和探针,简写为TaqMan-rRT-PCR,进而验证基因及方法的特异性,并优化反应体系,以纯菌、血样本模拟等分析了反应体系的敏感性,建立了快捷、特异和高灵敏的诊断猪霍乱沙门菌的TaqMan-rRT-PCR检测方法。
1 材料与方法
1.1猪霍乱沙门菌特异基因寻找和引物探针设计 根据以往的研究[19],我们对猪霍乱沙门菌的特有基因进行了筛选,数据的分析过程简述为:利用R脚本,分析比对GenBank中所有猪霍乱沙门菌已知序列,初步获得这些全基因组序列共有的基因序列,再将这些共有序列与其他血清型沙门菌及人类基因组(人类EST库)进行比对分析,最终获得猪霍乱沙门菌特异基因SC0358。分析过程中,判定基因是否存在的标准为:基因序列一致性若<50%,则认为该基因不存在;若≥50%,则认为该基因存在。根据猪霍乱沙门菌参考菌株SC-B67(NC_006905.1)中SC0358基因(Gene ID: 3332775)序列,利用Beacon Designer软件设计相应的TaqMan-rRT-PCR引物(表1)。
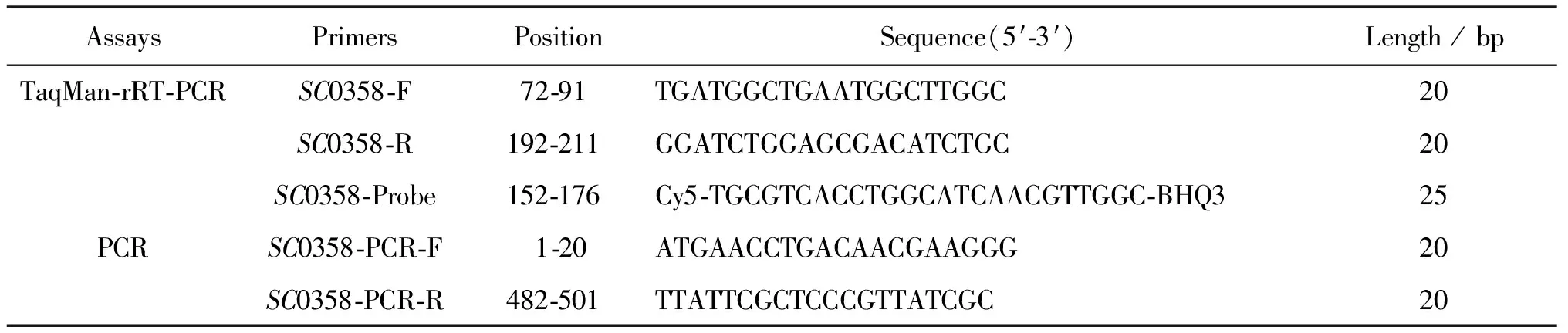
表1 实验所用引物
1.2实验用菌株及培养 本研究所用菌株均来自中国疾病预防控制中心传染病预防控制所,所有菌株均经过生化及血清型(群)鉴定。其中伤寒沙门菌(S.Typhi)10株、甲型副伤寒沙门菌(S.ParatyphiA)4株、乙型副伤寒沙门菌(S.ParatyphiB)2株、丙型副伤寒沙门菌(S.ParatyphiC)20株、猪霍乱沙门菌(S.Cholerasuis)26株、阿贡纳沙门菌(S.Agona)3株、肠炎沙门菌(S.Enteritidis)8株、鼠伤寒沙门菌(S.Typhimurium)8株、汤卜逊沙门菌(S.Thompson)4株、德尔卑沙门菌(S.Derby)4株、山夫登堡沙门菌(S.Senftenberg)2株、韦太夫雷登沙门菌(S.Weltevreden)2株、阿伯丁沙门菌(S.Aberdeen)1株、鸭沙门菌(S.Anatum)1株、火鸡沙门菌(S.Meleagridis)1株、圣地亚哥沙门菌(S.Sandiego)1株、乌干达沙门菌(S.Uganda)1株、肯塔基沙门菌(S.Kentukey)1株、梦得维的亚沙门菌(S.Montevideo)1株、斯坦利沙门菌(S.Stanly)1株、波摩那沙门菌(S.Pomona)1株、波茨坦沙门菌(S.Potsdam)1株、姆班达卡沙门菌(S.Mbandaka)1株、伊斯坦布尔沙门菌(S.Istanbul)1株、非丁伏斯沙门菌(S.Hvittingfoss)1株、利奇菲尔德沙门菌(S.Litchfield)1株、印第安纳沙门菌(S.Indiana)1株、盖茨黑德沙门菌(S.Gateshead)1株、维尔肖沙门菌(S.Virchow)1株、威廉斯堡沙门菌(S.Wilhelmsburg)1株、旺兹沃斯沙门菌(S.Wandsworth)1株、胥伐成格隆沙门菌(S.Schwarzengrund)1株、利文斯通沙门菌(S.Livingstone)1株、利物浦沙门菌(S.Liverpool)1株、斯坦利维尔沙门菌(S.Stanleyville)1株。另外,本研究也选用其他肠道常见病原菌O1、O139血清群霍乱弧菌(V.choleraeserogroup O1,V.choleraeserogroup O139)各2株、副溶血弧菌(V.parahaemolyticus)3株、志贺菌(Shigellaspp.)4株、致泻性大肠杆菌(DiarrhealE.coli)4株以及引起发热并可在血液标本中分离到的金黄色葡萄球菌(S.aureus)5株、肺炎链球菌(S.peumoniae)1株、伯氏疏螺旋体(Borreliaburgdorferi)1株、钩端螺旋体(Leptospira)1株、嗜肺军团菌(Legionella)1株、脑膜炎奈瑟菌(N.meningitis)1株、立克次体(Rickettsia)1株、布鲁氏菌(Brucella)3株等共29株作为伤寒沙门菌的特异性评价检测菌株。菌株培养所用培养基:肺炎链球菌(哥伦比亚血平板)、嗜肺军团菌(GVPC液体培养基)、伯氏疏螺旋体(BSK培养基)、钩端螺旋体(Korthof培养基)、脑膜炎奈瑟菌(血琼脂培养基)、立克次体(Vero-E6细胞培养)和布鲁氏菌(布氏琼脂),其余菌株均用Luria-Bertani培养基。
1.3反应体系与扩增条件 以提取的病原菌的RNA为模板,参照One Step PrimeScriptTMRT-PCR Kit(Perfect Real Time)试剂盒说明书(Takara, code No.RR064A),采用20 μL反应体系:10 μL 2×One Step RT-PCR Buffer Ⅲ(1×)、0.4 μL TaKaRa Ex Taq HS(5 U/μL)、0.4 μL PrimeScript RT Enzyme Mix Ⅱ、0.5 μL PCR Forward Primer(10 μmol/L)、0.5 μL PCR Reverse Primer(10 μmol/L)、1 μL 探针引物、RNA模板2 μL、5.2 μL 无RNase 水。使用CFX96荧光PCR仪对RNA样本进行反转录及核酸扩增,反应条件为:42 ℃ 5 min; 95 ℃ 10 s; 95 ℃ 5 s, 58 ℃ 20 s,40个循环。对于Ct值≤35的扩增结果判定为阳性。以相应的Ct值为纵坐标,横坐标为细菌浓度的对数值,绘制TaqMan-rRT-PCR标准曲线方程。
普通PCR反应体系:5 μL 10×扩增缓冲液(含Mg2+)、4 μL dNTP混合物(每种浓度为2.5 mmol/L)、上游和下游引物分别 1.5 μL(10 μmol/L)、1 μL Pfu(5 U/μL)、2 μL模板DNA(50 ng/反应)、35 μL ddH2O。反应条件为:95 ℃ 5 min,35个循环:95 ℃ 10 s,52 ℃ 30 s,72 ℃ 1 min,72 ℃ 5 min,25 ℃ 5 min。
1.4血模拟标本的制备及RNA提取 从平板上挑取新鲜培养的单克隆,液体振摇培养5 h,菌液浓度经平板计数(6.5×108cfu/mL),将培养液按10倍梯度系列稀释为101~106cfu/mL,分别用2 mL新鲜的人抗凝血与同体积的各浓度菌液混匀,室温放置30 min,作为全血模拟标本。对上述模拟标本进行猪霍乱沙门菌RNA的提取(QIAamp UCP PurePathogen Blood field test Kit,QIAGEN公司),将不加菌液的血液作为阴性对照组(NC)。
1.5纯培养细菌的RNA提取 将从平板上挑取的单克隆猪霍乱沙门菌过夜培养,第2天,按1∶100接种到新鲜的培养液里,菌液浓度为OD=0.6左右时,收集菌液,提取总RNA(RNeasy Minikit,QIAGEN公司)。对提取的总RNA进行浓度测定后,进行10倍梯度稀释,最后选取6个浓度梯度:0.005、0.05、0.5、5、50和500 pg/μL,每个浓度的样本各取2 μL作为模板,分析TaqMan-rRT-PCR反应体系的敏感性。
1.6细菌的DNA提取 挑取平板上的新鲜单克隆,接种到LB液体培养基中,菌液浓度为OD=0.6左右时,收集菌液,提取总DNA,按照相应试剂盒(QIAGEN)说明书操作步骤进行。
2 结 果
2.1TaqMan-rRT-PCR检测体系建立 根据筛选到的猪霍乱沙门菌的特异基因SC0358,设计普通PCR引物(表1),选取从我国不同地点及时期分离到的猪霍乱沙门菌,共计26株,提取DNA为模板,对SC0358进行全基因扩增,结果得到大小为501 bp的目的条带,随机选择5个PCR产物进行测序、比对分析,DNA序列一致率为100%,说明SC0358在猪霍乱沙门菌中高度保守。同时利用34种血清型116株沙门菌及29株非沙门菌进行扩增,结果均为阴性,说明SC0358是猪霍乱沙门菌的特异、保守的基因,可作为诊断猪霍乱沙门菌感染的分子靶标。利用软件Beacon Designer 设计针对该基因的TaqMan-rRT-PCR引物(表1),以猪霍乱沙门菌的纯菌样本提取的总RNA为模板进行扩增反应,最终确定的反应条件、引物用量及退火温度详见1.3(反应体系与扩增条件)。
2.2TaqMan-rRT-PCR特异性分析 以48种145株细菌为检测样本,进一步分析TaqMan-rRT-PCR引物的特异性,其中26株猪霍乱沙门菌检测结果均为阳性,沙门菌属的其余34种血清型90株菌扩增结果均为阴性,其他常见的腹泻症状致病菌及临床常见的发热病原菌扩增均为阴性。同时将这些样品进行了普通PCR检测,TaqMan-rRT-PCR与普通PCR检测结果一致。结果说明:根据SC0358基因序列,设计TaqMan-rRT-PCR体系检测引物,可很好的识别猪霍乱沙门菌,具有非常高的血清和菌种特异性,目前检测的菌株基础上分辨率可达100%。
2.3以纯菌样本RNA为模板的TaqMan-rRT-PCR敏感性分析 提取猪霍乱沙门菌纯培养物的RNA,按10倍梯度稀释后作为模板,检测TaqMan-rRT-PCR反应的敏感性,本实验重复3次,结果一致(图1A)。本研究结果显示检测SC0358基因的敏感性为5 fg/反应,大约为10个拷贝/反应。以反应Ct值为纵轴,以模板RNA的拷贝数的对数值为横轴,得到的标准曲线方程为:y=-1.53ln(x)+36.196,R2=0.999 6(图1B),说明引物的扩增效率很高。
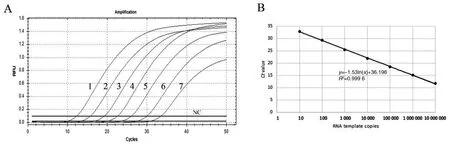
A:纯菌RNA样本TaqMan-rRT-PCR敏感性分析,提取的猪霍乱沙门菌总RNA经系列梯度稀释后,作为反应的模板。
2.4血液模拟标本中TaqMan-rRT-PCR敏感性分析 将猪霍乱沙门菌培养液按10倍梯度稀释至不同浓度后,与新鲜的血液混匀,室温放置后,从模拟血标本中提取猪霍乱沙门菌的RNA,用50 μL的无RNase的无菌水溶解每个样品的RNA产物,取其中2 μL作模板,进行TaqMan-rRT-PCR敏感性分析,进行了3次独立重复实验,结果一致。如图2A所示:以猪霍乱沙门菌特异基因SC0358为靶标的TaqMan-rRT-PCR反应体系检测血模拟标本的最低检测下限为25 cfu/mL。以反应Ct值为纵轴,模板RNA拷贝数的对数值为横轴,得到的标准曲线方程为:y=-1.546ln(x)+37.451,R2=0.989 3(图2B),说明引物的扩增效率很高。

A:血模拟样本RNA的TaqMan-rRT-PCR敏感性分析,提取猪霍乱沙门菌血模拟样本的总RNA经系列梯度稀释后,作为反应的模板。a: 2.5×106 cfu/mL;b: 2.5×105 cfu/mL;c: 2.5×104 cfu/mL;d: 2.5×103 cfu/mL;e: 2.5×102 cfu/mL;f: 2.5×101 cfu/mL;NC: 阴性对照。B: 模板浓度和Ct值之间的相关系数分析。
3 讨 论
靶标的特异性是分子诊断最关键一步。基于全基因组、多基因和单基因的病原菌检测技术都是基于病原菌的遗传物质DNA或RNA的特征识别。寻找病原微生物的特异基因并据此设计引物,通过荧光定量PCR检测病原菌仍旧是方便快捷、性价比高的检测手段。另外,当前基因组测序和生物信息学分析技术快速发展,大量病原微生物进行了基因组测序,病原基因组数据库包括的种类和数量也急剧增加,使得通过基因组数据库的比对、筛选到某种病原微生物的特异基因序列变得很容易。我们可以不经过大量菌株实验测试,只需将基因组数据库中存储的各类病原微生物基因组序列进行比对,就可以寻找、判断一种病原体的特异基因或片段序列。
目前,已建立通过检测编码特异抗原的基因鉴别病原菌的检测方法[13, 20-23],也有根据病原菌特有保守的非抗原基因的检测方法[24-25]。分子检测所选的靶基因应为待检病原微生物的特有识别序列,这是建立特异分子检测方法的基本要求。根据沙门菌毒力岛(SPI-1)三型分泌系统中编码伴侣分子的invB基因序列,设计检测猪霍乱沙门菌的PCR引物,虽然猪霍乱沙门菌可扩增出阳性目的条带,但扩增产物的特异性比较低,此序列与NC006905、AE008832、STU08279和AE017220序列同源性高达99%~100%[17],所以利用invB基因并不能直接区分猪霍乱沙门菌与其他血清型沙门菌,还需其他的血清学及生化实验辅助。
目前为止,经数据库序列比对,经本研究所用沙门菌属及临床症状类似的非沙门菌致病菌的核酸扩增筛选,确定SC0358基因是猪霍乱沙门菌的特异基因,SC0358编码DNA稳定蛋白。根据SC0358全基因序列,设计TaqMan-rRT-PCR的引物,能很好地区分猪霍乱沙门菌与其他常见的沙门菌血清型,此方法可应用于发热病原的鉴别诊断。
以TaqMan技术为基础建立的rRT-PCR方法检测猪霍乱沙门菌有明显的优势。首先,除内外引物外,还有探针序列,3条序列覆盖的3个区域可增加检测的特异性。其次,在临床和疫情现场,判断病例样本中是否存在活菌或处于应急感染期至关重要。TaqMan-rRT-PCR反应体系所用的模板为RNA,阳性结果表明处于感染期,致病菌处于活的状态,可排除死菌残留DNA的假阳性结果。另外,细菌染色体DNA为单拷贝,而基因转录产物mRNA具有明显多的拷贝数,因此,对于细菌相关基因转录的mRNA进行检测,具有提高方法敏感性和明确活菌感染的优势。最后,我们以猪霍乱沙门菌特有基因SC0358建立的TaqMan-rRT-PCR反应体系分析纯菌、血模拟样本的敏感性分别为5 fg/反应(大约为10个拷贝/反应)、25 cfu/mL,优于之前的检测体系[18-19]。
鉴于猪霍乱沙门菌是一类重要的人兽共患菌,也是食品安全中需要防范的病原菌;另外,猪霍乱沙门菌也可致血流感染,因此以发热和血液为标本进行病原微生物检测时,应作为一种筛查的病原体;又因为猪霍乱沙门菌在沙门菌血清型鉴定上难与丙型副伤寒沙门菌进行血清凝集鉴别,本研究建立的TaqMan-rRT-PCR检测猪霍乱沙门菌的反应体系,为解决上述问题提供很好的方法。本研究特异性和敏感性数据均来自猪霍乱沙门菌纯培养及血液模拟标本,将来需要进一步收集来自食品、临床病人或者动物的实际标本,对本研究建立的猪霍乱沙门菌TaqMan-rRT-PCR检测体系进一步验证和完善。
利益冲突:无
