降解AFB1的克雷伯氏菌分离、鉴定及降解机理初步研究
2021-06-01谢澳文韩一鸣李文靖张帅兵吕扬勇
谢澳文,樊 磊,韩一鸣,李文靖,王 乐,张帅兵,吕扬勇
河南工业大学 生物工程学院,河南 郑州 450001
黄曲霉毒素(aflatoxins, AFs)主要是由黄曲霉和寄生曲霉产生的一种聚酮合酶类(PKS)次级代谢产物。目前已获得鉴定的黄曲霉毒素有20多种,包括B、M等多个家族,其中AFB1具有较强毒性和致癌性,在食品中也最为常见[1-2]。长期摄入含有黄曲霉毒素的食物,可导致人体免疫力降低、肝功能损伤甚至诱发肝癌[3-5]。在一定的条件下,黄曲霉产生的AFB1常存在于玉米、花生等大宗农产品中,由此造成的污染而导致的直接或间接经济损失非常严重。因此,深入研究黄曲霉毒素脱毒方法及其降解机理对于进一步研究制定有效策略保证食品安全和人体健康具有重要意义。
目前,黄曲霉毒素的去除手段主要包括:物理方法如紫外照射[6-7]、高温处理、微波处理[8]、放射性元素[9]及电子束照射[10]、某些物质吸附[11]等;化学方法如酸处理、碱处理和氧化剂处理等[12-13]。然而,理化去除黄曲霉毒素的方法虽然能够去除AFB1,但存在成本高、有化学残留以及影响食品营养价值等弊端[14-16]。因此,利用生物法去除黄曲霉毒素已成为目前的研究热点之一,其机理是通过吸附作用或酶促反应降解毒素从而达到脱毒的目的[17-20]。比如Liu等[21]研究发现假蜜环菌胞内酶可将黄曲霉毒素转化成环氧化物,并最终打开双呋喃环从而脱毒;Afsharmanesh等[22]发现枯草芽孢杆菌UTB1在细菌素的生物合成过程中能够产生一种降解黄曲霉毒素的氧化还原酶,并对其降解基因进行了确证。在一定的条件下筛选得到降解酶的菌株,并通过发酵、分离纯化脱毒酶的研究技术已广泛应用于食品、饲料等领域[23]。通过生物法去除黄曲霉毒素的过程高效且反应是在温和的条件下进行,对于食品中的营养物质基本不会造成破坏或者只是极少破坏,因此应用前景广泛[24-25]。
作者选取自然界发霉的粮食、秸秆、牛粪以及土壤等样品,通过分离获得了多个具有降解黄曲霉毒素能力的菌株,通过薄板层析初步筛选出降解效果较好的菌株;通过发酵条件的优化,筛选降解菌株的最优培养基,对其发挥作用的降解酶进行质谱鉴定;对降解产物萃取后,通过液质联用(LC-MS/MS)获得降解产物的分子量,推断其可能的降解机理。
1 材料与方法
1.1 材料
发霉的花生、玉米、秸秆、土壤以及牛粪均采自郑州郊区的农田。Hormisch改良初筛培养基、LB培养基参考文献[26-27]。其余培养基如下。
SC培养基(g/L):蛋白胨 10.00、Glucose 5.00、K2HPO4·3H2O 0.10、KH2PO41.00、MnSO40.50、 MgSO4·7H2O 1.00,pH 7.0。
DJN培养基(g/L):蛋白胨 10.00、酵母粉 5.00、K2HPO4·3H2O 0.10、KH2PO41.00、MnSO40.50、MgSO4·7H2O 1.00、牛肉膏 3.00,pH 7.0。
DPN培养基(g/L):蛋白胨10.00、Glucose 5.00、K2HPO4·3H2O 0.10、KH2PO41.00、MnSO40.50、MgSO4·7H2O 1.00、牛肉膏 3.00,pH 7.0。
1.2 主要仪器与设备
1260型高效液相色谱仪:安捷伦科技有限公司;荧光检测器:岛津公司;MicrOTOF-QII质谱仪:布鲁克公司;UV-3100型分光光度计:上海美谱达仪器有限公司;恒温摇床:上海一恒仪器有限公司;5810R 型离心机:Eppendorf。
1.3 方法
1.3.1 AFB1降解菌的初筛与复筛
将5 g样品置于95 mL的无菌水中,加入玻璃珠,在室温条件下,160 r/min振荡1 h,获得悬浊液,取300 μL涂布于Hormisch改良初筛培养基,37 ℃恒温培养7 d,挑选在初筛培养基上生长良好的菌株进行划线分离,划线分离3次后,挑取单菌落保存至LB斜面备用。 菌种复筛参考孙粮等[24]的方法。
氯仿萃取之后,通过薄层层析法初步判断菌株发酵液的降解效果,高效液相色谱法测定降解率,筛选出降解效果最优的菌株。
1.3.2 高效液相色谱检测AFB1
样品前处理方法:以氯仿作为萃取剂,采用分步萃取的方式连续萃取3次,旋转蒸发后,用甲醇将萃取出的降解产物溶解,按照国家标准[28]采用液相色谱检测。
1.3.3 AFB1降解菌的鉴定
参考《伯杰氏细菌鉴定手册》[29]和《常见细菌系统鉴定手册》[30]进行属的鉴定。16 s rDNA基因扩增及PCR程序参考孙粮等[24]的方法。
将获得的测序结果在GenBank数据库中进行同源性比对,并在MEGA7中进行分析,计算相似性并采用Neighbor-Joining方法做系统发育进化树。
1.3.4 降解菌株最优培养基的选择
挑选降解效果较好的菌株在LB培养基中活化后分别接种于SC、DJN及DPN培养基中,重复1.3.2的步骤,通过HPLC对样品中AFB1的含量进行检测,并计算降解率。
1.3.5 降解AFB1成分分析
菌悬液及上清液的制备:取2 mL菌体发酵液,10 000 r/min离心2 min,收集上清液备用。菌体在无菌操作台中使用无菌水清洗2次,并重悬于2 mL无菌水中制得菌悬液备用。
上清液处理:(1)上清液中加入终质量浓度为0.01 g/mL蛋白酶K,室温下处理1 h;(2)上清液加入终质量浓度为0.01 g/mL SDS后处理6 h。分别在菌悬液,上清液,经过蛋白酶K、SDS处理后的上清液中加入AFB1,按照1.3.1所述方法进行降解试验并测定降解率。
1.3.6 不同培养基发酵上清液蛋白图谱及差异蛋白鉴定
SDS-PAGE的分离胶与浓缩胶的浓度分别为15%与5%,通过SDS-PAGE比较不同降解率的发酵液上清液中蛋白图谱的差异,筛选差异蛋白条带,切胶后送北京华大蛋白质研发中心进行质谱鉴定,详细方法参考文献[31]。
1.3.7 AFB1降解产物分析
以上清液加AFB1振荡0 h作为空白对照,按照1.3.2的步骤进行降解试验,在190~800 nm进行紫外全波长扫描,测定降解产物的紫外吸收波长。分别使用正丁醇、氯仿、乙酸乙酯等萃取剂对降解后的产物进行萃取,采用分步萃取的方式连续萃取3次,在55 ℃下进行旋转蒸发后,用甲醇将获得的降解产物溶解,在190~800 nm进行紫外全波长扫描,并将含有降解产物的甲醇溶液用于质谱检测。
2 结果与分析
2.1 菌株的筛选及鉴定
通过初筛从样品中得到了46株降解株,对这些菌株进行AFB1降解试验。结果显示,从土壤中筛选出的N1菌株对AFB1有较好的降解效果,通过16S rDNA基因(图1)及生理生化(表1)鉴定,结果表明该菌属于克雷伯氏菌属。

图1 N1的系统发育进化树

表1 菌株N1的生理生化试验结果
2.2 降解AFB1最佳培养基筛选及降解成分分析
N1菌株在SC、DPN、DJN培养基中的发酵上清液对AFB1的降解率存在差异,分别为57%、36%、74%,因此,将DJN培养基确定为最佳培养基,在后续的降解试验中采用该培养基进行发酵。
未处理的发酵上清液对黄曲霉毒素的降解率达到了74%,远高于菌体悬液对黄曲霉毒素20%的降解率,表明N1菌株对黄曲霉毒素的降解能力以上清液为主,菌体的吸附作用存在但不明显。在上清液经过蛋白酶K、SDS处理后,对黄曲霉毒素的降解能力大幅度下降,分别为10.56%和0。由此推断上清液中对黄曲霉毒素具有降解能力的物质可能为胞外酶。
2.3 AFB1降解酶的初步推断
3种培养基上清液对AFB1降解率不同,同时初步确定降解物质为胞外蛋白,因此,通过SDS-PAGE电泳对胞外蛋白图谱进行表征,考察不同培养基发酵上清液蛋白图谱的差异,以期对目标酶作初步分析,结果如图2所示。

图2 不同培养基发酵上清液的蛋白图谱
图2表明,N1菌株在3种培养基的发酵上清液中胞外蛋白图谱差异性不明显,但在DJN培养基的发酵上清液中蛋白条带的浓度相比SC与DPN稍高。通过比较发现,相比于另外2种培养基,23 kDa处蛋白条带浓度较高且完整地分布在DJN发酵培养上清液中,因此选择该分子量完整单一的①号条带进行切胶回收,并送至北京华大蛋白质研究中心进行质谱鉴定。根据数据库比对结果,并结合已有文献报道的黄曲霉毒素降解酶,综合分析该条带,初步推断对应的酶可能为Mn-超氧化物歧化酶(SodA)或NADH-醌氧化还原酶(NuoB),在后续试验中需要做进一步的蛋白分离鉴定,或者用基因克隆、异源表达等实验手段确定其种类。
2.4 降解产物萃取及检测
按照1.3.1的步骤进行降解试验,降解结束后对降解体系进行紫外全波长扫描,结果显示在波长为310 nm左右具有较强的紫外吸收峰(图3a)。
图3结果表明,氯仿和乙酸乙酯萃取产物的全波长扫描结果与整个降解体系不同,在310 nm左右没有吸收峰(图3b和3c),只有正丁醇萃取的产物在该波长处具有较强紫外吸收峰,说明降解产物存在其中(图3d)。
2.5 LC-MS/MS检测降解产物的分子量
将正丁醇萃取液经过旋转蒸发,甲醇溶解后进行液质联用检测,在负离子模式下甲醇及降解产物的粒子流如图4所示。结果表明,甲醇溶液的粒子流背景噪声较低,满足测试要求,而正丁醇萃取产物则在保留时间为2.6 min有单一峰出现,其他杂质峰不明显。
对保留时间为2.6 min峰的物质和可能的降解产物进行分析,结果见图5。该峰对应的二级质谱图(图5a)显示其分子量为241.1,根据碎片峰提示,推测该降解产物的结构式如图5b所示。研究表明黄曲霉毒素结构中的苯环结构相对比较稳定,很难被破坏,而呋喃环上的 8、9 位双键部位则容易被破坏,该功能双键是黄曲霉毒素与蛋白和DNA形成等复合体的作用位点,也是导致基因突变和致癌的主要功能基团[32]。此外,文献[20]报道黄曲霉的内酯键、甲氧基和环戊烯酮也能够被破坏,从而降低其毒性。降解之后的结构式(图5b)与黄曲霉毒素B1原始结构相比,呋喃环上的 8、9 位双键被破坏,这与文献[21,24]报道的一致;除此之外12位的甲氧基也被去除,其进一步的结构需要采用核磁共振来确定。

图3 N1菌株发酵上清液降解黄曲霉毒素B1产物全波长扫描图
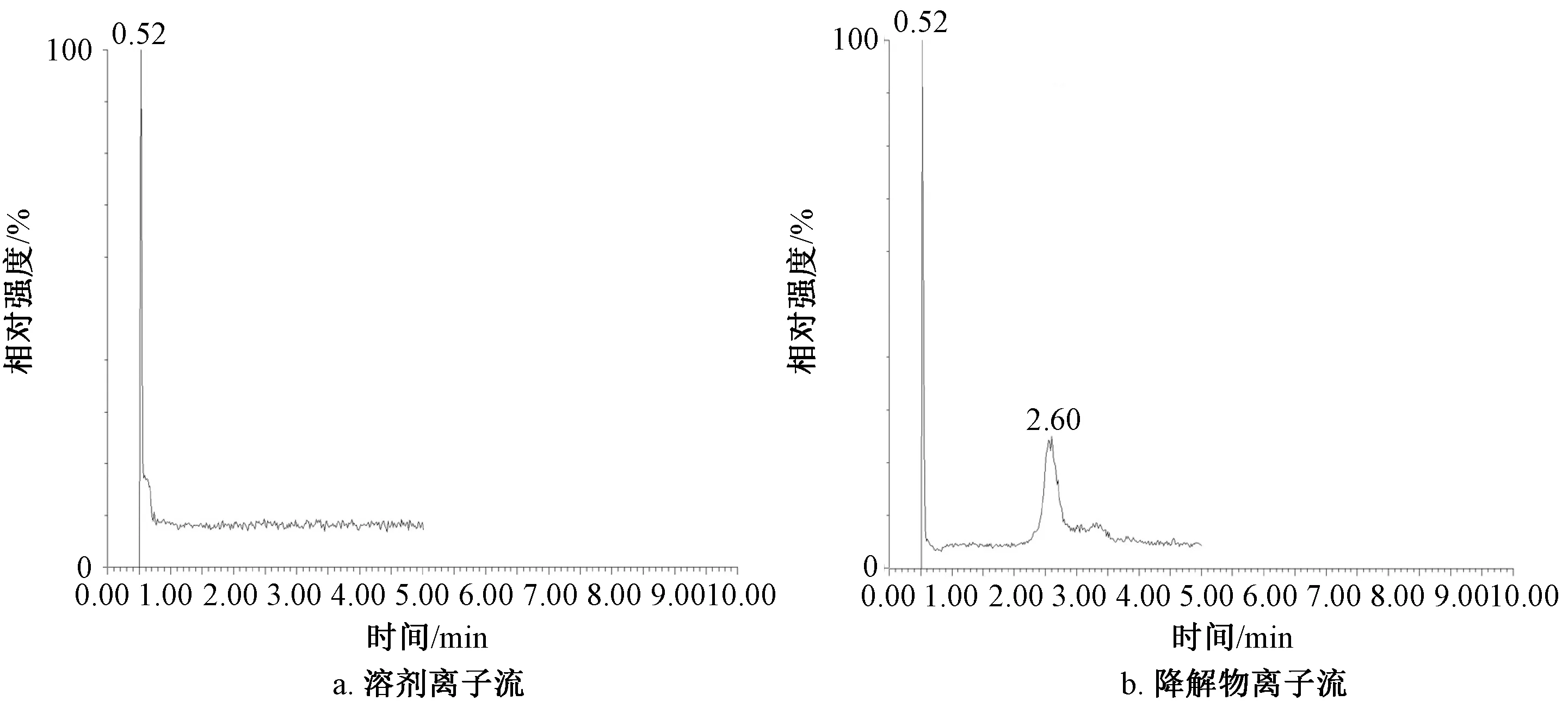
图4 降解产物负离子模式下粒子流图

图5 降解产物的二级质谱图及推测的结构式
3 讨论与结论
以黄曲霉毒素结构类似物香豆素为唯一碳源,从土壤中筛选出一株对AFB1具有良好降解能力的菌株N1,经过分子生物学鉴定为克雷伯氏菌属。目前对AFB1具有降解能力的大部分是枯草芽孢杆菌、铜绿假单胞菌、乳酸菌等,而克雷伯氏菌属报道相对较少,只有最近王威等[33]做过类似研究。研究发现该N1菌株在DJN发酵液中的上清液对AFB1降解效果最好,在37 ℃、72 h内降解率为74%,初步分析其降解成分为胞外酶,胞外蛋白差异条带的鉴定结果显示:该酶可能为超氧化物歧化酶或者NADH -锟氧化还原酶,后期还需要对该蛋白进行异源表达、分离纯化以及降解效果分析等以明确其种类。降解产物的分析结果表明,通过正丁醇萃取能够获得降解产物,表明通过胞外酶的作用,黄曲霉毒素结构发生了变化,呋喃环上的 8、9 位双键以及12位的甲氧基被破坏,降解产物的极性增大,亲水性加强,LC-MS/MS结果显示该降解产物的分子量为241.1,推测其呋喃环发生了变化,这与已有文献报道的作用位点一致。本研究结果为进一步分离纯化该胞外酶,继而进行异源表达从而大规模获取该蛋白并应用于工业生产提供了基础数据。
