虎榆软膏治疗变应性接触性皮炎小鼠模型的药效学及作用机制
2021-05-27刘丹夏笔军文思何皎叶理宫灿仪邱苗芳
刘丹,夏笔军,文思,何皎,叶理,宫灿仪,邱苗芳
1.南方医科大学皮肤病医院,广东 广州 510091; 2.广州市妇女儿童医疗中心,广东 广州 510623
皮炎、湿疹是由遗传、环境、内分泌、神经、感染等多种因素引起的表现为不规则性丘疹以及糜烂和水疱等的炎症性皮肤病,包括变应性接触性皮炎(allergic contact dermatitis,ACD)、湿疹和特应性皮炎等。Ⅳ型变态反应参与其发病机制。虎榆软膏为本院制剂,主治亚急性、慢性皮炎湿疹。为了进一步验证其疗效,本实验通过建立小鼠急性、慢性ACD模型,探索该药对皮炎、湿疹的治疗作用,并从免疫炎症角度探讨其作用机制,为临床开展应用虎榆软膏治疗皮炎、湿疹提供理论依据。
1 材料与方法
1.1 实验动物、药物、试剂及仪器
实验动物:C57小鼠60只,雌性,7~8周龄,体重18~23 g[广东省医学实验动物中心,合格证号NO. 44007200027365,许可证号SCXK (粤) 2013-0002],实验室通风良好,温度20~25 ℃,相对湿度40%~60%。
药物及试剂:虎榆软膏(批号20200302)、虎榆软膏阴性对照(批号20200302)、氢化可的松乳膏(批号20200228),均由我院制剂室配制。2、4-二硝基氟苯(DNFB,阿拉丁,批号L1705138);逆转录试剂盒(TaKaRa,批号AJ60795A);qPCR试剂盒(TaKaRa,批号AJ61478A),TNF-α、IL-1β、IL-6、IL- 4、IL-17引物(北京六合华大基因科技有限公司)。
仪器:高速冷冻离心机(5424R,Eppendorf),旋涡振荡仪(VORTEX-5,Qilinberier),千分尺(精密度0.001 mm,三量量具),光学显微镜(CX31,OLYMPUS),电子天平(MS-105,瑞士梅特勒),打耳器(YLS-Q4,山东省医学科学院设备站),小动物麻醉机(德国CK),微量分光光度计(NANODROP ONE,Thermo scientific),多功能皮肤屏障检测仪(MPA580,德国Courage and Khazaka公司),RT-PCR仪(CFX Connect Real-time System,BIO-RAD),荧光定量PCR仪(T100 Thermal Cycler,BIO-RAD)。
1.2 方法
1.2.1 急性、慢性ACD模型的建立与给药 将60只C57小鼠分为急性、慢性各5组,每组6只。分别为空白对照组、模型组、虎榆软膏组、阳性组、基质组。按参考文献[1-4]建立模型及给药。急性模型:5组实验前1 d每只小鼠下腹部剃毛3 cm×3 cm范围,第1 d于该脱毛部位涂50 μL 0.5% DNFB丙酮橄榄油溶液(4 ∶1)致敏,空白对照组涂空白溶剂, 5 d后每只小鼠右耳内外侧各均匀涂10 μL 0.2% DNFB溶液进行激发,空白对照组涂空白溶剂,每天1次,连续激发两次。1 d后右耳开始给药,基质组给予空白基质,虎榆软膏组给予虎榆软膏,阳性组给予氢化可的松乳膏,一天2次。
慢性模型:5组实验前1 d每只小鼠下腹部、背部剃毛3 cm×3 cm范围,第1 d于下腹部脱毛部位涂50 μL 0.5% DNFB丙酮橄榄油溶液(4 ∶1)致敏,5 d后50 μL 0.2% DNFB激发背部,每隔1 d激发1次,共激发14次,空白对照组涂空白溶剂。每次激发后2 h给药,空白对照组、模型组不给药,基质组给予空白基质,虎榆软膏组给予虎榆软膏,阳性组给予氢化可的松乳膏,一天2次。
1.2.2 检测指标 HE与甲苯胺蓝染色:急性ACD模型小鼠耳部、慢性ACD模型小鼠背部皮肤组织标本置于固定液中,经石蜡包埋固定,制成5 μm 的薄层切片,HE、甲苯胺蓝染色。在高倍光学显微镜下观察各组小鼠皮肤组织病理学改变。皮肤屏障功能检测:慢性ACD模型小鼠末次激发24 h后,置小动物麻醉机中麻醉,多功能皮肤屏障检测仪测量背部皮肤角质层水合力(stratum corneum hydration,SCH)、透皮失水量(transdermal water loss,TEWL)、pH值。
耳厚度和耳重量差:急性ACD模型小鼠在激发前、末次激发24 h,千分尺分别测量小鼠耳厚度,计算耳肿胀度;处死小鼠,打耳器打下左右耳,十万分之一天平称量左右耳质量,计算左右耳质量差。
脏器指数:慢性ACD模型小鼠末次激发48 h后,称量小鼠体重,处死小鼠,取脾脏称重,计算脏器指数。
TNF-α、IL-1β、IL-6、IL- 4、IL-17 mRNA表达量检测:取慢性ACD模型小鼠背部皮肤置于triozol中,提取总RNA,逆转录成cDNA,qPCR检测,引物序列如下:TNF-α F:5′-TCAGTTCCATGGCCCAGAC-3′,R:5′-GTTGTCTTTGAG-ATCCATGCCT-3′;IL-1β F:5′-GCAACTGTTCCTGAACTCA-ACT-3′,R:5′-ATCTTTTGGGGTCCGTCAACT-3′;IL-6 F:5′-TAGTCCTTCCTACCCCAATTTCC-3′,R:5′-TTGGTCCTTAGCCACTCCTTC-3′;IL- 4 F:5′-AC-AGGAGAAGGGACGCCAT-3′,R:5′-GAAGCCCTACAGACGAGCTCA-3′;IL-17 F:5′-TCGCCATTCAGCAAGAAATCC-3′,R:5′-CACAGGTGCAGCCAAC-TTTTA-3′;GAPDH F:5′-TCCCTCAAGATTGTCAGCAA-3′,R:5′-AGATCCACAA-CGGATACATT-3′。Real-time PCR反应扩增条件为:94 ℃ 60 s,52 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 10 min。
2.3 统计学分析
采用软件SPSS 17.0进行统计学处理。两组间耳肿胀度、耳重量差、SCH等比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 虎榆软膏对急性ACD模型小鼠耳病理学改变的影响
从HE染色看,与空白对照组相比,模型组小鼠耳表皮角化过度、增厚,海绵水肿,血管扩张,充血明显,真皮以单核细胞浸润为主,可见淋巴细胞和嗜酸性粒细胞,表明急性ACD造模成功;与模型组相比,虎榆软膏组和阳性药物组表皮增厚程度减小,水肿减轻,单核细胞浸润减少,真皮血管扩张充血现象缓解,基质组未见缓解。从甲苯胺蓝染色看,模型组和基质组小鼠肥大细胞数量多于空白对照组,虎榆软膏组肥大细胞数量少于模型组,见图1。
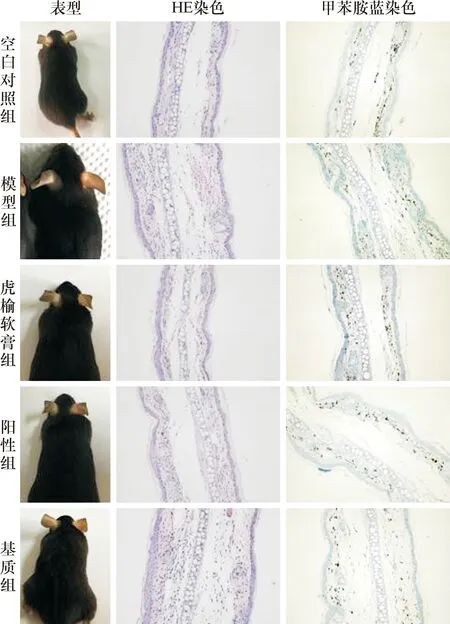
图1 急性ACD小鼠及耳组织病理图片(200×)Fig. 1 Acute ACD mice and histopathological images of ears (200×).
2.2 虎榆软膏对急性ACD模型小鼠耳肿胀和耳重量差的影响
模型组末次激发后24 h耳肿胀较空白对照组明显升高 (t=25.33,P<0.01),左右耳质量差增大(t=8.23,P<0.01),表明急性ACD造模成功。与模型组相比较:虎榆软膏组、阳性组、基质组耳肿胀度均明显降低,差异有统计学意义(t值分别为16.46、20.00、6.202,P值均<0.01);虎榆软膏组、阳性组左右耳质量差均明显减小(t值分别为4.62、5.71,P值均<0.01),基质组左右耳质量差增大,但差异无统计学意义(t=2.19,P=0.060)。表明虎榆软膏对急性ACD有明显作用,详见表1。

表1 虎榆软膏对急性ACD模型小鼠的影响Tab.1 Effects of Huyu ointment on acute
2.3 虎榆软膏对慢性ACD模型小鼠皮损及皮肤病理学改变的影响
相对于空白对照组,模型组小鼠背部皮肤增厚、水肿、红斑,表明慢性ACD模型小鼠造模成功,虎榆软膏组和阳性组小鼠皮肤增厚、水肿、红斑状况均改善。从HE染色看,与空白对照组相比,模型组和基质组小鼠背部表皮增厚,海绵水肿,血管扩张,炎性细胞增多;虎榆软膏组和阳性药物组表皮增厚程度减小,水肿减轻,炎性细胞浸润减少,真皮血管扩张现象缓解。从甲苯胺蓝染色看,模型组和基质组小鼠肥大细胞数量多于空白对照组,虎榆软膏组肥大细胞数量少于模型组,见图2。
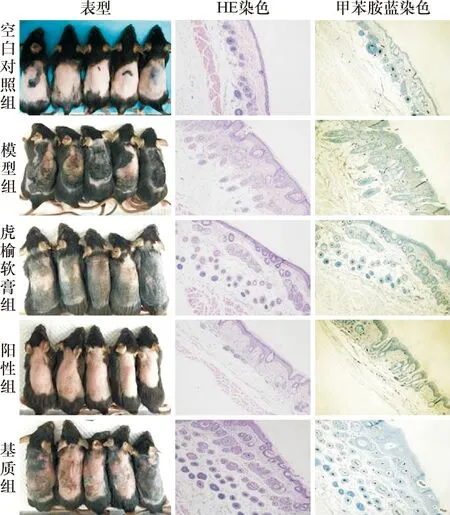
图2 慢性ACD小鼠及背部皮肤组织病理图片(200×)Fig. 2 Chronic ACD mice and histopathological images of back slin (200×).
2.4 虎榆软膏对慢性ACD模型小鼠皮肤屏障功能的影响
SCH:与空白对照组比较,模型组小鼠明显下降(t=13.77,P<0.05);与模型组比较,虎榆软膏组明显升高(t=7.78,P<0.05)。TEWL:与空白对照组比较,模型组小鼠明显升高(t=9.21,P=0.001);与模型组比较,虎榆软膏组明显降低(t=3.12,P=0.014)。pH值:各组小鼠皮肤pH值无明显差异(P值均>0.05),见表2。
2.5 虎榆软膏对慢性ACD模型小鼠脾脏指数的影响
与模型组比较,空白对照组、虎榆软膏组和阳性组脾脏指数均明显下降,差异有统计学意义(t值分别为5.22、3.18、6.05,P值均<0.05),基质组无明显变化(t=1.81,P=0.109)详见表2。
表2 小鼠皮肤屏障功能指标及脾脏指数Tab.2 Indexes of skin barrier function and spleen index in
2.6 慢性ACD模型小鼠炎症因子TNF-α、IL-1β、IL-6、IL- 4、IL-17 mRNA的表达
相对于模型组,虎榆软膏组TNF-α、IL-1β、IL-6、IL- 4、IL-17 mRNA表达量明显降低(t值分别为3.39、2.16、15.53、20.24、2.82,P值均<0.05),表明虎榆软膏能抑制慢性ACD模型小鼠炎症因子的分泌,详见表3。
表3 不同组别细胞因子mRNA的表达量Tab.3 mRNA expression of cytokine in different
3 讨论
DNFB诱导下的小鼠ACD模型是研究变应性接触性皮炎的经典模型[5],已有数十年的历史。本研究中,HE染色后观察急性ACD模型小鼠耳部、慢性ACD模型小鼠背部皮损组织的病变程度,发现模型组表皮增厚,海绵水肿,血管扩张,充血,炎性细胞增多,与空白对照组比较差异明显,说明本实验造模成功。
皮炎、湿疹病程长,难治易复发,严重影响患者的生活质量。目前临床上用于治疗皮炎、湿疹的激素类药存在各种副作用,因此寻找安全有效的药物具有重要临床意义。中药外治皮炎、湿疹以清热解毒为主,虎榆软膏由虎杖、地榆、苦参、冰片组成,诸药合用,共奏清热解毒、燥湿止痒,敛疮生肌之功。虎杖为君药,有多种药理作用,包括抗病毒、抗菌、抗炎、抗氧化、促进创面愈合等作用[6-7],主要成分白黎芦醇有抗炎及免疫活性[8-10]。地榆收敛止血,可有效减轻创面液体渗出,是一种无毒抗炎活性很强的中药[11-13]。苦参清热燥湿,杀虫、利尿,抗感染抗炎,苦参制剂也被广泛用于皮肤科[14-16]。冰片凉血清热止痛,防腐止痒,为佐使。现代药理学研究表明,冰片具有抗细菌、真菌、消炎镇痛等药理作用[17]。各单味药的抗炎作用为虎榆组方药理机制的研究提供了理论依据。
本研究结果显示,虎榆软膏对急性、慢性ACD小鼠模型均有较好的疗效。慢性ACD模型在持续4周的用药过程中未发现药物的不良反应,证明外用虎榆软膏安全有效。皮肤屏障功能和皮肤组织中炎症细胞因子mRNA表达量检测结果显示,外用虎榆软膏能修复皮肤屏障,降低皮肤中炎症因子表达量,其作用机制可能与修复皮肤屏障,调控Th1、Th2免疫应答,降低炎症因子有关。提示虎榆软膏可开发成为一种较好的治疗皮炎、湿疹的非激素外用药。
