禽流感病毒跨种传播机制的研究进展
2021-05-20汪秀会
汪秀会
(河北工程大学,邯郸 056000)
AIV(Avian influenza virus,AIV)作为一种重要的人畜共患病病原,严重威胁着畜禽养殖业及人类的公共卫生安全。通常情况下,AIV由于对人唾液酸受体的亲和性较低而不能直接感染人。但自1997年,香港发生了首例人感染高致病性H5N1 AIV的事件后[1],人感染 H9N2、H7N7、H7N3等AIV的事件时有发生。2013年初,我国华东地区首次出现了人感染H7N9 AIV的疫情,并迅速在多个省份发生;同年,陆续发生了H6N1(台湾地区,仅1例)和H10N8(江西,感染3例,死亡2例)AIV感染人事件;2014年开始出现H5N6 AIV感染人事件(四川、广东和云南陆续出现病例)。AIV(1994年,H9N2;1996,H5N1)感染我国禽群的20多年里,给我国的养殖业造成了巨额损失;连续不断的AIV感染人事件的出现,给公共卫生带来了巨大的压力和挑战,因此,加强AIV跨种传播机制的研究迫在眉睫。
1 流感及流感病毒
流感是由流感病毒引起的人或动物的呼吸道疾病,是一种传染性强、传播速度快的人兽共患病,多发于温度骤变的春秋季节。流感病毒可通过空气中的飞沫、人与人之间、人与动物之间、动物与动物之间的接触或接触被污染的物品而传播。流感病毒一般不会引起机体的死亡,多于发病3~4 d后体温逐渐恢复,症状好转,但很容易引起并发症,造成其他细菌病毒的同时感染,最后因急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)和(或)多脏器衰竭而造成机体死亡。
流感病毒属于正黏病毒科流感病毒属的单股负链RNA病毒,有囊膜,其上含有致密地镶成规则毛边样的纤突。初次分离的流感病毒呈杆状或丝状,长度可达400 nm。在体外多次传代后,病毒有球状、椭圆状、杆状、丝状等多种形态,直径一般在80~120 nm。按照不同的分类标准,流感病毒可划分为不同的类型。按照核蛋白(nuclear protein,NP)和基质蛋白(matrix protein,MP)的不同,流感病毒分为A型(甲型)、B型(乙型)和C型(丙型)3种。其中A型流感病毒根据其表面的血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的不同,可划分为16个HA亚型和9个NA亚型。HA和NA之间可以随机组合,其组合形式可达上百种。其中H1N1、H2N2、H3N2亚型主要感染人,其他亚型流感病毒可感染家禽、猪、牛、犬等。根据感染宿主范围的不同,A型流感病毒又可划分为AIV、猪流感病毒(Swine influenza virus,SIV)、马流感病毒(Equine influenza virus,EIV)、牛流感病毒(Bovine influenza virus,BIV)、犬流感病毒(Canine influenza virus,CIV)等。其中AIV根据其致病性的强弱又可分为高致病性禽流感病毒(Highly pathogenic avian influenza virus,HPAIV)、低致病性禽流感病毒(Low pathogenic avian influenza virus,LPAIV)和无致病性禽流感病毒(None pathogenic avian influenza virus,NPAIV)。B型流感病毒仅感染人,仅引起局部流行;C型流感病毒可感染人和猪,表现为散发,近年从狗体内也分离到了该病毒。2011年已从猪体内分离出了该病毒,此后研究者发现牛是D型流感病毒的主要“病毒储存库”[2]。2016年,国际病毒分类委员会执委会批准命名了一种新病毒—D型流感病毒,并认为该病毒是流感病毒的一个新属,与A、B和C型流感病毒存在一定的差异。
流感病毒基因组由8个分节段的单股负链RNA(PB2、PB1、PA、NP、HA、NA、M、NS)组成,主要编码PB2、PB1、PB1-F2、PA、HA、NP、NA、M1、M2、NS1和NEP共11种蛋白。此外,PB1-N40、PA-X、PA-N155、PA-N182、M42和NS3等蛋白也在近几年陆续被发现,但这些蛋白的功能尚不清楚[3]。流感病毒一般在鸡胚尿囊液中进行增殖。组织培养过程中最常用到的是犬肾细胞(madin-darby canine kidney,MDCK)。组织培养过程中可以产生细胞病变(cytopathic effect,CPE)。流感病毒的抵抗力不强,56℃条件下灭活30 min可以使其失活,在室温下不易保存,但在0~4℃时可以存活数周左右。
2 禽流感的危害
禽流感是由A型流感病毒引起的一种禽类的急性出血性传染病,主要以呼吸道疾病和隐性感染为特征。能够引起禽流感的流感亚型主要有H5N1、H5N2、H5N6、H7N1、H7N7及H9N2等,其中H5和H7可引起高致病性禽流感。
禽流感不仅给养殖业带来了难以估计的损失,同时还可以在自然条件下感染多种哺乳动物,包括猫[4]、海豹[5]、狗[6]、高原鼠兔[7]、恒河猴[8]等。随着候鸟迁徙以及活禽市场的存在,AIV之间以及AIV和季节性流感病毒之间很容易发生重组。截止到目前,包括H1N1、H2N2和H3N2在内的季节性流感,已经有14种A型流感可以感染人(图1)。禽流感通常会引起高死亡率,一般介于30%~70%[9]。
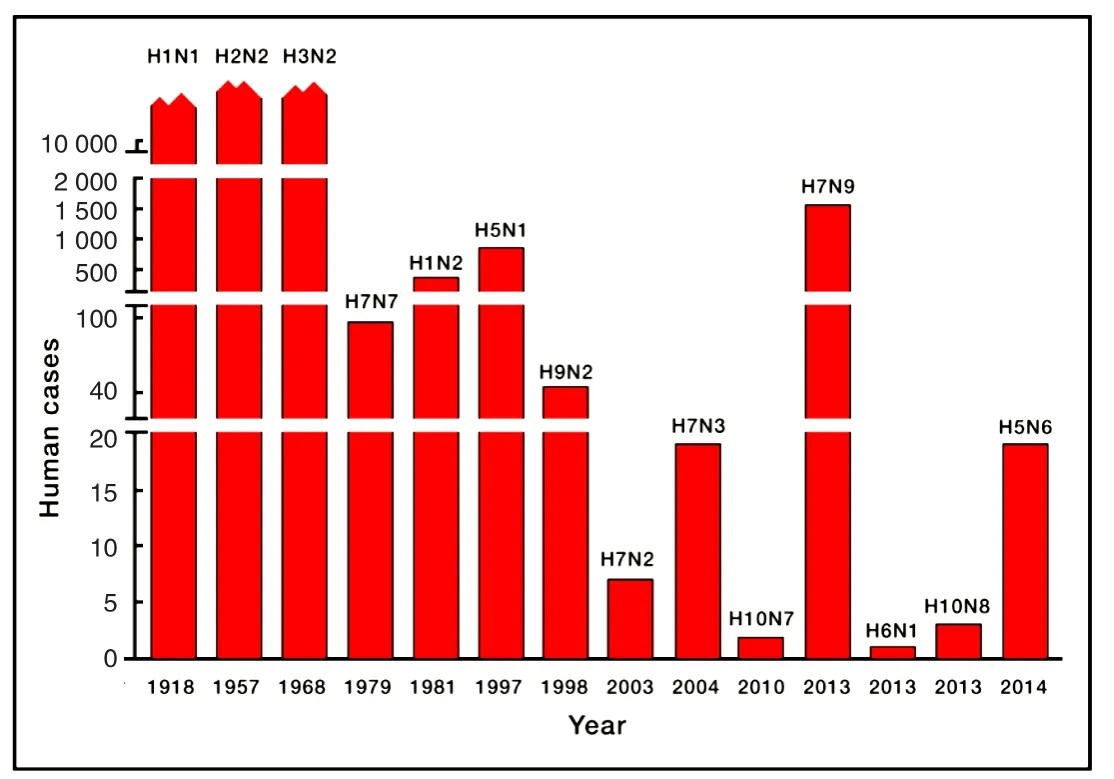
图1 可感染人的亚型流感病毒[9]Fig.1 Human infections with subtypes of Influenza A viruses[9]
3 流感病毒的基因组结构及功能
3.1 非结构蛋白NS1和NS2的结构及功能 流感病毒基因组片段8编码NS1和NS2蛋白,包含2个有重叠的开放阅读框(open reading frame,ORF),即一个大的ORF和一个小的ORF,两者有部分重叠。NS1(26 kDa)由大的ORF编码,含有207个氨基酸,不含有内含子序列,编码28-648位核苷酸;NS2是一个含有121个氨基酸残基、大小为14 kDa的多肽,编码该段的核苷酸包含内含子,因此是由mRNA拼接而成。
NS1和NS2蛋白在感染的细胞内大量存在,而不存在于病毒粒子中。其中,NS1蛋白主要在核内,NS2则主要在胞浆内。A型流感病毒的NS1蛋白可与病毒的RNA结合,在RNA开始转录后发挥独特的调节功能。在缺乏干扰素(interferon,IFN)反应的细胞(如Vero细胞)内,NS1蛋白的有无对病毒复制影响并不大。研究表明,NS1蛋白作为辅助因子,对宿主体内IFN介导的反应具有非常重要的作用[10]。NS1蛋白在复制过程中具有调节作用,在翻译后产生磷酸化,能与胞质中的多聚核糖结合,然后分布在胞核中。NS2蛋白主要在病毒的繁殖后期大量合成,含有1个核定位信号区[11],在病毒组装过程中对核糖核蛋白(ribonucleo protein,RNP)在胞核和胞浆之间的运输起一定作用。
3.2 基质蛋白M1和M2的结构及功能 流感病毒基因组片段7可编码基质蛋白M1和离子通道蛋白M2,其中M1蛋白(27.8 kDa)含有252个氨基酸残基,M2蛋白是含有97个氨基酸残基的多肽,与M1的编码区部分重叠,但具有不同的ORF框。M2核苷酸中含有内含子序列,故该编码区转录的mRNA需要经过转录后的加工修饰等过程。此外,基因组片段7还可能存在第3个编码区M3,编码仅9个氨基酸的多肽。
M1蛋白约占总蛋白质的40%,是流感病毒颗粒中含量最为丰富的蛋白,也是病毒的主要结构蛋白,具有型的特异型。M1蛋白抗原性的差异是流感病毒分型的依据之一。现已发现M1蛋白能够与RNP相互作用,并且在控制转录、病毒粒子的组装过程中能与HA、NA和M2蛋白的胞浆尾部相互作用[12]。
M2蛋白由97个氨基酸残基组成(约15 kDa),N端的前9个氨基酸与M1蛋白相同。M2蛋白插入病毒囊膜形成四聚体离子通道,在病毒脱壳期间将质子转入病毒粒子。M2蛋白的离子通道活性与膜内pH值有关,pH值低时M2蛋白被激活,M2蛋白功能的改变或丧失会直接影响病毒的复制。研究发现AIV M2蛋白依靠二硫键维持一个四聚体形式,从而形成一个质子通道,控制高尔基体内的pH值。由于M2蛋白形成跨膜离子通道部位的氨基酸序列在人、马、猪、禽等流感中高度保守,因此M2蛋白是很好的流感疫苗靶标蛋白。
3.3 血凝素(hemagglutinin,HA)的结构及功能HA作为流感病毒主要的表面蛋白,是一种插入到病毒囊膜的Ⅰ型膜蛋白。流感病毒的HA与细胞表面的受体结合并且诱导膜融合进而开始感染。由于HA的蛋白酶切位点是HA具有感染性的第一步,因此HA的酶切非常重要。在相关酶的作用下,HA的前体HA0被切割成HA1和HA2,然后激活融合能力[13]。切割位点位于同一个环上,这个环突出于HA的表面。由于HA的氨基酸序列和环的构象在不同亚型的流感病毒中存在差异,因此,这些不同也就决定了HA会被不同的蛋白酶进行切割。
HA是A型流感病毒致病性的主要决定因素。HA的切割能力依赖于宿主蛋白酶。其中,高致病性AIV在蛋白酶作用位点具有多个碱性氨基酸裂解位点,而低致病性和哺乳动物流感病毒只具有单个碱性裂解位点。HA蛋白酶敏感性差异和酶的组织专一性的差异是呼吸道感染病毒以及感染的系统性传播的重要决定因素。人流感病毒和AIV的唾液酸受体具有特异性,其中前者主要结合α-2,6-唾液酸受体,后者主要结合α-2,3-唾液酸受体,而目前的研究已经表明,在人的组织中也包含AIV的受体。由于季节性流感和人兽共患的流感病毒所结合的唾液酸受体的特异性,以及在人的呼吸道中不同受体二代分布情况存在的较大差异,在一定程度上决定了流感症状的严重程度。
3.4 神经氨酸酶(neuraminidase,NA)的结构及功能 NA是流感病毒表面的另外一种很重要的蛋白,是一种Ⅱ型膜蛋白。NA的结构分为头部和颈部,其主要功能是促进病毒粒子的成熟与释放,从而促进病毒粒子的传播和流行。NA还能够裂解呼吸道黏膜中的唾液酸,使呼吸道黏液的活性减弱,从而有助于病毒颗粒移向靶细胞,促进病毒渗入呼吸道上皮细胞及其在呼吸系统的扩散。
近几年的研究表明,NA颈部区域存在很大的不同。通过对GenBank中的N1序列分析发现,根据N1颈部区域的不同可以将其划分为6种不同的类型[14]。为了验证NA颈部区域对流感病毒的生物学重要性,研究人员以WSN为骨架,在NA的颈部区域进行缺失、插入或者突变,结果发现NA颈部的长度可以发生变化,并且其颈部长度与病毒的复制能力和致病性有关。
3.5 核衣壳蛋白(nucleocapsid protein,NP)的结构和功能 核衣壳蛋白由基因片段5编码,是一种重要的结构蛋白。NP是构成病毒核衣壳的重要成分,在病毒的感染周期中具有非常重要的作用。在NP上,共含有三个核定位信号位点(nuclear localization signal,NLS)[15]。NP包含两个主要的领域:头部和身体区域。这两个域被一个带负电荷的槽分开,这个槽与RNA结合有关。病毒在合成RNA的过程中,NP对病毒从转录到复制过程具有非常重要的作用,体内和体外病毒感染实验均证明,如果缺乏可溶性的NP蛋白,病毒则不能从转录向复制模式转换[16]。NP蛋白在流感病毒中是一个高度保守的结构蛋白,在病毒进化的过程中不容易发生突变。
3.6 聚合酶蛋白的结构和功能 流感病毒的RNA依赖的RNA聚合酶是由PB1、PB2和PA三个亚基组成的三聚体(图2)。RNA聚合酶复合体在流感病毒基因组的复制和转录过程中起着举足轻重的作用。研究表明,PB1通过其N端与PA相连,通过其C端与PB2相连,因此PB1位于聚合酶复合体的中心位置。PB1、PB2和PA三种蛋白均是在核糖体内合成的,合成后,PB2蛋白可单独入核,而PB1蛋白和PA蛋白则需要形成二聚体后才能够由细胞质进入细胞核内[17]。
图2 A型流感病毒聚合酶的结构和功能区[17]Fig.2 Structure and functional domains of the influenza A virus polymerase[17]
PA亚基与其他蛋白没有显著的相似性,并且PA蛋白功能在很长一段时间都不是很清楚。随着PA蛋白N末端结构域的揭示,人们才明白,PA蛋白N末端是核酸内切酶的活性亚基。通过水解单股RNA和单股DNA,证实结晶域具有真正的核酸内切酶活性。位于构成聚合酶三聚体的PA活性位点的结构突变表明,RNA依赖的核酸内切酶活性在病毒复制过程中具有保守性。
PB1亚基,相对于PA和PB2亚基的研究,对PB1结构的研究还不够具体。聚合酶结合的中心区域是基于RNA依赖的聚合酶的保守区域的特点所预测的。之前的研究表明,PB1的N端区域与PA的C端区域相连,而且这一现象已经通过PA的C端的结构被证实。在PB1的另一端,PB1的C端与PB2的N端相连。近期的一项结晶结构表明,PB1的C端的86个氨基酸与PB2的N端的37个氨基酸是如何紧紧连接在一起的[18]。尽管它的结构很小,但是,在不同的AIV和人流感病毒中他们相互作用的区域是高度保守的。并且这个区域还有可能是一个药物作用靶点。
PB2亚基包含两个区域,其中一个区域是449-495位氨基酸,该区域的主要功能是使得PB2蛋白能够进入细胞核,另一个区域位于PB2蛋白的羧基端,是一个核定位信号,由两部分组成,位于736-739位氨基酸和752-755位氨基酸[19]。正是由于这两个区域的存在,才确定了PB2蛋白在核中的定位。PB2蛋白通过C端的核定位信号,与α-输入蛋白结合后进入细胞核。PB2亚基起初被验证为具有帽子结合作用的亚基。后经过突变确定PB2帽子结合的作用实际却是将其与中心残留物Phe-363和Phe-404隔离开来[20]。这一结论与之前的研究是不一致的。在该亚基上还可以获得其他信息,比如核质转运。与PA蛋白一致的是,PB2的蛋白序列相似性不高。利用这一特点就可以通过序列比对的方法来确定PB2蛋白上的结构域。但研究发现,可溶性的PB2不能完整地表达,因此关于PB2的研究进展缓慢。
4 AIV跨种传播的影响因素
流感病毒蛋白上发生适应性的点突变是AIV跨种传播适应新宿主的一种重要方式。而大部分的适应性点突变出现在负责流感病毒复制和转录的RNP复合物上。其中,PB2蛋白上存在的一些氨基酸,是影响流感病毒致病性的重要因素,对病毒的复制、致病性或跨宿主传播能力等,具有一定的影响,涉及到的位点包括E627K、D701N、A588V、Q591K、S714R、Q591R、M147L、T271A、G590S、E158G等。而且,一些新的适应性关键氨基酸位点仍然在不断被发现,说明PB2蛋白在流感病毒的基因结构和功能上均起到了举足轻重的作用。
4.1 PB2蛋白的627K位点 PB2蛋白的627K位点为最常见的哺乳动物适应性位点,也是目前流感研究的热点之一。该位点在H5N1、H7N7、H9N2、H7N9以及H10N8等亚型的流感病毒中均可检测到,且通常会导致致死性的结果。Hadjetz等[21]研究表明,含PB2 627K的流感病毒对哺乳动物的适应性与宿主的核输入蛋白importin α1及α7有关,沉默这两种蛋白的表达后,流感病毒的聚合酶活力大大降低,importin α7的敲除鼠也表现出了对627K病毒更强的抵抗力。Weber等[22]研究表明,627K适应哺乳动物与其对宿主天然免疫相关的RIG-I蛋白的拮抗有关。Long等[23]报道了一种新的与PB2 627位点相关的宿主蛋白ANP32A,哺乳动物细胞内ANP32A蛋白的33个氨基酸的缺失限制了627E病毒的复制与转录,而这种限制能被627K所克服。Steven等[24]研究表明,存在于哺乳动物的ANP32A不能提高AIV聚合酶活性,而存在于绝大多数禽类中的ANP32A与哺乳动物的ANP32A在结构上存在显著差异,该差异对禽源ANP32A克服哺乳动物的宿主限制是必需且足够的[24]。
4.2 PB2蛋白的701N位点 除了PB2 627K外,PB2蛋白的701N也能增强H5N1、H7N7以及新型H7N9亚型AIV对小鼠的毒力。研究表明,含有701N的H1N1 SIV对哺乳动物的适应性具有重要作用。Liu等[25]研究发现,当H1N1 SIV中发生D701N突变时,病毒的聚合酶活性、复制能力,以及在小鼠中的致病性均提高,而病毒复制能力的提高与宿主细胞importin-α7的调控有关。
4.3 PB2蛋白的588V位点 同样位于PB2 627-domain的588位点,近年来也多有研究报道其与流感病毒哺乳动物的适应性相关。Zhao等[26]研究表明,PB2蛋白T588I的突变能增强甲型H1N1流感病毒在哺乳动物细胞的聚合酶活力、增殖能力,提高病毒对小鼠的致病性。而PB2蛋白的588T位点与147T、339T位点的联合作用使得H5N1 AIV对小鼠的致病性增强[27]。PB2蛋白的588V位点在H10N8、H7N9及H9N2等亚型的AIV中与小鼠致病性相关。这些结果表明,PB2蛋白的588位点是与病毒哺乳动物适应性相关的重要的位点。在前期研究中,沉默importin-α1、α3、α4、α5及α7五种核输入蛋白后,检测HEK293T细胞上聚合酶活力,我们发现,沉默importin-α1后,PB2 588V聚合酶活力显著下降,沉默其他蛋白则无下降现象[28]。
4.4 其他影响AIV对哺乳动物适应性的因素 其他亚型如 pdmH1N1 PB2蛋白591位的精氨酸(591R)、271 位的丙氨酸(271A)等能够独立增强流感病毒对哺乳动物的适应性[29]。同时,PB2蛋白与哺乳动物适应性相关的新的氨基酸陆续被发现,如H5N1 AIV的S714R、新型H7N9 AIV的K526R等[30-31]。除单个位点的作用外,多个位点联合作用导致AIV跨宿主传播的现象也在不断显现,并且当这些位点伴随着627K同时存在时,其对哺乳动物的致病能力大大提高[32]。以上研究表明,AIV适应哺乳动物宿主可能有更多新的突变形式存在。
除了PB2蛋白上的这些适应性标志外,随着流感疫苗的不断使用,流感病毒对宿主细胞的亲和性由α-2,3-唾液酸受体逐渐具有了与α-2,6-唾液酸受体结合的能力,这为流感病毒跨宿主传播奠定了基础。另外在PB1、PA、NP和NEP蛋白上的一些突变也对哺乳动物的复制和致病性具有提高作用[33-34]。
5 小结
AIV在我国禽群中的流行已经超过20年,并多次感染人。AIV跨越种间屏障感染哺乳动物与流感病毒基因组的结构特点密不可分,PB2蛋白是跨宿主传播最重要的因素之一。AIV给我国的养殖业造成了巨额损失,连续不断的AIV感染人事件的出现,给公共卫生带来了巨大的压力和挑战,因此,加强AIV跨种传播机制的研究显得尤为重要。
