山羊鼻内肿瘤病毒荧光定量PCR检测方法的建立及应用
2021-05-20肖霜艳翟少伦陈小文谢逸伦周秀蓉吕殿红温肖会贾春玲魏文康刘正飞
肖霜艳,翟少伦,陈小文,谢逸伦,周秀蓉,吕殿红,温肖会,翟 颀,贾春玲,魏文康,刘正飞
(1.华中农业大学动物医学院,武汉430000;2.广东省农业科学院动物卫生研究所 广东省畜禽疫病防治研究重点实验室 农业农村部兽用药物与诊断技术广东科学观测实验站,广州 510640;3.四会市畜牧兽医局,四会526200)
羊鼻内肿瘤病毒(Enzootic nasal tumor virus,ENTV)属于反转录病毒科β反转录病毒属,主要有山羊鼻内肿瘤病毒(Enzootic nasal tumor virus-2,ENTV-2)和绵羊鼻内肿瘤病毒(Enzootic nasal tumor virus-1,ENTV-1)两种类型,分别以山羊和绵羊为易感宿主[1]。1995年,在内蒙古首次发现我国的羊鼻内肿瘤(enzootic nasal tumor,ENT)病例[2]。
随着对ENT的调查研究发现,该病四季可发,存在地域性差异,可水平传播[3]。传染源主要是患病羊、带毒羊以及被污染的牧草等,可通过直接接触感染其他羊群。ENTV-2的检出率在0.5%~15%[4],致死率高达100%。目前,ENTV-2在我国内蒙古、湖南、四川、陕西、广东和重庆等地相继被检测出来,流行范围呈现扩大的趋势[2-3,5-7]。ENTV-2与ENTV-1、绵羊肺腺瘤病毒(Jaagsiekte sheep retrovirus,JSRV)以及内源性反转录病毒(Endogenous retrovirus,ERVs)在基因序列上有较高的同源性,可高达88%以上[8]。ENTV-2多分布在血液、拭子、组织等样品中,在血清中的拷贝数较低,这给ENTV-2的检测和鉴别带来了极大的挑战。实时荧光定量RT-PCR法特异性高、检测限低,适合应用于ENTV-2在血清中的检测[9-10]。本研究针对env基因设计特异性引物和探针,建立了检测ENTV-2的荧光RT-qPCR方法。
1 材料和方法
1.1 质粒、对照品及试剂 山羊鼻内肿瘤病毒阳性重组质粒由广东省农业科学院动物卫生研究所制备保存;病毒基因组提取试剂盒购自AXYGEN公司;一步法RT-PCR扩增试剂、胶回收试剂盒、E.coli DH5α感受态细胞、DL600 DNA marker购自TaKaRa公司;pGM-T载体、高纯度小提中量试剂盒购自TIANGEN公司;山羊痘活疫苗购自重庆澳龙生物制品有限公司;山羊痘与小反刍兽疫二联苗购自国药集团扬州威克生物工程有限公司;羊败血性链球菌病活疫苗购自青海生物药品厂有限公司;牛病毒性腹泻病毒毒株、边界病毒毒株、羊副流感病毒3型毒株由江苏省农业科学院兽医研究所毛立博士馈赠。
1.2 样品来源及处理 结合临床诊断与分子生物学诊断确诊为ENTV-2阳性的样品来源于广东省阳西县某山羊场,将采集鼻拭子置于装有2 mL、4℃预冷PBS的EP管中;反复冻融3次,取上清液后保存于-80℃,使用病毒基因组提取试剂盒提取病毒核酸。
1.3 引物探针设计 参考羊鼻内肿瘤病毒CQ1株(MK164400)、ENTV/CH/GT/2015株(MK210250)、GDQY2017株(MK164396)、E N T V 2-S C株(H M 1 0 4 1 7 4)、S h a n x i株(KU179192)、ENTV2株(AY197548)、enJSRV2-19株(EF680304)、ENTV-1NA1株(GU292317)、ENTV-1OVC株(KC189895)、JSRV株(M80216)和JSRV21株(AF105220)的全基因组序列,针对env基因设计特异性好、保守性高的引物和探针,预扩增片段大小为124 bp。由生工生物工程(上海)股份有限公司合成,其序列如下:ENTV2-F:5'-ATGGCAATAGTTTATATCTG CAAT-3';ENTV2-R:5'-GATGGCCTTGTATCAA CATAAATGG-3';ENTV2-Probe(探针):5'-FAM-ATATAAGAATCCCGTAACACCTACATCTC-BHQ1-3'。
1.4 目的基因的扩增 将上述阳性样品提取核酸,使用一步法RT-PCR试剂盒(TaKaRa)及引物ENTV2-F/R扩增目的片段。反应体系(25 μL):PrimeScriptTMOne Step Enzyme Mix 0.5 μL,2×One Step Buffer(Dye Plus)12.5 μL,上、下游引物各0.5 μL,RNase Free ddH2O 8 μL以及模板3 μL。反应程序:50℃ 30 min;95℃预变性5 min;95℃变性30 s,53℃复性30 s,72℃延伸30 s,共35个循环;72℃再延伸5 min。2.0%琼脂糖凝胶电泳分析扩增产物并纯化回收。
1.5 克隆及验证 将纯化目的片段与pGM-T载体连接,反应体系(10 μL)为:pGM-T 载体 1 μL、目的片段5 μL、T4 DNA Ligase 1 μL、10×T4 DNA Ligation Buffer 1 μL、ddH2O 2 μL;16℃连接过夜后,连接产物转化至E. coli DH5α感受态细胞,涂布于含IPTG和X-gal的氨苄平板上,37℃恒温培养12~16 h,挑取单个白色菌落接种于含氨苄的液体LB培养基中,37℃、200 r/min振荡培养12 h后,提取重组质粒pE-Ta送生工生物工程(上海)有限公司测序,比对测序结果。
1.6 一步法荧光RT-PCR检测方法的建立
1.6.1 退火温度优化 以阳性重组质粒pE-Ta为模板,反应体系(25 μL):PrimeScriptTM1 Step Enzyme Mix 0.5 μL,2×1 Step Buffer(Dye Plus)12.5 μL,上、下游引物与探针(10 μmol/L)各1 μL,RNase Free ddH2O 6 μL,模板2 μL。反应程序:50℃ 30 min;94℃ 2 min;98℃ 10 s,50℃~60℃30 s,45个循环,在退火过程中采集荧光信号。退火温度在50℃~60℃范围设置8个温度梯度,上述试验均设置3个重复。
1.6.2 引物及探针浓度优化 将引物及探针稀释至10 μmol/L,分别以0.1、0.25、0.5、0.75、1、1.25、1.5、2 μL阳性重组质粒pE-Ta为模板,加入1 μL(10 μmol/L)探针。按照上述体系及程序进行扩增。选择合适的引物浓度,加入探针(10 μmol/L)的量分别为:0.1、0.25、0.5、0.75、1、1.25、1.5、2 μL。其余试剂和反应程序同上,上述试验均设置3个重复。
1.6.3 标准曲线的建立 选取阳性重组质粒pE-Ta为模板,进行10倍倍比稀释(5.61×101~5.61×109copies/μL,9个梯度),用优化好的反应体系和程序进行检测,每个样品设置3个重复,并设置空白对照。根据起始模板浓度对数与反应的循环数(Ct值)的线性关系,建立一步法荧光RT-PCR检测方法标准曲线。
1.6.4 判定标准 以最低检测限浓度的质粒为模板,用所建立的一步法荧光RT-qPCR检测方法进行检测,设置15个重复,对获得的数据进行分析,结合灵敏度检测进行判定标准确定。
1.6.5 特异性试验 分别提取羊副流感病毒3型病毒、小反刍兽疫病毒与山羊痘病毒二联弱毒苗、山羊痘病毒弱毒苗、羊边界病毒血清与牛病毒性腹泻病毒液的相应病毒核酸作为对照组模板,以ENTV-2阳性血清中的ENTV-2核酸为阳性对照,参考方法确定的ENTV-2阴性的无症状肺组织为阴性对照,用所建立的一步法荧光RT-qPCR检测方法进行检测,同时设空白对照。
1.6.6 敏感性试验 以山羊鼻内肿瘤病毒阳性重组质粒pE-Ta为模板,进行10倍倍比稀释(5.61×100~5.61×109copies/μL),用所建立的一步荧光RTPCR检测方法进行检测,每个浓度设置3个重复,测定该方法的敏感性。
1.6.7 重复性试验 对不同浓度的阳性质粒(5.61×106、5.61×104、5.61×102copies/μL)分别进行批内和批间重复性试验。批内试验设置3个样本重复,批间试验分3次进行。对Ct值的平均值()、标准偏差(SD)和变异系数(CV)进行分析。
1.7 建立的一步法荧光RT-qPCR检测方法的临床应用 收集广东省内的山羊血清样品100份,其中疑似ENTV-2感染的样品8份,无临床表征的样品92份。提取核酸,采用本研究建立的一步荧光RT-PCR方法进行ENTV-2的检测,并进行数据统计与分析。
2 结果
2.1 目的基因扩增及验证 PCR扩增产物在琼脂糖凝胶电泳中可见1条约124 bp的条带,大小与预期片段相符(图1),并且测序结果与目的序列一致。
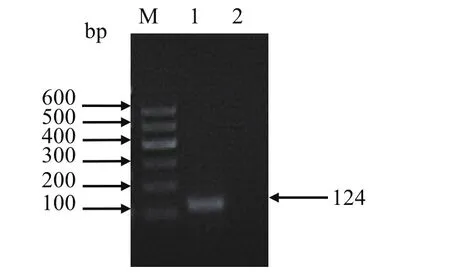
图1 ENTV-2目的基因的PCR扩增Fig.1 PCR amplification of ENTV-2 target gene
2.2 退火温度及引物探针浓度优化 通过对退火温度和引物探针浓度优化,在Tm 53℃时,Ct值最小,且扩增效率最高;引物和探针的终浓度分别为0.5、0.6 μmol/L时,所对应的Ct值最小,且绝对荧光信号强度最高。
2.3 标准曲线建立 该方法的扩增动力学曲线如图3A所示。以标准品浓度对数值为横坐标,Ct值为纵坐标,由系统计算得到相对应的标准曲线(图3B),标准曲线方程为:y= -3.26x+14.23,R2=0.999,E=102%。结果表明,Ct值与标准品浓度的对数线性关系较好。
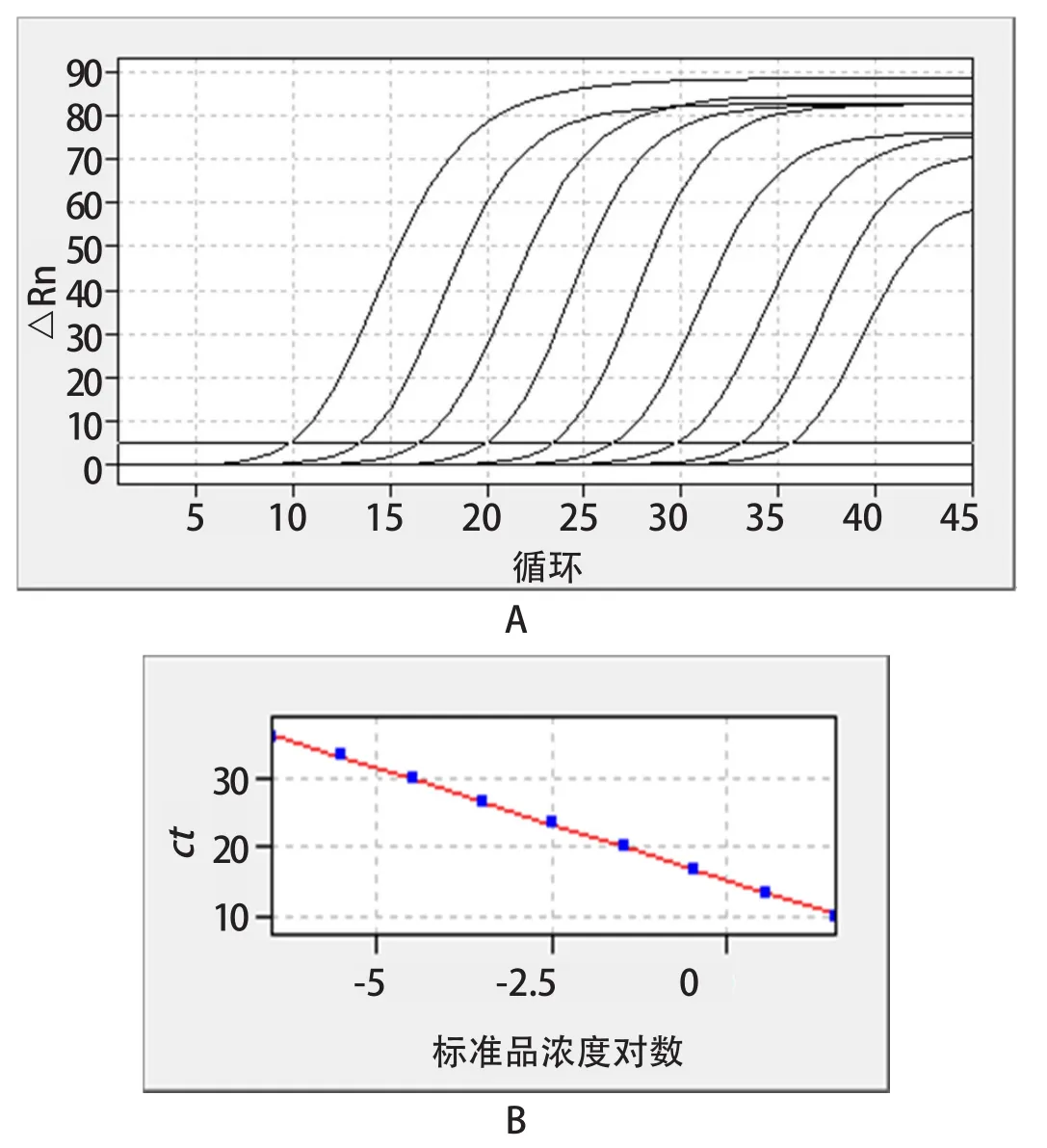
图2 一步法荧光RT-qPCR的扩增动力学曲线与标准曲线Fig.2 One step fluorescence RT-PCR amplification kinetics curve and standard curve
2.4 结果判定 Ct值≤40,且出现明显的S型扩增曲线,判定为阳性;无Ct值,且无扩增曲线判定为阴性;40<Ct值≤42,有扩增曲线,判定为可疑,重复试验后,有Ct值和扩增曲线判定为阳性。
2.5 特异性试验 山羊鼻内肿瘤病毒阳性对照出现S曲线并有Ct值(24.27),曲线①;山羊痘病毒、小反刍兽疫病毒、牛病毒性腹泻病毒、边界病毒、羊副流感病毒三型、阴性对照与空白对照均未呈现明显的S曲线且无Ct值,曲线②。表明本研究建立的针对ENTV-2一步法RT-qPCR检测方法具有良好的特异性,结果见图3。
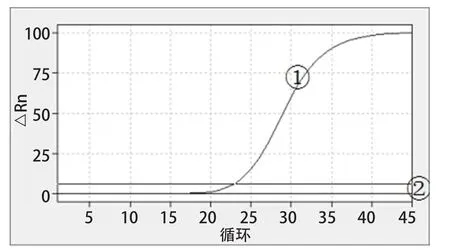
图3 特异性试验结果Fig.3 Specificity test results
2.6 敏感性试验 结果显示,本研究建立的针对ENTV-2的一步法荧光RT-qPCR检测方法的最低检测限为5.61 copies/μL,表明该方法的灵敏度高,最右侧蓝紫色扩增曲线对应的质粒浓度为5.61 copies/μL(图4)。
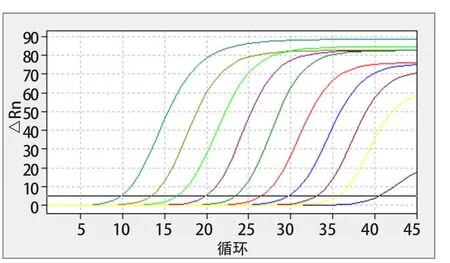
图4 敏感性试验扩增曲线Fig.4 Sensitivity test amplification curve
2.7 重复性试验 根据批内试验获得的Ct值计算平均值、标准偏差、变异系数,并分析数据,可知该方法批内重复性较好,CV均小于1.0%(CV≤5%,试验数据有效),该方法重复性较好。根据批内试验获得的Ct值计算平均值、标准偏差、变异系数,并分析数据,可知该方法批间重复性较好,CV均小于1.5%(CV≤5%,试验数据有效),结果见表2。

表1 批内试验结果Table 1 Intra-batch test results

表2 批间试验结果Table 2 Inter-batch test results
2.8 临床样品检测结果 收集广东省内的山羊血清样品100份,其中疑似ENTV-2感染的样品8份,无临床表征的样品92份。采用本研究建立一步荧光RT-qPCR对其进行检测,共检查出ENTV-2阳性样品10份,该检测结果与Apostolidi等[11]建立的方法检测结果一致,阳性样品检测结果见表3。ENTV-2的阳性部分样品扩增曲线如图5所示,阳性对照Ct值为25.67,阳性样品Ct值为29.35,阴性对照无Ct值。
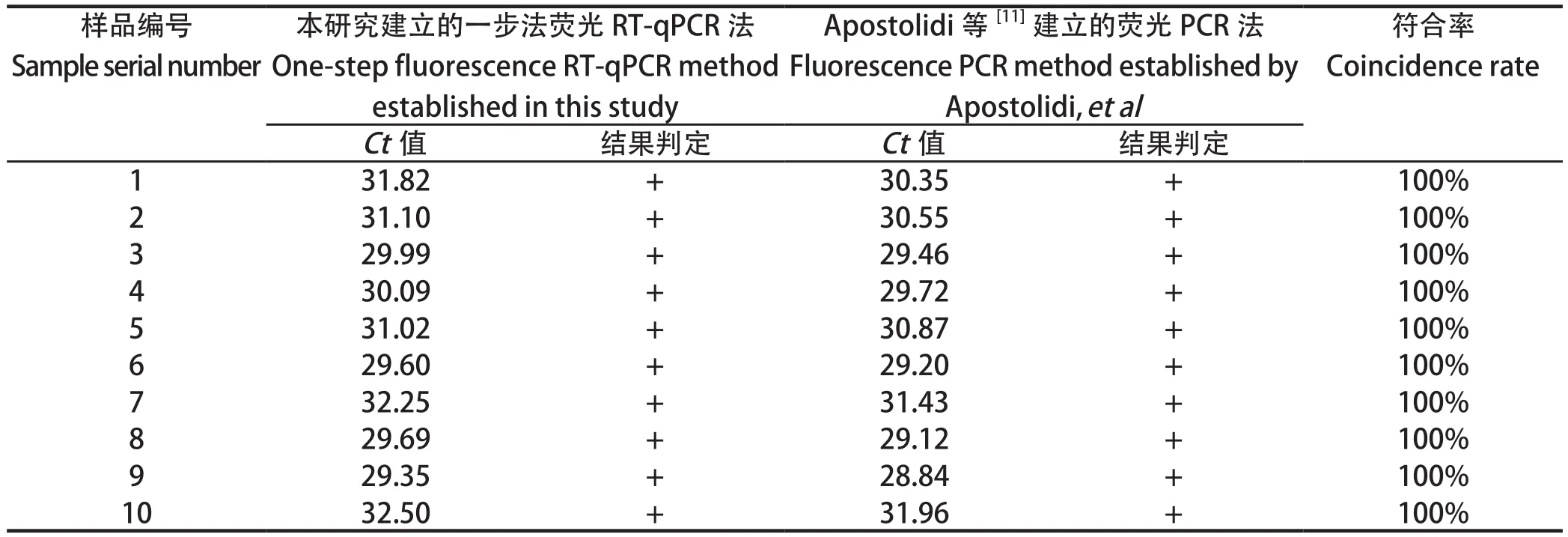
表3 临床比对试验Table 3 Clinical comparison test
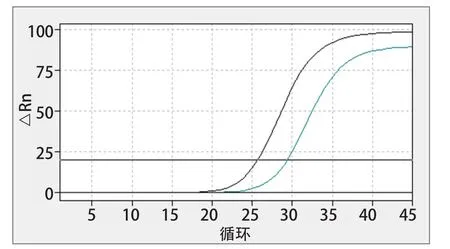
图5 临床样品检测扩增曲线Fig.5 Clinical sample detection amplification curve
3 讨论
ENT的防控主要存在以下几个问题:在预防方面,由于ENTV-2能够对机体产生免疫抑制作用,目前还没有研究出相应的疫苗;在治疗方面,市场上未发现针对ENT治疗的特效药,采取手术治疗的方式,发现该方法在难度、实用性及预后的评价等方面均较低[12];在诊断方面,ENT的潜伏期与病程长短不一,表现出症状的羊只年龄为3个月~5岁龄[3],且其临床症状与感冒初期症状相似,在临床诊断上易与感冒混淆。目前,国内外已经建立的ENTV-2荧光实时定量PCR检测方法主要有两种:第一种是基于TaqMan探针法建立的实时荧光TaqMan法,引物及探针设计是基于希腊7株已知的ENTV-2毒株基因组设计的,反应程序最低耗时为2.25 h,检测限为2×102RNA转录本[10];第二种是基于Eva Green新型染料建立的实时荧光定量PCR,检测限为30个拷贝数,该方法使用的染料为新型染料,相对于SYBR Green染料其特异性高,成本低,但特异性与实时荧光TaqMan法相比较低[13]。本研究建立的一步法荧光RT-qPCR检测方法的引物与探针设计基于已知的来源于不同地区不同时期的ENTV-2毒株全基因组,与前两种方法比较,其检测限低(5.61 copies/μL),特异性高,重复性好,变异系数均低于2%(0.09%~1.11%),耗时短,效率高,检测的范围大,对检测样品的核酸纯化要求低等优势。根据标准曲线方程,可以在已知待检样品Ct值的情况下,推算出待检样品的初始浓度,因此,该方法不仅可以进行定性检测还可以进行定量检测。
ENTV-2在广东省的检出率为10%(CI为4.9%~17.6%),有明显呼吸道症状的检出率为100%(CI 63.1%~100%),比无症状的检出率高出2.17%(CI 0.3%~7.6%)。当表现出典型的临床症状时,ENTV-2的检出率高。ENTV-2属于慢性传染性疾病,且较难诊断,所以在同一羊群中的流行率偏高,影响其流行率的因素还有养殖环境、方式和密度等。
总之,本研究建立的一步法荧光RT-qPCR检测方法为ENTV2的检测以及流行病学调查提供了可靠的技术支撑。
