在猪肺泡巨噬细胞上Notch信号通路调控LPS诱导的炎性反应研究
2021-05-20张彦兵魏建超邵东华李蓓蓓马志永邱亚峰
陆 艳,杨 义,张彦兵,魏建超,刘 珂,邵东华,李蓓蓓,马志永,邱亚峰
(中国农业科学院上海兽医研究所,上海 200241)
Notch信号通路作为一种进化过程中保守的信号通路,通过影响细胞的分化、增生、存活等在宿主发育中起着必要的作用[1]。在哺乳动物中,Notch信号通路由4个受体(Notch1、Notch2、Notch3和Notch4)以及5个配体(Jagged1、Jagged2、Dll1、Dll3和Dll4)构成。Notch信号通路为一种细胞间的信号通路,由不同细胞表面的受体和配体的相互作用而激活。具体为在配体与受体的细胞外区域结合后,胞内区(intracellular domain of Notch receptors,NICD)在蛋白酶(如γ-分泌酶)的作用下裂解,并释放入细胞核中;其中,在经典的Notch信号通路激活时,核内NCID与Notch信号通路的调控因子RBP-J结合,并招募相关的共激活蛋白(如CBP/p300等)调控下游靶基因(如Hey1等)的转录[2]。
Notch信号通路在免疫系统中也发挥着关键的作用,包括T淋巴细胞和B淋巴细胞的发育、T细胞功能调控、Th细胞的分化等。除淋巴细胞外,Notch信号通路影响DC细胞的调节作用以及巨噬细胞的激活[3-8]。有研究显示,TLR信号通路影响Notch信号通路中受体和配体的表达,继而通过Notch信号通路调控炎性因子的分泌以及巨噬细胞的激活[9]。由此可知,Notch-TLR相互协作促进TLR介导的巨噬细胞的激活以及炎性反应。
在人和小鼠上,Notch信号通路协同TLR调控炎性反应[3,10-11]。在猪源巨噬细胞上是否也存在Notch-TLR相互作用调控TLR诱导的炎性反应,目前还不清楚。本研究利用LPS处理猪肺泡巨噬细胞,分析LPS处理对Notch信号通路配体、受体以及下游靶基因表达的影响。此外,利用Notch信号通路抑制剂以及RBP-J基因沉默研究Notch信号通路对LPS诱导炎性反应的调控作用。本研究结果将为Notch信号通路在猪相关疾病中的作用奠定基础。
1 材料和方法
1.1 主要试剂 OPTI-MEM、EDTA、RPMI 1640培养基、胎牛血清、细胞用PBS缓冲液均购自Gibco公司;抑制剂DAPT和LPS购自SIGMA公司;RNAiso PLUS(Trizol)、PrimeScriptTMRT Master Mix(Perfect Real Time)、TB GreenTMPremix Ex TaqTMⅡ(Tli RNaseH Plus)均购自TaKaRa生物技术有限公司。Lipofectamine® RNAiMAX Reagent购自英潍捷基公司。
1.2 猪肺泡巨噬细胞的分离 实验用猪购自上海农科院猪场;猪肺泡巨噬细胞取自35~40日龄的健康仔猪,健康猪安乐死后,取出肺脏,用PBS缓冲液清洗后移入超净台,利用PBS(含EDTA)进行灌肺冲洗;4℃条件下将肺冲洗液300×g离心10 min,细胞利用RPMI 1640完全培养基重悬(含10%胎牛血清),计数后用于后续的实验。
1.3 DAPT抑制Notch信号通路 为了研究信号通路在LPS诱导的炎性反应中的作用,本实验选择DAPT(γ-分泌酶抑制)处理PAM抑制Notch信号通路。将新鲜制备的PAM细胞接种于24孔板,每孔1×106个细胞,过夜培养后,加入DAPT(终浓度为20 μmol/L),DMSO处理组为对照,预处理1 h后,加入LPS(1 μg/mL)或DMSO,继续培养6 h后收样。
1.4 RNA干扰 为了研究信号通路在LPS诱导的炎性反应中的作用,本研究采用RNA干扰沉默Notch信号通路调控因子RBP-J(siRNA序列见表1)抑制Notch信号通路的激活。按照上述的方法培养PAM,细胞贴壁后用1 μL RNAi MAX转染总体积为1.5 μL浓度为20 μmol/L的siRNA,于转染后66 h分别用LPS或DMSO处理,6 h后收样。
1.5 荧光定量PCR 根据Trizol Reagent的说明书,提取细胞的总RNA,利用PrimeScriptTMRT Master Mix试剂盒进行反转录,制备cDNA;随后,根据TB GreenTMPremix ExTaqTMⅡ的说明书配制荧光定量混合物,利用ABI 7500进行检测。以GAPDH为内标,计算percentage GAPDH的相对表达量(%GAPDH=100×2-ΔCT)以及差异倍数(Fold change=2-ΔΔCT)。所有统计学分析均使用t检验进行,P<0.05为差异显著,具有统计学意义,用“*”表示;P<0.01为差异极显著,具有统计学意义,用“**”表示。
2 结果
2.1 在PAM上,LPS处理激活Notch信号通路 已有研究显示,Notch信号通路参与调控LPS诱导的炎性反应[12-13],其主要是LPS处理影响了Notch信号通路中一些受体或配体的表达,继而这些改变的受体或配体激活Notch信号通路,最终,影响炎性分子的表达。在PAM上,LPS处理是如何影响Notch信号通路中受体或配体表达的,还不清楚。因此,本研究首先在PAM上分析了LPS处理对Notch信号通路中受体或配体表达的影响。结果显示,LPS处理后在转录水平上显著增加配体Jagged1、Jagged2和Dll4的表达(图1A),但LPS处理不影响受体的表达(图1B)。为了检测LPS处理对Notch信号激活的影响,本研究对Notch信号通路的下游靶分子的表达情况进行了检测。结果显示,LPS处理后在转录水平上显著上调Notch信号通路下游靶基因Hey1的表达(图1C)。以上结果说明,LPS处理通过增加配体的表达激活Notch信号通路。
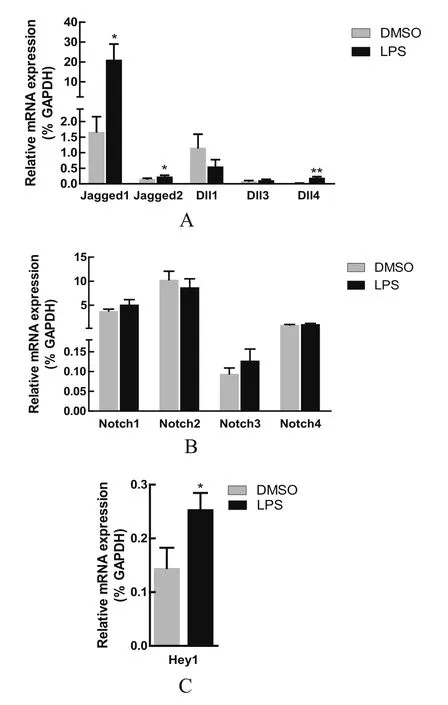
图1 Notch信号通路组分在猪肺泡巨噬细胞中的表达Fig.1 Expression of Notch signaling components in primary porcine alveolar macrophages
2.2 在PAM上,Notch信号通路抑制剂处理降低LPS诱导的炎性反应 在LPS处理激活Notch信号通路的研究基础上,我们继续分析了Notch信号通路在LPS诱导的炎性反应中的调控作用。首先,利用Notch信号通路的抑制剂DAPT(γ-分泌酶抑制剂)处理细胞,然后利用qPCR分析了炎性因子TNF-α和IL-1β的表达情况。结果显示,与DAPT未处理的对照组相比,DAPT显著地降低LPS诱导产生的TNF-α(图2A)和IL-1β(图2B)。此外,对Notch信号通路的下游靶基因进行检测,结果显示,在转录水平上DAPT处理抑制LPS诱导的Hey1的上调表达(图2C)。以上结果说明,Notch信号通路参与调控LPS诱导的炎性反应。
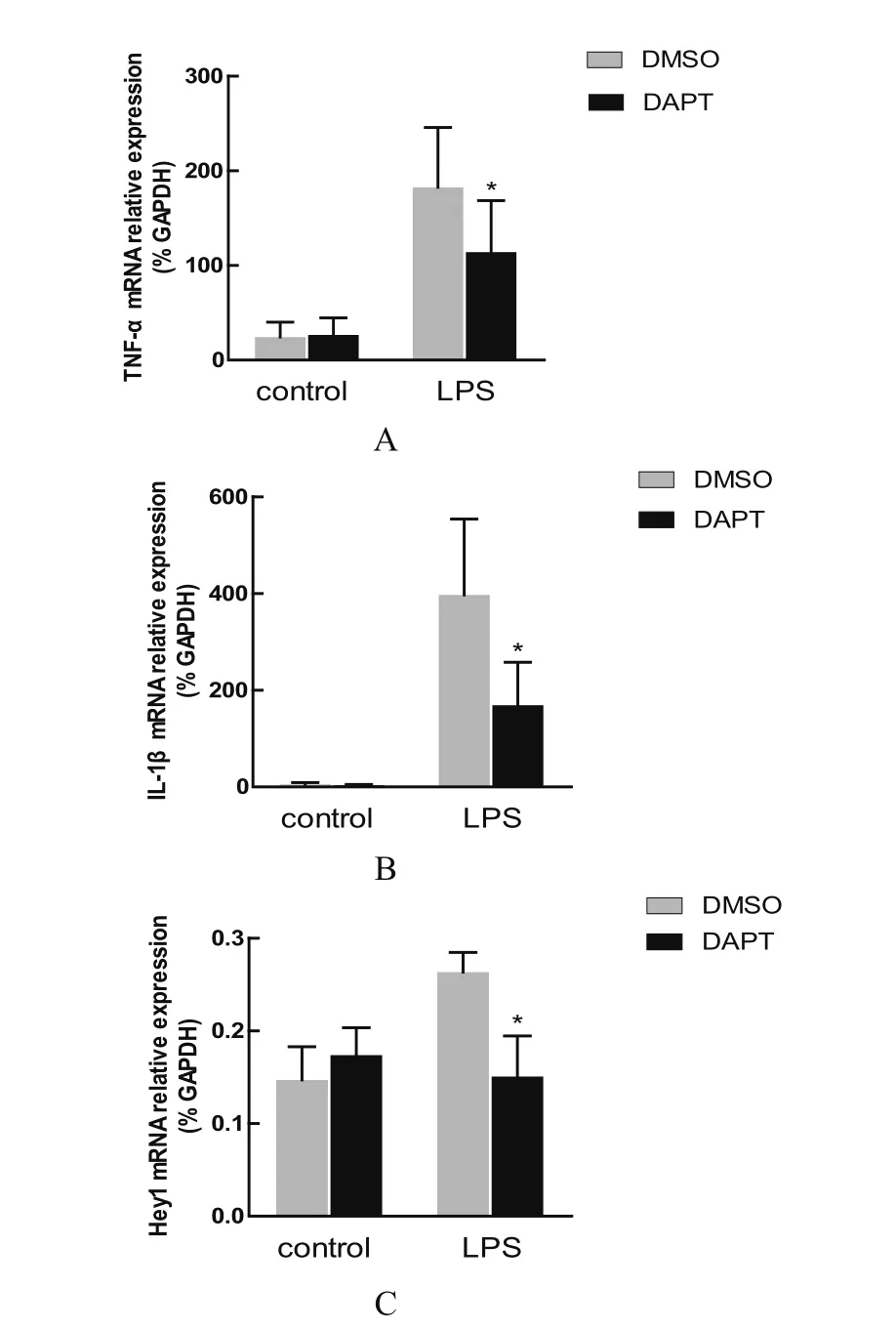
图2 DAPT抑制LPS诱导的炎症反应并抑制靶基因表达Fig.2 DAPT attenuats LPS induced inflammatory responses and inhibits target gene expression
2.3 在PAM上,沉默Notch信号通路转录调控因子RBP-J抑制LPS诱导的炎性反应 采用RNA干扰的方法沉默Notch信号通路转录调控因子RBP-J分析Notch信号通路在LPS诱导的炎性反应中的作用。结果显示,沉默RBP-J的表达(图3A)显著降低了LPS诱导产生的TNF-α(图3B)和IL-1β(图3C)。此外,在转录水平上沉默RBP-J抑制LPS诱导的Hey1的上调表达(图3D)。与DAPT处理的结果一致,Notch信号通路参与调控LPS诱导的炎性反应。
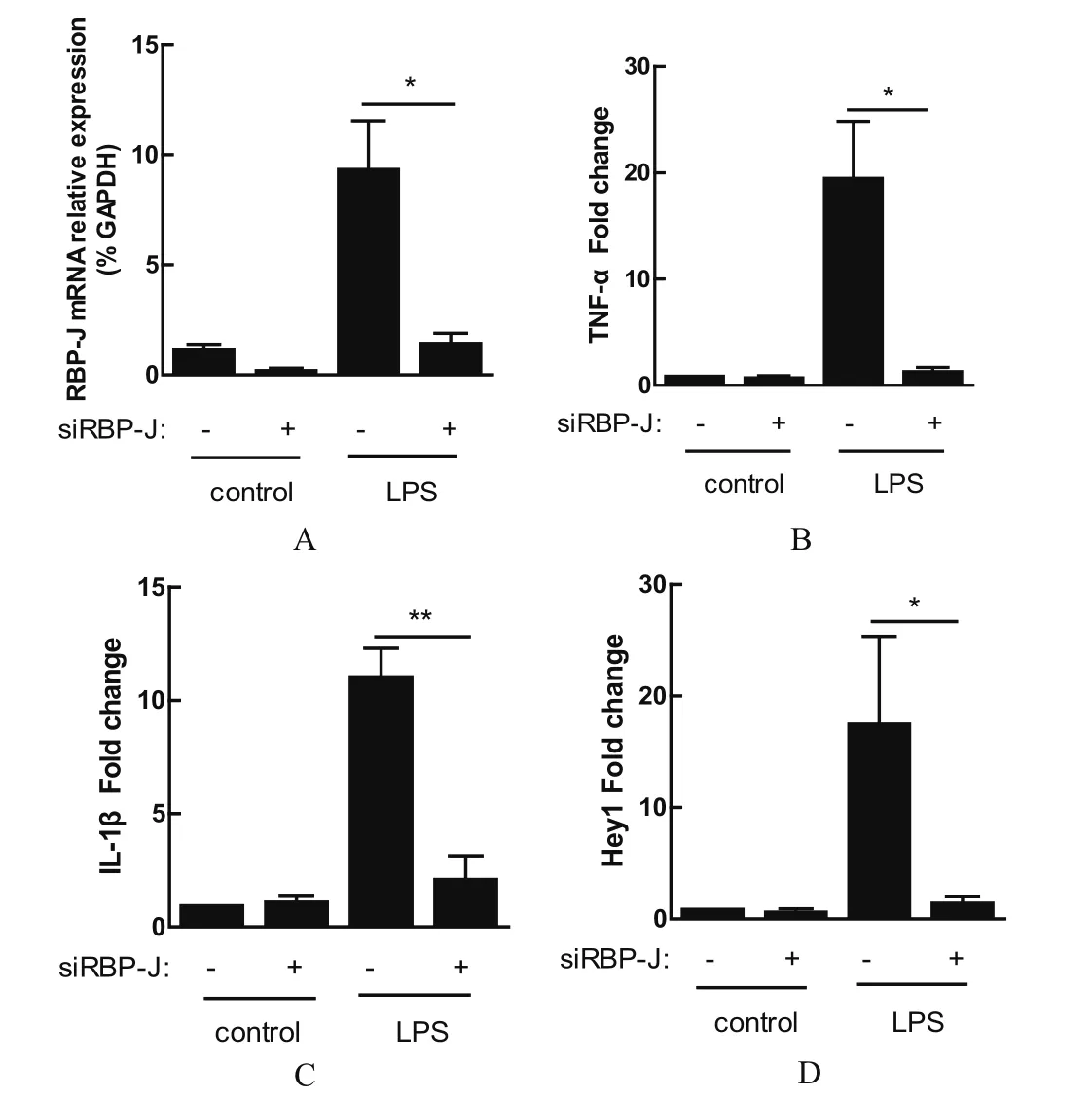
图3 干扰RBP-J可抑制LPS诱导的炎性反应并抑制靶基因表达Fig. 3 Interference with RBP-J inhibits inflammatory responses induced by LPS and inhibits target gene expression
3 讨论
本研究利用LPS/TLR4诱导炎性反应的模型初步揭示了在PAM上Notch-TLR通过协作调控促进炎性反应的机制,具体表现为:1)LPS/TLR4促进Notch信号通路的激活,包括在转录水平上调Jagged1、Jagged2、Dll4和靶基因Hey1的表达;2)Notch信号通路抑制剂DAPT抑制LPS诱导的炎性反应;3)沉默Notch信号通路转录调控因子RBP-J的表达抑制LPS诱导的炎性反应。本研究结果不仅揭示了在PAM上TLR促进Notch信号通路的激活,而且激活的Notch信号通路可进一步诱导TLR介导的炎性反应。
在人和小鼠巨噬细胞上的研究发现,LPS处理诱导不同Notch配体和受体的表达。在小鼠巨噬细胞上,LPS处理显著上调Jagged1的表达,但对其他配体或受体表达的影响因细胞不同而有所变化[13]。在BMDM上,LPS处理上调Dll4,但在人巨噬细胞上,LPS处理上调Jagged1和Dll1的表达对Dll4的表达没有影响[13],而在RAW264.7细胞上,LPS处理并不影响Dll4的表达,反而促进Notch1的上调表达[12]。本研究结果显示,LPS处理增加了Jagged1、Jagged2和Dll4的上调表达,但不影响Notch受体的表达。因此,在不同的巨噬细胞上(人、小鼠和猪),LPS诱导都可上调Jagged1的表达,而其他配体或受体的变化因物种及细胞类型不同有所变化,Jagged1的上调表达对LPS诱导的炎性反应起着重要的作用[13-14],但上调的Jagged1是否对LPS诱导的炎性反应起着重要的作用尚需进一步研究。
与对人或小鼠巨噬细胞上的研究结果类似,在PAM上,DAPT处理抑制LPS诱导的炎性反应。Notch信号通路存在经典或非经典的模式,本研究结果显示,沉默RBP-J(经典Notch信号通路调控因子)抑制LPS诱导的炎性反应。由此可知,在PAM上,LPS/TLR4通过经典的Notch通路调控炎性反应。
在兽医临床上,由多种病原微生物导致的猪呼吸道综合征(porcine respiratory disease complex,PRDC)给养猪业造成巨大的损失。其中,继发的细菌感染是导致PRDC的关键因素,其主要是通过诱导炎性因子的表达促进PRDC的产生[15-20]。本研究结果显示,Notch信号通路调控LPS诱导的炎性反应,不仅为揭示PRDC(由继发性细菌感染引起的)的致病机制奠定基础,也为将来PRDC疾病的防控提供重要的药物靶标。
