多房棘球绦虫钙网蛋白的表达及其与补体组分C1q的相互作用分析
2021-05-20陈路娟王彦海赵利美
陈路娟,程 喆,王彦海,赵利美
(1.内蒙古科技大学 包头医学院基础医学与法医学院病原生物学教研室,包头014060;2.厦门大学 生命科学学院寄生动物研究室,厦门361102)
多房性包虫病俗称泡型包虫病(alveolar echinococcosis,AE),是由多房棘球绦虫(Echinococcus multilocularus,Em)的幼虫感染引起的一种严重的人兽共患寄生虫病[1-3]。AE广泛分布于北半球,我国是世界上包虫病高发的国家之一,主要分布于西北和西南地区,某些牧区发病率可高达10%,内蒙古是AE的高发地区之一[4]。泡球蚴在肝实质内呈弥漫性浸润生长,犹如恶性肿瘤,导致“类肝癌样”致死性寄生虫病,危害性较大。WHO相关资料显示,未经治疗的AE患者10年病死率高达94%,因此有“恶性包虫病”或“虫癌”之称[5]。
AE发病缓慢,早期症状不明显,且发展迅速,至今仍无有效的预防措施。多数患者就诊时已属晚期,失去最佳手术治疗时间,术后疗效不稳定,易复发,因此只能选择药物治疗,而药物治疗棘球蚴病的效果并不理想,且存在多种缺陷,比如费用昂贵、耐药性、毒副作用等[6]。由于缺乏有效的治疗和预防手段,泡型包虫病目前尚未得到有力的控制,迫切需要安全有效的防治措施。因此,研究多房棘球绦虫与宿主免疫系统的相互作用及其致病机制,对预防和控制泡型包虫病的流行至关重要。
钙网蛋白(calreticulin,CRT)是一种一级结构高度保守的Ca2+结合蛋白,属于内质网(ER)滞留蛋白家族,具有N、P、C三个结构和功能区。CRT具有多种生物学功能,比如参与钙离子储存与信号转导、细胞凋亡与粘附等,某些物种CRT还能够通过与补体组分C1q结合,抑制C1q依赖的补体经典途径活化[7-8]。比如美洲板口线虫(Necator americanus)CRT能与人C1q结合并抑制补体介导的细胞溶解,同时还能特异性的结合一些整合素的胞质信号区及白细胞和血小板相关的粘附分子[9];捻转血矛线虫(Haemonchus contortus)CRT既可结合C1q[10],又可结合C反应蛋白(C-reactive protein)[11],从而抑制补体经典途径的激活。C反应蛋白与C1q结合后会激活经典途径,而捻转血矛线虫CRT既能结合C1q又能结合C反应蛋白,起到了双重抑制作用;马来丝虫(Brugia malayi)CRT可与C1q结合抑制补体的活化[12]。近年来,有关旋毛虫(Trichinella spiralis)的研究也证实,CRT不仅能通过与C1q结合,还能作用于甘露糖结合凝集素MBL而发挥免疫调节作用[13-14]。
经同源性分析比对发现,多房棘球绦虫钙网蛋白(Echinococcus multilocularus calreticulin,EmCRT)(GenBank登录号:CUT99434.1)与美洲板口线虫、捻转血矛线虫、马来丝虫、旋毛虫CRT的同源性分别为56%、55%、49%和41%,认为EmCRT也具有结合补体C1q的潜力。本研究对EmCRT基因进行克隆和表达,并对其蛋白序列进行分析,为后续研究其逃避宿主免疫攻击的分子机制奠定基础,同时也为抗包虫疫苗和新药的研制提供重要的科学依据。
1 材料和方法
1.1 虫体与载体 多房棘球绦虫原头蚴由唐崇惕等[15]采自内蒙古呼伦贝尔草原,采用昆明株小鼠腹腔接种传代,保存于厦门大学寄生动物研究室;真核表达载体pcDNA3.3-Myc由厦门大学细胞应激生物学国家重点实验室韩家淮教授提供。
1.2 细胞 Hela细胞保存于厦门大学人兽共患寄生虫病实验室。
1.3 主要试剂 总RNA提取试剂盒购自德国QIAGEN公司;反转录试剂盒购自日本TaKaRa公司;rTaq DNA聚合酶购自加拿大ABM公司;限制性核酸内切酶、LipofectamineTM2000 Transfection Reagent、ECL化学发光试剂盒、Alexa Fluor 488标记的山羊抗兔荧光二抗均购自美国Thermo scientific公司;PCR产物回收试剂盒、小量提取质粒试剂盒购自天根生化科技(北京)有限公司;PVDF膜购自美国GE Healthcor;Myc-Tag Rabbit抗体、抗兔二抗购自中国Cell Signaling Techonology公司。
1.4 引物的设计与合成 根据UniProt数据库中收录的多房棘球绦虫钙网蛋白EmCRT基因序列(GenBank登录号:LN902845.1),利用Primer Premier 5.0软件设计引物。上游引物F1:5'-GAGGAAAATTTTCGGATC CGCCACCATGGCCATCCTTGC-3',下游引物R1:5'-AGCTTCCCAATTGGGGCTCGAGCAATTCATCCTTTG GG-3',下划线部分为酶切位点,加粗部分为不依赖连接反应克隆(ligation independent cloning,LIC)序列。引物由厦门铂瑞生物公司合成。
1.5 RNA提取与cDNA合成 将收集到的多房棘球绦虫囊用RNAlater处理,按照总RNA提取试剂盒使用说明提取虫体总RNA。以提取的虫体总RNA为模板,参照反转录试剂盒的操作说明合成cDNA。
1.6 EmCRT基因的克隆 以囊cDNA为模板,对EmCRT基因进行PCR扩增。扩增体系(50 μL):rTaq Mix 25 μL,ddH2O 17.5 μL,cDNA模板5 μL,上、下游引物各1.25 μL。反应条件:94℃预变性3 min;94℃变性10 s,60℃退火30 s,72℃延伸1 min 30 s,共30个循环;72℃再延伸5 min。扩增产物经1%琼脂糖凝胶电泳后,纯化并回收扩增产物。
1.7 重组质粒pcDNA3.3-Myc-EmCRT的构建 将扩增回收产物与用BamHⅠ、XhoⅠ酶切处理的pcDNA3.3-Myc载体连接,反应体系:载体90 ng,PCR回收产物90 ng,酶缓冲液1 μL,ddH2O补至10 μL,冰浴5 min。再加入1 μL Exo Ⅲ酶4℃反应1 h。最后加入1 μL EDTA(0.5 mol/L,pH8.0)终止反应,并于65℃水浴融化5 min。将连接产物转化至DH5α感受态细胞中,涂布于含有氨苄青霉素的平板,37℃过夜培养。次日挑取菌落PCR和双酶切鉴定均正确的质粒,送至厦门铂瑞生物公司进行测序。
1.8 重组蛋白的表达与鉴定 Hela细胞的转染:转染前接种合适密度的Hela细胞至6孔板,待细胞长至70%~90%汇合时,按照转染试剂说明DNA(µg):脂质体(µL)为1∶2的比例转染细胞,48 h后收集蛋白。
Western blot检测EmCRT蛋白的表达:将目的蛋白进行SDS-PAGE电泳,转膜后用5%脱脂奶粉室温封闭1 h,以兔源Myc标签单克隆抗体为一抗及辣根过氧化物酶标记的羊抗兔IgG为二抗进行杂交,最后用ECL显色。
重组蛋白的免疫荧光检测:将L-多聚赖氨酸包被的细胞爬片置于12孔板内,加入转染的Hela细胞,密度为2×105个/孔,待细胞长至90%汇合时,吸去培养基,4%多聚甲醛进行固定,再用10%山羊血清室温封闭2 h,用抗Myc单克隆抗体及Alexa Fluor 488标记的山羊抗兔荧光二抗进行杂交,最后在激光共聚焦荧光显微镜下观察并拍照。
1.9 EmCRT蛋白序列分析 利用在线软件SignalP 4.1 Server对EmCRT进行信号肽预测;通过GenBank数据库检索,运用ClustalW软件将多房棘球绦虫钙网蛋白EmCRT与其他寄生虫(美洲板口线虫、捻转血矛线虫、马来丝虫)CRT进行同源性比对分析;参照捻转血矛线虫CRT的C1q结合位点,寻找EmCRT的C1q潜在结合区域[9]。
2 结果
2.1 EmCRT基因的扩增 提取多房棘球绦虫囊总RNA反转录合成cDNA。以cDNA为模板,使用特异引物对EmCRT基因进行PCR扩增。经琼脂糖凝胶电泳检测,在1200 bp处可见明显条带(图1),与预期目的基因片段长度一致。
图1 EmCRT基因的PCR扩增产物Fig.1 PCR amplification products of EmCRT
2.2 重组质粒pcDNA3.3-Myc-EmCRT的筛选和鉴定将PCR产物连接至真核表达载体pcDNA3.3-Myc上获得重组质粒pcDNA3.3-Myc-EmCRT,将其转化DH5α宿主菌后,挑取单个菌落进行PCR鉴定,其中1~5号菌落在1200 bp处有明显的阳性条带,与预期结果相符(图2A)。
挑取PCR鉴定正确的菌落,接种培养后提取质粒,用BamHⅠ和XhoⅠ进行双酶切鉴定,质粒经双酶切后得到大小分别约为5100 bp和1200 bp的两个核酸片段(图2B),与预期大小一致。测序结果与EmCRT基因(GenBank登录号:LN902845.1)序列一致性达100%。
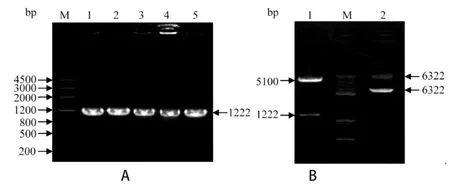
图2 重组质粒菌落PCR和双酶切鉴定Fig.2 Identification of the recombinant plasmids by PCR and restriction enzyme
2.3 pcDNA3.3-Myc-EmCRT重组质粒在Hela细胞中的表达 于转染48 h后裂解细胞,抽提细胞蛋白,取部分上清液,以Myc单克隆抗体为一抗,对重组蛋白EmCRT进行Western blot识别。结果显示,在约46 kDa处有特异性表达条带(图3A),与目的基因编码的蛋白理论值大小相符(含载体携带的标签),表明重组蛋白EmCRT在Hela细胞中得到了表达。细胞免疫荧光结果显示,转染重组质粒pcDNA3.3-Myc-EmCRT的细胞带有绿色荧光,而对照组未转染细胞未见明显荧光(图3B)。
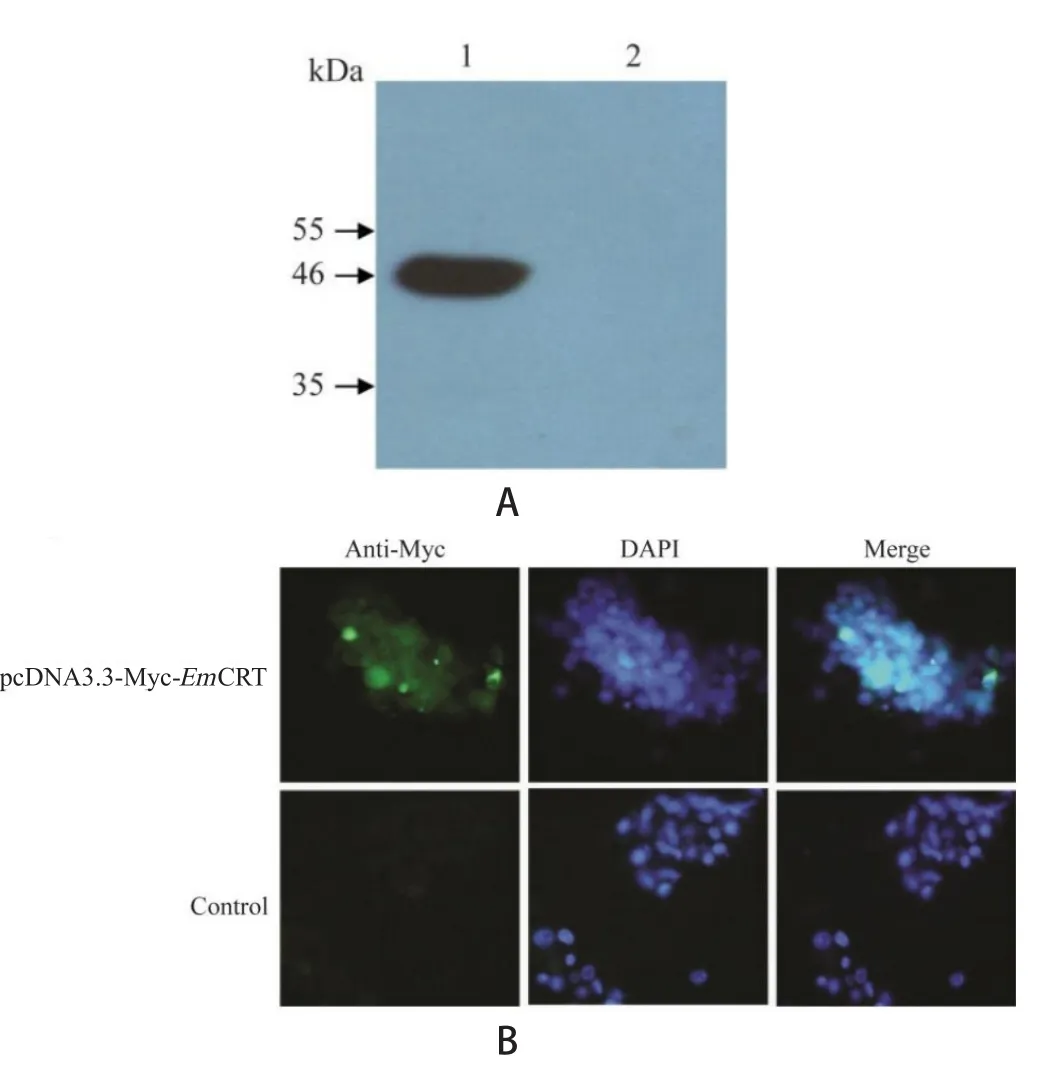
图3 重组EmCRT蛋白的表达与鉴定Fig.3 Western blot and cell immuno fluorescence analysis of recombinant EmCRT
2.4 EmCRT序列分析 利用软件SignalP 4.1对EmCRT进行信号肽预测,结果显示该蛋白N端的第1-18位氨基酸为信号肽序列(图4A)。
经过同源性序列比对分析,发现多房棘球绦虫钙网蛋白EmCRT与美洲板口线虫、捻转血矛线虫和马来丝虫钙网蛋白的氨基酸序列同源性高达49%~56%(图4B)。进一步对比其他蠕虫钙网蛋白序列,发现多房棘球绦虫钙网蛋白EmCRT具有4个C1q潜在结合位点(图4C)。
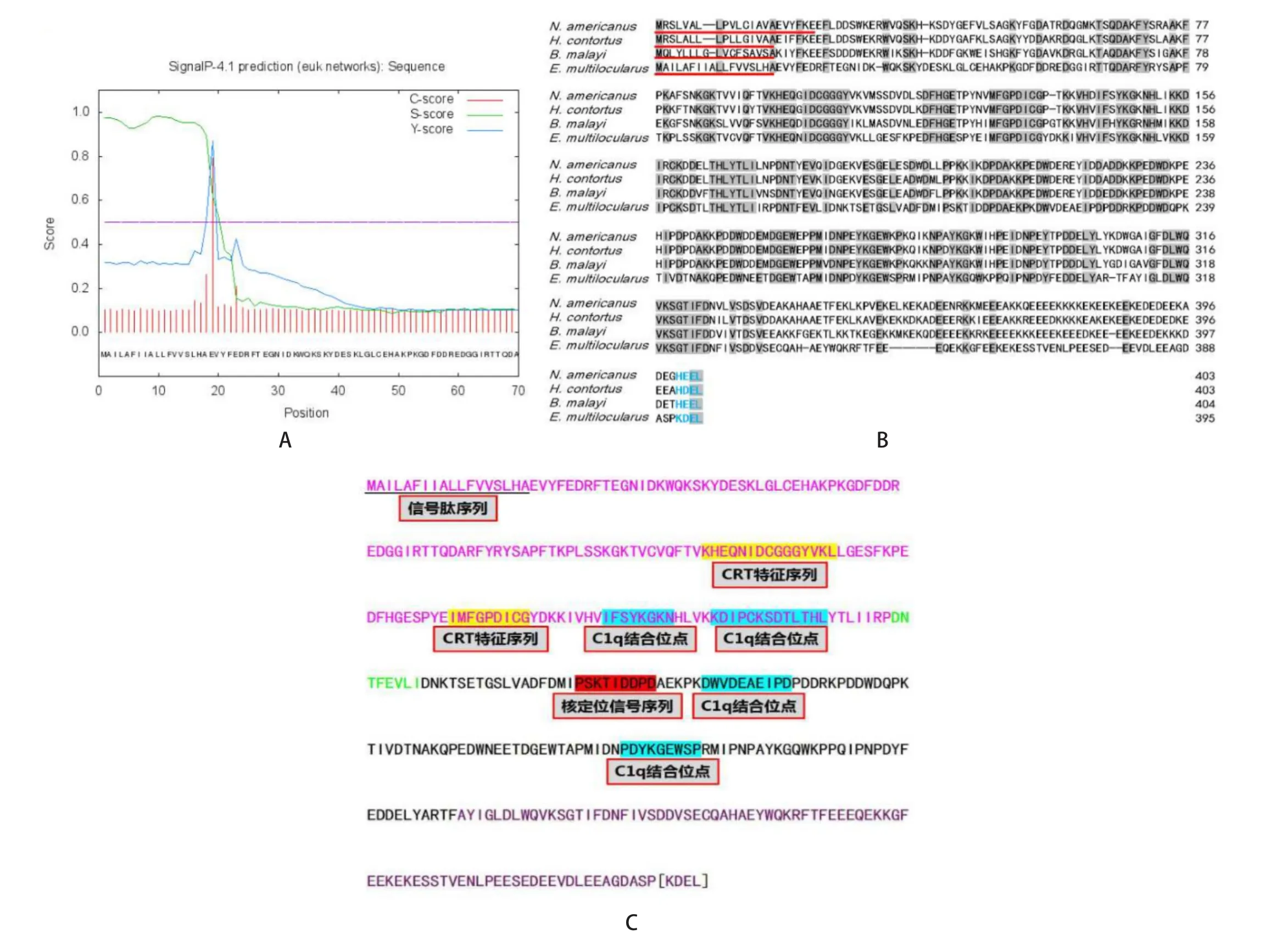
图4 EmCRT序列分析Fig.4 Sequence analysis of EmCRT
3 讨论
包虫病是一种严重影响人民健康和畜牧业发展的人兽共患寄生虫病,特别是AE,病死率较高,但缺乏安全有效的防治手段。根据我国实际情况,采取以免疫预防为主的防治措施是较理想的途径[16]。因而探究多房棘球绦虫的致病机制,特别是虫体逃避宿主免疫攻击的机制,对于AE的防控具有重要作用。
逃避宿主的免疫攻击是寄生虫在宿主体内存活的关键因素,因此在自然界长期进化过程中,寄生虫为了能够在宿主体内存活,形成了一套复杂的逃避宿主免疫攻击的能力,称为免疫逃避。主要包括:(1)解剖位置的隔离:有些寄生虫在宿主细胞内或腔道中形成囊壁、包囊或纳虫空泡等生理屏障,使之与宿主免疫系统隔离;(2)表面抗原的改变:寄生虫在不同发育阶段不断产生新的抗原变异体,造成宿主产生的特异性抗体无法对其进行识别即抗原变异;有些寄生虫体表可表达与宿主组织相似的成分即分子模拟,或将宿主抗原吸附到虫体体表,或用宿主抗原将自身包被,伪装了虫体本身,即抗原伪装,从而保护虫体不受免疫攻击;(3)破坏或抑制宿主免疫应答:主要表现在虫体对特异性B淋巴细胞的耗竭、对Treg细胞的诱导与激活以及对补体的逃避等[17]。
补体系统作为固有免疫的一部分,是抵御病原体入侵宿主的重要防线,在机体抗感染免疫过程中具有重要作用,因此逃避宿主的补体攻击成为病原体实施免疫逃避策略过程中的首要靶标[18]。研究发现,伯氏疏螺旋体(Borrelia burgdorferi)脂蛋白BBK32可通过作用于补体组分C1而抑制经典途径的活化[19];铜绿假单胞菌(Pseudomonas aeruginosa)的碱性蛋白酶可通过裂解补体C2而抑制经典途径和MBL途径的激活[20];白色念珠菌(Candida albicans)pH调节抗原Pra1可通过裂解补体C3而抑制三条补体途径的活化[21];旋毛虫副肌球蛋白Ts-Pmy可与补体C1q和C9结合而抑制补体的活化[22-23]。上个世纪70年代,有学者发现多房棘球绦虫幼虫可通过经典途径或旁路途径激活补体[24],因此逃避补体系统的杀伤对于多房棘球绦虫在中间宿主体内的生存具有极其重要的影响,但其逃避补体攻击的具体分子机制至今尚不清楚[25]。
钙网蛋白是一种高度保守的Ca2+结合蛋白,具有多种生物学功能[26-27]。序列比对显示EmCRT与其他寄生虫CRT具有49%~56%的同源性,表明这些CRT对于虫体在宿主体内的存活起到相对保守的作用。根据报道,寄生虫CRT一般作为一种分泌性蛋白或表达于虫体体表,通过与补体经典途径启动因子C1q结合而参与宿主的免疫调节作用[9,10,13]。由此我们推测,多房棘球绦虫感染宿主后其CRT可能也具有免疫调节的作用,因而对其相关特性及功能开展研究。
外源蛋白质表达系统分为原核表达系统和真核表达系统,其中最常用的原核表达系统是大肠杆菌(E.coli)表达系统,真核表达系统有酵母表达系统、昆虫表达系统及哺乳动物细胞表达系统,每一类表达系统都具有其自身的优缺点。哺乳动物细胞表达系统具有指导蛋白正确折叠、多种翻译后修饰功能等优点[28],表达产物在分子结构、生物学功能等方面接近天然蛋白质分子[29]。pcDNA系列载体是哺乳动物细胞表达重组蛋白常用的体系之一,具有巨细胞病毒(Cytomegalovirus,CMV)强启动子,可操纵外源基因在多数哺乳动物细胞中的高效表达。本研究应用PCR法成功克隆多房棘球绦虫囊EmCRT基因,经测序证实其与GenBank公布的EmCRT序列一致。运用基因重组技术将EmCRT基因片段插入真核表达载体pcDNA3.3-Myc,构建了pcDNA3.3-Myc-EmCRT重组质粒。选用pcDNA3.3作为表达载体,表达产生的重组蛋白N末端具有Myc标签的融合蛋白,易于蛋白的纯化和检测。采用新一代脂质体转染试剂LipofectamineTM2000将重组质粒转入Hela细胞,Western blot及细胞免疫荧光实验可检测到EmCRT的表达,表明重组质粒能够在真核细胞中正确表达。
应用SignalP 4.1软件对EmCRT蛋白结构进行预测,发现其N端1~18 aa为信号肽序列,为了不影响蛋白的分泌,在设计真核表达的引物时保留了信号肽。根据以上分析,推测该蛋白为多房棘球绦虫的1种分泌蛋白。通过进一步序列比对分析,参比捻转血矛线虫CRT蛋白序列发现EmCRT至少具有4个潜在的C1q结合位点,这对后续EmCRT与人补体组分相互作用的研究具有重要参考价值,但预测分析获得的结果尚需进一步的实验确证。后续实验将在此预测分析结果的基础上探究EmCRT与人补体C1q的相互作用,并进一步研究二者的结合是否会影响C1q介导的补体及非补体活化功能,从而深入阐明多房棘球绦虫逃避宿主补体攻击的分子机制。
