HLA-DRB1单核苷酸多态性与重度子痫前期遗传易感性的关系
2021-05-19李胜军张璐璐李静王宏伟刘世国孙鹏
李胜军,张璐璐,李静,王宏伟,刘世国,孙鹏
(1 青岛大学附属青岛市妇女儿童医院检验科,山东 青岛 266034; 2 青岛大学附属医院新生儿科;3 青岛大学附属医院检验科; 4 青岛大学附属医院产前诊断中心)
子痫前期(PE)是指妊娠20周后首次出现的以高血压、蛋白尿为主要表现的临床综合征[1],近年来PE发病率呈现不断上升趋势,由于其可伴发严重并发症,如心力衰竭、HELLP综合征等,成为导致孕产妇不良预后的重要原因。研究表明,胚胎在子宫内附着、存活须凭借母-胎间的免疫耐受平衡[2],携带父方来源的胎儿基因与母体的基因冲突使得滋养细胞侵入障碍、胎盘浅着床从而导致PE的发生[3]。人类白细胞抗原(HLA)可在妊娠过程中抑制子宫内膜自然杀伤细胞的活性,进而维持母胎之间免疫平衡。HLA-DR抗原是HLA基因系统中的重要抗原之一,决定其特异性的主要编码基因DRB1座位具有高度多态性。目前研究认为,HLA-DRB1基因相关位点单核苷酸多态性(SNP)与多种疾病的发生密切相关[4-6]。其中HLA-DRB1rs3135388位点位于5′非翻译区,有研究证实其SNP与多发性硬化症有明确的相关性[7-8];rs2308765位点的SNP可导致错义突变(由半胱氨酸突变为苯丙氨酸),与脑血管疾病相关[9];rs2213586位点目前仍处于研究阶段,其功能未知。然而,这3个位点的SNP与重度PE是否具有相关性目前尚无报道。本文研究通过对产妇HLA-DRB1基因的3个位点rs3135388、rs2308765及rs2213586进行基因型及等位基因频率分析,探讨HLA-DRB1基因SNP与重度PE的相关性,以期为重度PE的诊断及治疗提供遗传学依据。现将结果报告如下。
1 资料与方法
1.1 研究对象
2016年6月—2017年8月,选取在青岛大学附属医院分娩的重度PE产妇60例(子痫组),年龄20~46岁,平均(33.67±5.42)岁。重度PE诊断参照相关文献标准[10],满足下列任何一种情况即可诊断:①收缩压≥21.28~23.94 kPa,或舒张压≥14.63 kPa;②24 h尿蛋白>5.0 g或随机尿蛋白以上;③中枢神经系统功能障碍,精神状态改变和严重头痛(频发,常规镇痛药不缓解);④脑血管意外;⑤视力模糊,眼底点状出血,极少数病人发生皮质性盲;⑥肝细胞功能障碍,肝细胞损伤,血清转氨酶至少升高2倍;⑦上腹部或右上象限痛等肝包膜肿胀症状,肝被膜下出血或肝破裂;⑧少尿,24 h尿量<500 mL,肺水肿、心力衰竭;⑨血小板<100×109/L;⑩凝血功能障碍;微血管病性溶血(血清乳酸脱氢酶升高);胎儿生长受限、羊水过少、胎盘早剥。选取同期正常妊娠的产妇100例作为对照组,年龄22~44岁,平均(30.74±4.60)岁。两组研究对象既往均无原发性高血压、内分泌疾病、心力衰竭、急慢性肾炎以及癌症等病史。本文研究经医院伦理委员会审核批准。
1.2 研究方法
1.2.1临床资料采集 根据知情同意原则收集研究对象的临床资料,包括产妇孕产次、血压及新生儿胎龄、体质量、生后1 min Apgar评分等。
1.2.2HLA-DRB1相关SNP位点测序 采集研究对象外周血,应用Promega DNA纯化试剂盒提取基因组DNA,PCR扩增目的片段,引物由美国Applied Biosystems(ABI, New York, USA)生物公司设计并合成,引物序列见表1。对目的片段进行直接测序,测序结果由BioEdit Sequence Alignment Editor读出,不能读取结果或结果模棱两可时进行反向测序[11],分析基因型及等位基因频率。

表1 PCR引物及其序列
1.3 统计学分析

2 结 果
2.1 两组临床资料比较
子痫组产妇年龄、收缩压和舒张压均高于对照组,子痫组新生儿胎龄、出生体质量及1 min Apgar评分均低于对照组,差异有显著性(t=-22.12~34.78,P<0.05)。子痫组产妇的生产次数(产次)、怀孕次数(孕次)与对照组相比,差异无统计学意义(P>0.05)。见表2。
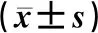
表2 子痫组和对照组临床资料比较
2.2 Hardy-Weinberg平衡检验
对照组HLA-DRB1基因rs3135388位点(χ2=0.066,P=0.798)、rs2308765位点(χ2=0.000,P=1.000)及rs2213586位点(χ2=1.355,P=0.244)的基因型频率分布均符合Hardy-Weinberg遗传平衡,即P>0.05,认为群体遵循遗传规律,所得数据具有良好的群体代表性。
2.3 两组HLA-DRB1 rs3135388、rs2308765以及rs2213586位点基因型和等位基因频率分布比较
本研究两组均未发现rs2308765位点的SNP。
子痫组与对照组HLA-DRB1rs3135388基因型差异无统计学意义(χ2=1.678,P=0.432),两种等位基因频率差异无统计学意义(χ2=0.688,P=0.407,OR=0.590,95%CI=0.167~2.081)。子痫组与对照组HLA-DRB1rs2213586位点基因型差异无统计学意义(χ2=5.600,P=0.061),两种等位基因频率差异无统计学意义(χ2=0.687,P=0.407,OR=1.310,95%CI=0.691~2.484)。见表3、4。

表3 两组 rs3135388位点基因型及等位基因频率比较

表4 两组rs2213586位点基因型及等位基因频率比较
3 讨 论
PE是一种妊娠期的特发性疾病,而重度PE常可引发心力衰竭、肺水肿、HELLP综合征等,进而导致孕产妇的不良预后;同时由于孕期胎盘功能不良,母体与胎儿物质交换障碍,可致胎儿生长受限、早产、低出生体质量及生后窒息低氧等[12-13]。有研究发现,PE孕妇与正常对照组HLA-DRB1的表达存在明显差异[14],该基因的多态性与重度PE的发生存在紧密联系[15]。
PE属于妊娠高血压疾病,流行病学研究发现,高血压具有明显的家族聚集倾向,病人一级近亲属发生高血压的风险较对照组增加约5倍[16],提示遗传因素在疾病的发病过程中也发挥重要作用[17]。此外,已有研究显示,PE可以看作母体对胎儿的同种移植物的免疫排斥反应,而母体与胎儿间免疫失衡导致的胎盘功能不良与PE的发生发展密切相关[18-20]。HLA是器官移植期间导致移植排斥反应发生的重要组织相容性抗原,在人体免疫应答期间发挥着重要的作用。妊娠过程中,HLA在介导母儿免疫耐受中起着重要作用,可以防止母体对胎儿的免疫攻击,而且还能与特定受体结合后促进血管生长因子的分泌,促进胎盘血管的正常滋生以及胚胎组织向子宫内膜的安全着床[21]。HLA-DR抗原是HLA基因系统中最重要的抗原之一,决定其特异性的主要编码基因DRB1座位具有高度多态性,目前多项研究证实该区域的基因多态性与PE的发生密切相关。HAYWARD等[22]和吴乾渝等[23]研究发现,PE病人HLA-DRB1*06和HLA-DRB1*07及其新生儿HLA-DRB1*07出现的频率显著高于正常对照组。刘国成等[15]通过病例对照研究发现,HLA-DRB1*03基因的多态性与妊娠期高血压具有相关性。
本研究采用PCR直接测序法检测HLA-DRB1单个核苷酸变异对PE发病的影响。结果显示,子痫组和对照组均未发现rs2308765位点的SNP,而两组rs3135388及rs2213586位点基因型分布和等位基因频率差异均无统计学意义,表明这两个位点多态性可能与PE遗传易感性不相关。分析其原因,可能与本研究样本量偏小以及等位基因与基因频率的连锁不平衡有关。此外,妊娠期高血压作为环境与遗传因素共同起作用的疾病,其发病可能与多种基因联合作用相关。因此,本研究尚不能认为HLA-DRB1rs2308765、rs3135388、rs2213586位点SNP与重度PE有相关性。进一步扩大样本量、检测其他相关基因,进行单倍型分析和多位点联合分析,或将为下一步研究的重点。
