下调miR-141-3p对晚期NSCLC细胞侵袭转移和化疗敏感性影响及其机制
2021-05-19王亚飞张振军宋长亮张磊
王亚飞,张振军,宋长亮,张磊
(1 邯郸市中心医院肿瘤科,河北 邯郸 056000; 2 冀中能源峰峰集团总医院邯郸分院骨科)
肺癌病死率位居恶性肿瘤的首位,多数病人确诊时已是晚期失去手术机会,其预后极差,多归因于目前缺乏有效的早期诊断途径[1-4]。晚期非小细胞肺癌(NSCLC)病人多采用以化疗为主的治疗方案[5-6]。值得注意的是肿瘤治疗效果与病人个体化特征密切相关,即便同一种治疗方案应用于有着相似临床诊断、临床分期及药物种类和剂量的不同患癌个体,亦可能产生不同反应。化疗敏感性已成为衡量化疗效果的主要指标[4],而耐药性在治疗过程中很常见。微小RNA(microRNA)是一类非编码RNA,可通过调节特定基因的表达,参与肿瘤发展进程[7]。近年来的研究表明,microRNA在肺癌的发展、诊疗、放化疗敏感性等方面均发挥着重要作用[8-9]。例如,miR-141已被证实可作为NSCLC潜在的诊断标志物[10-11];miR-141-3p在对化疗有效的NSCLC病人中呈低表达[12]。但目前关于miR-141-3p是否参与晚期NSCLC治疗过程中化疗敏感性机制的研究未见报道。本研究以体外实验方式,采用细胞转染探究miR-141-3p在NSCLC细胞系的表达,并探讨其对晚期NSCLC化疗敏感性的影响及其作用机制,为逆转肺癌化疗耐药性提供临床依据。
1 材料与方法
1.1 实验材料
1.1.1试剂和仪器 NSCLC细胞株A549(中国科学院肿瘤研究所);顺铂(北京沃凯生物科技有限公司);miR-141-3p模拟物(miR-141-3p mimic)、miR-141-3p抑制物(miR-141-3p inhibitor)、Yes相关蛋白1载体(YAP1vector)、YAP1沉默表达(siRNA-YAP1)质粒和PCR引物(上海吉玛公司);Matrigel胶(上海玉博生物科技有限公司);倒置显微镜(Leica公司,德国);CCK8试剂(上海翊圣生物科技有限公司);Trizol试剂(北京百奥森泰生物技术有限公司);两步法实时定量逆转录聚合酶链反应(qRT-PCR)试剂盒(上海联迈生物工程有限公司);Western blot抗体(Abcam,UK);ECL发光液(上海七海复泰生物科技有限公司);双荧光素酶报告基因检测试剂盒(翌圣生物科技(上海)有限公司)。
1.1.2研究对象 2016年6月—2018年6月,选择邯郸市中心医院不能手术的50例晚期NSCLC病人作为研究对象,术前均未接受放化疗及免疫治疗。其中男34例,女16例,年龄为22~71岁,平均年龄(54.12±6.67)岁。所有病例均经CT引导下经皮肺穿刺或支气管镜下黏膜活检,并经病理证实为晚期NSCLC。同时,以24例手术切除的肺癌病人的癌旁正常肺组织(距病灶5 cm)为对照组。
1.2 实验方法
1.2.1细胞培养与分组处理 收集NSCLC细胞株A549置于Kaighn’s F-12K培养基(补加有体积分数0.10胎牛血清(FBS)和青霉素/链霉素/真菌素),接种于24孔板,每孔500 μL,置于37 ℃、含体积分数0.05 CO2、100%湿度培养箱中孵育。根据细胞生长情况,每隔2~3 d传代1次。将细胞分为6组:Blank组(A组,不做任何处理),miR-141-3p mimic组(B组,转染miR-141-3p过表达质粒),miR-141-3p inhibitor组(C组,转染miR-141-3p inhibitor质粒),YAP1vector组(D组,转染YAP1过表达质粒),siRNA-YAP1组(E组,转染siRNA-YAP1质粒),miR-141-3p mimic+siRNA-YAP1组(F组,共转染miR-141-3p inhibitor质粒和YAP1过表达质粒)。均采用Lipofectamine Transfection Reagent 2000(Invitrogen)介导细胞转染。
1.2.2qRT-PCR检测 转染48 h后,收集各组细胞,Trizol法提取细胞总RNA,并测定浓度和纯度(组织检测步骤同细胞检测)。按照qRT-PCR试剂盒说明书操作,置于PCR扩增仪,将样品RNA反转为cDNA,并进行qRT-PCR扩增。将基因上下游引物稀释,加入PCR扩增体系,灭菌ddH2O补足至20 μL。目的基因以GADPH为内参照,使用实时PCR检测系统平台进行检测。取Ct值,采用相对定量法计算,用2-△△Ct表示各目的基因相对表达量。每个实验均重复3次,取其均值。
1.2.3双荧光素酶报告检测 使用生物学预测网站进行miR-141-3p和YAP1的结合位点分析。克隆扩增YAP1的3’UTR区到pmirGLO双荧光素酶报告基因载体上,并命名为pWt-YAP1。同时构建pMut-YAP1载体,mimic-NC组与miR-141-3p mimic组分别与荧光素酶报告载体共转染NSCLC细胞株A549,采用双荧光素酶报告基因检测试剂盒检测荧光强度。
1.2.4Transwell实验 在各组转染48 h后细胞板内,每孔上室加200 μL细胞悬液,下室加800 μL含有体积分数0.20 FBS的条件培养基。37 ℃培养箱孵育20~24 h。取出Transwell板,1 g/L甲紫溶液染色。晾干后用倒置显微镜随机计数5个视野的细胞,并取平均值。实验重复3次。
1.2.5划痕实验 用Marker笔在6孔板背后均匀画横线(间距0.5~1.0 cm),横穿过孔。每孔至少穿过5条线。加入各组转染48 h后的细胞,过夜培养,待细胞均匀铺满容器底面。次日用枪头沿直尺划痕。用PBS洗细胞3次,去除划下的细胞,加入无血清培养基。放入37 ℃、体积分数0.05 CO2培养箱培养。取样拍照。
1.2.6CCK8检测 使用体积分数0.10 FBS培养基配制成不同浓度的顺铂溶液,4 ℃储存备用。取对数生长期的细胞接种于96孔培养板,置37 ℃、体积分数0.05 CO2条件下培养,取10 mg/L顺铂,加入96孔板中,设3个复孔。设置空白对照。48 h后,每孔加新配制的CCK8试剂10 μL,继续孵育4 h,终止培养,小心吸去培养液。在酶联免疫检测仪上测定各孔450 nm波长处吸光度(A)。细胞存活率=实验组A值/对照组A值×100%。
1.2.7Western blot检测 收集转染培养48 h后的各组细胞,以PBS洗涤后重悬。离心取上清,加入RIPA裂解液,轻摇重悬后,冰上孵育30 min,4 ℃、12 000 r/min离心10 min,取上清液,即为细胞总蛋白。应用碧云天BCA蛋白定量试剂盒测定蛋白质浓度。取20 μg细胞总蛋白用100 g/L的SDS-PAGE凝胶电泳分离蛋白质,随后湿法转膜,使用50 g/L的脱脂奶粉封闭1.5 h。按照抗体说明书稀释相应抗体于一抗稀释液中。实验所用的一抗如下:一抗兔抗人YAP1、一抗兔抗人TGF-β、一抗兔抗人Smad2及一抗兔抗人GAPDH多克隆抗体。加入相应HRP标记的二抗羊抗兔IgG抗体,在室温下反应2 h,ECL发光液显色,并曝光成像。采用Quanity One软件进行蛋白条带灰度分析。
1.3 统计学分析
2 结 果
2.1 晚期NSCLC组织miR-141-3p和YAP1表达
通过对50例晚期NSCLC组织及24例癌旁组织的qRT-PCR检测结果显示,与癌旁组织比较,癌组织中miR-141-3p和YAP1表达均显著升高,差异均有统计学意义(t=23.19、17.32,P均<0.05)。见图1。

①miR-141-3p,②YAP1。与癌旁组织相比,*P<0.05。
2.2 miR-141-3p对YAP1基因表达的调控
为研究miR-141-3p在NSCLC细胞中的靶向关系,通过生物学网站对其进行分析,结果显示,miR-141-3p和YAP1存在结合位点。双荧光素酶报告基因预测结果显示,与mimic-NC组相比较,YAP1野生型3’UTR的荧光素酶活性能被miR-141-3p抑制(t=7.643,P<0.05),而对YAP1突变型3’UTR的荧光素酶活性没有影响(P>0.05)。说明miR-141-3p能特异性结合YAP1的3’UTR区并在转录后水平下调FANCM基因表达。见图2。

①生物学网站预测miR-141-3p和YAP1的结合位点;②miR-141-3p和YAP1的荧光素酶活性检测结果。与mimic-NC组相比较,*P<0.05。
2.3 miR-141-3p调控对各组细胞YAP1表达影响
qRT-PCR检测结果显示,各组细胞YAP1表达差异有显著意义(F=116.8,P<0.05)。与Blank组相比,miR-141-3p mimic组YAP1基因表达上升(Tukey’s检验,P<0.05),miR-141-3p inhibitor组YAP1基因表达下降(Tukey’s检验,P<0.05)。说明miR-141-3p表达能够调控YAP1表达。见图3。
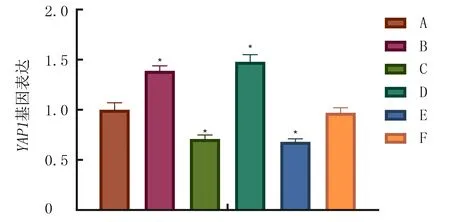
A:Blank组,B:miR-141-3p mimic组,C:miR-141-3p inhibitor组,D:YAP1 vector组,E:siRNA-YAP1组,F:miR-141-3p mimic+siRNA-YAP1组。与Blank组相比,*P<0.05。
2.4 miR-141-3p对晚期NSCLC细胞的增殖、迁移和耐药性的影响
结果显示,各组NSCLC细胞的增殖、迁移和耐药性比较,差异有显著意义(F=82.670~181.000,P均<0.05)。与Blank组相比,miR-141-3p mimic组和YAP1vector组癌细胞侵袭、迁移能力明显增强,顺铂处理后细胞存活率明显增加,差异有显著意义(Tukey’s检验,P均<0.05);而miR-141-3p inhibitor组和siRNA-YAP1组癌细胞侵袭、迁移能力明显减弱,顺铂处理后细胞存活率明显降低,差异有显著性(Tukey’s检验,P均<0.05)。Blank组和miR-141-3p mimic+siRNA-YAP1组各指标无显著差异(P>0.05)。说明miR-141-3p inhibitor+pcDNA-YAP1组逆转了这一趋势。见图4、5。

①各组细胞侵袭情况;②各组细胞侵袭率。A:Blank组,B:miR-141-3p mimic组,C:miR-141-3p inhibitor组,D:YAP1 vector组,E:siRNA-YAP1组,F:miR-141-3p mimic+siRNA-YAP1组。与Blank组相比,*P<0.05。

①各组细胞迁移情况;②各组细胞迁移数。A:Blank组,B:miR-141-3p mimic组,C:miR-141-3p inhibitor组,D:YAP1 vector组,E:siRNA-YAP1组,F:miR-141-3p mimic+siRNA-YAP1组。与Blank组相比,*P<0.05。
2.5 miR-141-3p对TGF-β信号通路相关蛋白影响
Western blot检测结果显示,各组TGF-β信号通路相关蛋白表达比较,差异有统计学意义(F=159.800、125.3000,P均<0.05)。与Blank组相比,miR-141-3p mimic组和YAP1vector组TGF-β和Smad2表达水平明显下降,而miR-141-3p inhibitor组和siRNA-YAP1组TGF-β表达水平明显提高,差异有显著性(Tukey’s检验,P均<0.05)。Blank组和miR-141-3p mimic+siRNA-YAP1组各项指标差异无显著性(均P>0.05)。见图6。

①各组蛋白电泳图;②各组蛋白表达量。A:Blank组,B:miR-141-3p mimic组,C:miR-141-3p inhibitor组,D:YAP1 vector组,E:siRNA-YAP1组,F:miR-141-3p mimic+siRNA-YAP1组。与Blank组相比,*P<0.05。
3 讨 论
microRNA已被证实在人类肿瘤的抗放化疗机制中发挥重要作用。例如,LIU等[13]在其研究中利用microRNA分子谱分析法筛选与LASS2相关的microRNA,以为鉴别化疗耐药和化疗敏感性提供依据,其结果发现miR-93抑制剂可增强si-LASS2转染肿瘤细胞的化学敏感性。LANG等[14]报道,采用miR-24靶向沉默S100A8基因可提高子宫内膜癌细胞对紫杉醇的化疗敏感性。刘娜等[15]在其研究中利用慢病毒表达载体转染卵巢癌细胞株,构建miR-200a表达上调模型,并结合MTT实验、PCR和免疫印迹检测发现miR-200a可能通过调控耐药相关ABC家族基因如ABCB3、ABCC1、ABCC2、ABCC3和ABCG2的表达,增加卵巢癌细胞对紫杉醇的敏感性。肖悦等[16]通过构建稳定表达miR-18a的白血病细胞转染模型,发现miR-18a能够通过靶定ATM调节白血病细胞HL-60对VP-16和VCR化疗敏感性。鉴于microRNA能在基因编码水平上反映肿瘤的耐药性机制[17-19],那么通过构建特定表达干预的细胞转染模型,可有助于探究特定microRNA与肿瘤耐药性的关联及其作用机制。
在本研究前期,我们通过生物信息学方法筛选出晚期NSCLC过表达基因miR-141-3p,且在线生物学预测软件报道miR-141-3p调控YAP1,YAP1在晚期NSCLC亦高表达,因此推测miR-141-3p通过调控YAP1影响晚期NSCLC。本研究首先通过qRT-PCR验证组织中miR-141-3p和YAP1的表达。结果显示,与癌旁组织相比,晚期NSCLC中miR-141-3p和YAP1呈高表达。进而,我们通过细胞转染分为不同干预组别,探讨了miR-141-3p对YAP1的调控关系,结果显示,过表达miR-141-3p能够促进YAP1基因和蛋白的表达,沉默miR-141-3p能够抑制YAP1基因和蛋白的表达,说明miR-141-3p的表达能够调控YAP1的表达。进一步研究结果表明,通过转染miR-141-3p mimic或YAP1vector,相比Blank组,过表达miR-141-3p或YAP1能够抑制TGF-β和Smad2表达,促进癌细胞侵袭迁移,增加细胞对顺铂耐药性。而通过miR-141-3pinhibitor或si-YAP1转染处理,则显示沉默miR-141-3p或YAP1能够提高TGF-β和Smad2表达,抑制癌细胞转移侵袭,降低细胞对顺铂耐药性。与此同时,Blank组和miR-141-3p mimic+siRNA-YAP1组各项指标无显著差异,提示后者逆转了这种趋势。这说明miR-141-3p能够通过YAP1促进晚期NSCLC细胞的增殖、迁移和耐药。
基于以上实验探究,我们推测,miR-141-3p下调可能通过抑制YAP1基因表达,激活TGF-β信号通路,进而调控晚期NSCLC细胞侵袭转移和化疗敏感性。值得注意的是,TGF-β家族是一类功能复杂的细胞因子,可广泛参与各种病理生理过程,介导肿瘤细胞的分化与增殖[20-22]。TGF-β信号通路相关蛋白如Smad2,亦参与人类肿瘤进程,与乳癌、肺癌等发生发展相关[23-24]。TGF-β信号通路及其相关蛋白组成肿瘤抑制通路,介导肿瘤细胞生长,并且可激活一系列信号通路如MAPK、ERK等信号通路[25-26]。本研究中,miR-141-3p下调及YAP1基因表达抑制促进了TGF-β和Smad2表达的提升,进而激活TGF-β信号通路,对于降低顺铂耐药性具有重要作用。既往研究已报道TGF-β信号通路与化疗耐药有关,并可通过调控TGF-β信号通路抑制肿瘤耐药[27]。孙彩霞等[28]报道,转染miR-141模拟物可降低卵巢癌细胞株SKOV-3和ES-2细胞对卡铂的敏感性,提示检测miR-141表达水平在预测卵巢癌对卡铂敏感性、评估病人预后及其合理指导综合治疗等方面的临床意义。
综上所述,本文结果显示,miR-141-3p下调可能通过抑制YAP1基因表达,激活TGF-β信号通路,进而调控晚期NSCLC细胞侵袭转移和化疗敏感性。本研究可为人类探讨NSCLC耐药机制提供新途径,microRNA与NSCLC耐药间的相关性将为逆转其耐药性提供一种全新的思路和策略。然而,本研究仅在细胞实验中初步探究miR-141-3p对NSCLC影响的作用机制,是否存在其他潜在靶点及其作用机制均未可知,其将为今后研究的主要方向,进而为NSCLC的诊治提供分子生物学依据。
