沙库巴曲缬沙坦通过调控心力衰竭大鼠TGF-β1/Smad3 和NF-κB 信号通路抑制心肌损伤
2021-05-18宋建敏陈灿宋
宋建敏陈 灿宋 波
(1.湖北医药学院附属随州医院心血管内科,湖北 随州 441300; 2.湖北医药学院附属随州医院心胸血管外科,湖北 随州 441300)
心肌梗死在全世界范围内具有较高的致残率和死亡率。 尽管由于早期溶栓、经皮冠状动脉介入治疗或冠状动脉搭桥术明显降低了急性心肌梗死的死亡率,但幸存患者中仍会发生左心室(LV)重塑[1]。 心肌梗死后这种不良的心脏重塑可导致心室功能障碍和心力衰竭,从而导致预后不良和死亡率升高[2]。 心力衰竭是心肌梗死的主要并发症,其在心肌梗死患者死亡原因中位于第二位[3]。 因此,抑制心脏重塑是治疗心肌梗死后心力衰竭的主要策略。
心肌梗死后左心室间质纤维化和炎性细胞浸润是心脏重塑的常见病理特征。 转化生长因子-β1(TGF-β1)已被确认为心脏纤维化的关键调节剂,其可影响细胞生长、凋亡和分化、增加胶原蛋白和基质蛋白的产生、保持成纤维细胞的活力。 心肌梗死动物模型的结果表明,心肌梗死中TGF-β1 的高表达以及使用TGF-β 受体抑制剂阻断TGF-β 途径可以减轻心肌梗死动物模型中的心脏纤维化[4]。 此外,核因子κB(NF-κB)是心肌梗死后心脏重塑和心力衰竭发展的关键因素,并且在炎症和先天免疫中起着至关重要的作用[5]。 NF-κB 家族成员p65 形成同二聚体或异二聚体,这些同二聚体或异二聚体与细胞质中的κB(IκB)蛋白抑制剂结合。 IκB 的降解会释放NF-κB 二聚体,并使NF-κB 易位进入细胞核,从而可以启动靶基因的转录。 NF-κB 的激活可诱导趋化因子(MCP-1)、细胞因子(TNF-α、IL-6)和基质金属蛋白酶(MMPs)的转录,并进一步促进炎症和纤维化[6]。 多项研究表明抑制NF-κB 可抑制炎症反应和心脏纤维化[6]。 因此,研究TGF-β1 和NF-κB 信号通路对于抑制心肌梗死后心力衰竭患者的心脏重塑具有巨大的潜在治疗价值。
沙库巴曲缬沙坦(sacubitril/valsartan)的商品名叫诺欣妥(entresto),是一种血管紧张素II 受体及脑啡肽酶的双重抑制剂类药物,由血管紧张素II 受体拮抗剂的缬沙坦及脑啡肽酶抑制剂前体AHU377 组成[7]。 沙库巴曲缬沙坦于2015 年获美国FDA 批准上市,2016 年被推荐为心力衰竭指南的I 类药物,并且取得了较好的疗效。 然而,沙库巴曲缬沙坦对心脏重塑的作用机制尚不明确。 因此,本研究建立了心肌梗死后心力衰竭模型,评估了沙库巴曲缬沙坦对心脏功能、心脏纤维化以及TGF-β1、p-Smads、collagen I、TNF-α 和IL-6 的影响。 并进一步探讨TGF-β1 和NF-κB 通路是否参与心脏重塑过程中沙库巴曲缬沙坦的保护作用。
1 材料和方法
1.1 实验动物
60 只SPF 级雄性Sprague-Dawley 大鼠(7 周龄,体重220 ~250 g) 由湖北省实验动物中心提供[SCXK(鄂)2019-0008],饲养于湖北医药学院屏障环境中[SYXK(鄂)2019-0031]。 给动物饲喂标准饲料和水,并饲养在12 h 光照和12 h 黑暗、(20±2)℃温度和(50±2)%湿度的环境中。 所有动物实验方案均已获得湖北医药学院附属随州医院伦理审查委员会的批准(20180211),并符合实验室动物管理和使用规定,实验设计符合3R 原则。
1.2 主要试剂与仪器
沙库巴曲缬沙坦( 诺新妥, 国药准字J20171054,Novatis Pharma Stein AG);Masson 三色染色剂染色(货号:G1340,北京索莱宝科技有限公司);α-SMA 一抗(免疫组化) (ab119952,英国Abcam 公司);HRP-聚合物标记的抗兔IgG 二抗(ab6721,英国Abcam 公司);RIPA 裂解缓冲液(产品编号:P0013 K,碧云天生物技术研究所);TGF-β1一抗(ab215715,英国Abcam 公司);p-Smad3 和Smad3 一抗(ab52903 和ab40854,英国Abcam 公司); p-Smad7 和 Smad7 一 抗 ( ab227309 和ab226872, 英 国 Abcam 公 司); TNF-α 一 抗(ab215188,英国Abcam 公司);IL-6 一抗(1 ∶1000,ab233706,英 国 Abcam 公 司); Collagen I 一 抗(ab138492, 英 国 Abcam 公 司); α-SMA 一 抗(ab265588,英 国Abcam 公 司);NF-κBp65 一 抗(ab183559,英国Abcam 公司);p-IκBα 一抗(sc-8404,美国Santa Cruz Biotechnology 公司);GAPDH一抗(ab8245,英国Abcam 公司);辣根过氧化物酶标记的山羊抗兔IgG(ab205718,英国Abcam 公司)。
1.3 实验方法
1.3.1 心肌梗死后心力衰竭动物模型
结扎左前降支冠状动脉(LAD)后由心肌梗死诱发心力衰竭。 腹膜内注射1%戊巴比妥钠(50mg/kg)麻醉大鼠,然后进行气管插管并连接呼吸机正压通气,术前记录12 导联心电图。 皮肤消毒后于胸腔开口,于左心耳根部下方2 mm 结扎LAD。 假手术组的大鼠在不结扎LAD 的情况下进行相同的手术操作。 实验后记录十二导联心电图。 将大鼠正常喂养1 周。 根据经胸超声心动图检查结果,当LVEF 降低45%时表示心力衰竭模型建模成功。
1.3.2 动物分组及给药
将存活大鼠随机分为以下组:假手术组(n=15)、模型组(n=15)和沙库巴曲缬沙坦组(n=15)。沙库巴曲缬沙坦组大鼠每天一次通过管饲法给予沙库巴曲缬沙坦10 mg/kg。 共治疗4 周。 模型组和假手术组给予等体积的生理盐水。
1.3.3 经胸超声心动图检查
采用无创经胸超声心动图方法评估左心室的形态和功能。 在麻醉动物中进行超声心动图检查。记录左心室收缩末期内径(LVIDs)和左心室舒张末期内径(LVIDd)以及左心室射血分数(EF)和左心室缩短分数(FS)。
1.3.4 心肌纤维化的测量
给药4 周后,收集大鼠心脏,并在磷酸盐缓冲液中洗涤,在4%多聚甲醛中固定过夜,然后包埋在石蜡中。 将每个石蜡包埋的心脏切成4 μm 厚的切片,并用MASSON 三色染色剂染色。 每个切片在尼康显微镜下成像,通过Image J 软件计算纤维化程度。
1.3.5 免疫组织化学染色
通过免疫组织化学染色检测α-SMA 蛋白的表达。 将心脏组织切片放在烤箱中烤片20 min,然后二甲苯脱蜡,梯度乙醇水化。 使用PH 9.0 的Tris/EDTA 缓冲液进行抗原修复。 在3% H2O2中孵育10 min 来封闭内源性过氧化物酶。 将切片在1%PBS 中洗涤3 次,每次6 min,并在4℃下与1%牛血清白蛋白中的一抗(1 ∶500 稀释)一起孵育过夜。 将切片用1% PBS 洗涤3 次,每次6 min。 然后将切片与HRP-聚合物标记的抗兔IgG 二抗(1 ∶500 稀释)室温孵育1 h。 将切片再次用1%PBS 洗涤3 次,每次6 min,然后用苏木精复染30 s。 使用OLYMPUS BX 50 数字显微镜。 在×400 放大倍数下观察图像。随机选择5 个视野进行阳性染色评分,阳性染色评分=阳性细胞计数评分×染色强度评分。 阳性细胞计数评分如下:<5%为0 分,5 ~25%为1 分,5 ~25%为1 分,26~50%为2 分,51~75%为3 分,>75%为4分。 染色强度评分如下:未染色为0 分,浅黄色为1分,棕黄色为2 分,深棕色为3 分。
1.3.6 蛋白质印迹分析
给药4 周后,对所有动物实施安乐死,立即收获心脏并保存在液氮中。 使用RIPA 裂解缓冲液裂解组织。 通过BCA 法测定蛋白质浓度。 蛋白质通过10% SDS-PAGE 分离并转移到硝酸纤维素膜上,然后与以下一抗在4℃下过夜孵育:TGF-β1(1 ∶500)、p-Smad3 和Smad3(1 ∶500)、p-Smad7 和Smad7(1 ∶500)、TNF-α(1 ∶1000)、IL-6(1 ∶1000)、Collagen I(1 ∶1000)、αSMA(1 ∶500)、NF-κBp65(1 ∶1000)、p-IκBα(1 ∶1000)和GAPDH(1 ∶1000)。 将膜与辣根过氧化物酶标记的山羊抗兔IgG(1 ∶2000)在室温下孵育2h。 GAPDH 作为内部对照。 通过ECL 法显影并使用Gene Gnome 凝胶成像系统捕获生成的图像。
1.4 统计学方法
2 结果
2.1 沙库巴曲缬沙坦改善心力衰竭大鼠心脏结构和功能
通过超声心动图评估心力衰竭大鼠治疗后的心脏功能。 研究显示(图1),与假手术组相比,模型组大鼠的EF 和FS 显著降低,而LVIDs 和LVIDd 显著升高(P<0.05)。 此外,与模型组相比,沙库巴曲缬沙坦组的EF 和FS 显著升高,而LVIDs 和LVIDd显著降低(P<0.05)。
2.2 沙库巴曲缬沙坦减轻心力衰竭大鼠心肌纤维化
间质纤维化是心梗后心脏重塑的主要特征。通过Masson 对间质纤维化进行的三色染色显示(图2),与假手术组相比,心肌梗死组的左室壁结扎部分梗死区域边界出现明显的间质纤维化,胶原蛋白染色区域显著增加(P<0.05)。 此外,与模型组相比,沙库巴曲缬沙坦组的胶原蛋白染色区域显著降低(P<0.05)。
图3 和图4 显示,与假手术组相比,模型组大鼠心脏组织中肌成纤维细胞标志物α-SMA 的表达显著升高(P<0.05)。 与模型组相比,沙库巴曲缬沙坦组α-SMA 的表达显著降低(P<0.05)。 α-SMA 阳性的肌成纤维细胞可促进细胞外基质(ECM)的合成。本研究检测了Collagen I 的表达,这是心脏成纤维细胞产生的主要胶原蛋白亚型。 研究显示(图3),与假手术组相比,模型组的Collagen I 表达显著升高(P<0.05)。 与模型组相比,沙库巴曲缬沙坦组Collagen I 的表达显著降低(P<0.05)。
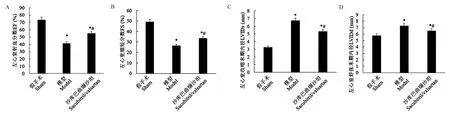
注:A-D:依次为EF、FS、LVIDs 和LVIDd;与假手术组比较,*P<0.05;与模型组比较,#P<0.05。图1 各组大鼠的EF、FS、LVIDs 和LVIDdNote. A-D, EF, FS, LVIDs and LVIDd in sequence. Compared with sham group, *P<0.05. Compared with model group, #P<0.05.Figure 1 EF, FS, LVIDs and LVIDd of each group of rats
2.3 沙库巴曲缬沙坦抑制心力衰竭大鼠心肌TGF-β1/ Smad3 信号通路
TGF-β1/ Smad3 信号通过参与调控心肌梗死后心肌纤维化的原因,本研究显示(图5),与假手术组相比,模型组大鼠心脏组织中TGF-β1 的蛋白表达以及Smad3 的磷酸化水平显著升高,而Smad7 的磷酸化水平显著降低(P<0.05)。 与模型组相比,沙库巴曲缬沙坦组TGF-β1 的蛋白表达以及Smad3 的磷酸化水平显著降低,而Smad7 的磷酸化水平显著升高(P<0.05)。
2.4 沙库巴曲缬沙坦抑制心力衰竭大鼠细胞因子的表达
细胞因子(TNF-α 和IL-6)的表达在心脏重塑和心力衰竭中起着关键作用。 本研究显示(图6),与假手术组相比,模型组TNF-α 和IL-6 的蛋白表达显著升高(P<0.05)。 与模型组相比,沙库巴曲缬沙坦组TNF-α 和IL-6 的蛋白表达显著降低(P<0.05)。
2.5 沙库巴曲缬沙坦抑制心力衰竭大鼠心肌NFκB 信号通路
先前的研究表明,促炎细胞因子诱导IκB 的磷酸化和降解,然后诱导NF-κB 从抑制性信号小体中释放出来,转移到细胞核并诱导许多基因的转录,从而导致炎性因子如TNF-α 和IL-6 的表达。 本研究显示(图7),与假手术组相比,模型组NF-κBp65和p-IκBα 的蛋白表达显著升高(P<0.05)。 与模型组相比,沙库巴曲缬沙坦组NF-κBp65 和p-IκBα 的蛋白表达显著降低(P<0.05)。
3 讨论
心脏重塑是一个复杂的过程,有许多连续和重叠的生物过程[8]。 在早期阶段,心脏重塑是坏死区域纤维化修复并形成疤痕的结果。 接下来,重塑过程由存活心肌的结构重排所驱动,包括心肌细胞肥大、心肌纤维化以及进行性左心室扩张。 心肌梗死后的心室扩张是心脏衰竭的代偿反应之一。 但是,过度扩张会引起心室收缩和舒张功能障碍,从而导致心力衰竭。 预防不良的心室重塑对于降低心肌梗死后心力衰竭的发病率和死亡率非常重要。 已经证实,间质纤维化是心力衰竭后心脏重塑的典型特征,其特征在于细胞外基质(ECM)的过度积累[9]。 Collagen I 和Collagen III 是最丰富的ECM 成分。 在心脏纤维化模型中,Collagen I 比Collagen III表现出更强烈和更长时间的上调。 活化的成纤维细胞是纤维化心脏中胶原蛋白的主要细胞来源。 α-SMA 表达已被广泛用作成纤维细胞分化成活化状态的肌成纤维细胞的标记物[10]。 在本研究中,我们观察到心肌梗死后心力衰竭大鼠心脏中Collagen I和α-SMA 蛋白被上调,这两者均通过沙库巴曲缬沙坦治疗得以抑制,这表明沙库巴曲缬沙坦可能通过抑制成纤维细胞活化和胶原生成而具有抗纤维化作用。
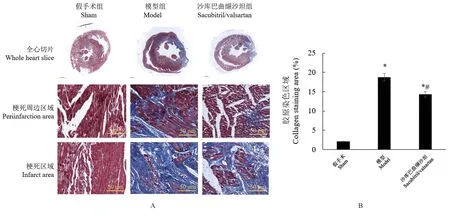
注:A:Masson 三色染色图像;B:胶原染色区域百分比;与假手术组比较,*P<0.05;与模型组比较,#P<0.05。图2 大鼠心脏组织的Masson 三色染色Note, A, Masson three-color staining image. B, Percentage of collagen staining area. Compared with sham group, *P<0.05.Compared with model group, #P<0.05.Figure 2 Masson trichrome staining of rat heart tissue
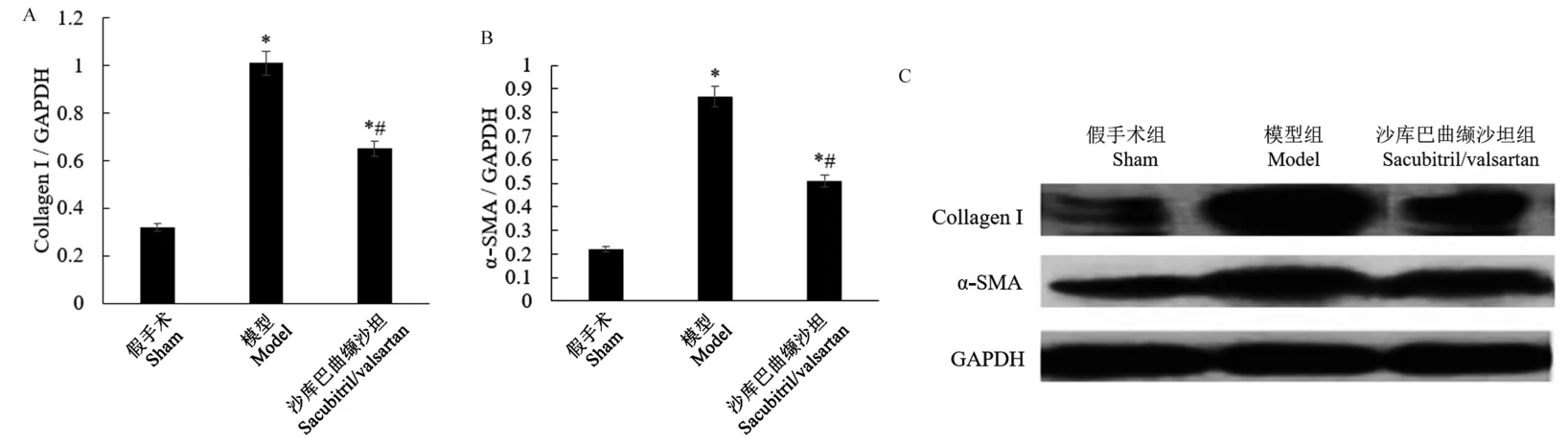
注:A:Collagen I 的蛋白相对表达量;B:α-SMA 的蛋白相对表达量;C:Western blot 代表性条带;与假手术组比较,*P<0.05;与模型组比较,#P<0.05。图3 Western blot 检测大鼠心脏组织Collagen I 和α-SMA 的蛋白表达Note. A, Relative protein expression of Collagen I. B, Relative protein expression of α-SMA. C, Representative Western blot bands. Compared with sham group, *P<0.05. Compared with model group, #P<0.05.Figure 3 Western blot detection of collagen I and α-SMA protein expression in rat heart tissues
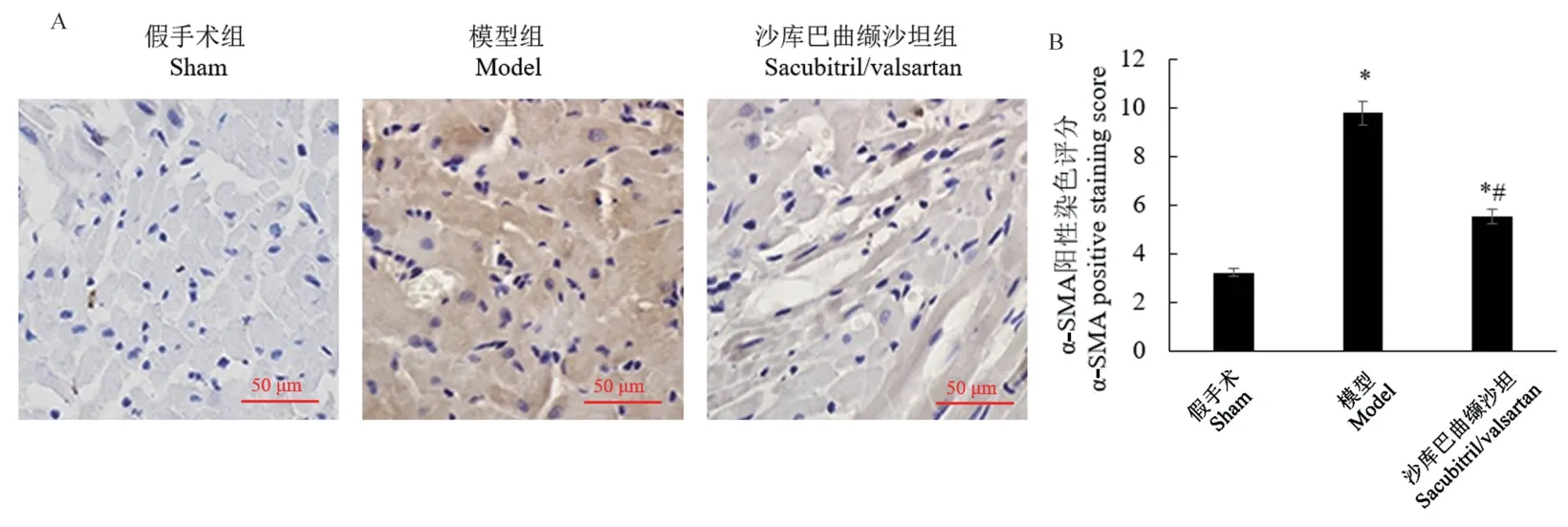
注:A:α-SMA 的免疫组化染色图像;B:α-SMA 的阳性染色评分;与假手术组比较,*P <0.05;与模型组比较,#P<0.05。图4 大鼠心脏组织α-SMA 的免疫组化染色Note. A, immunohistochemical staining image of α-SMA. B, positive staining score of α-SMA. Compared with sham group, *P<0.05. Compared with model group, #P<0.05.Figure 4 Immunohistochemical staining of α-SMA in rat heart tissue
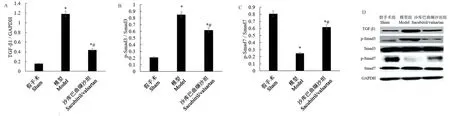
注:A:TGF-β1 的蛋白相对表达量;B:Smad3 的磷酸化水平; C:Smad7 的磷酸化水平;D:Western blot 代表性条带;与假手术组比较,*P<0.05;与模型组比较,#P<0.05。图5 Western blot 检测大鼠心脏组织TGF-β1 的蛋白表达以及Smad3 和Smad7 的磷酸化Note. A, Relative protein expression of TGF-β1. B, hosphorylation levels of Smad3. C, Phosphorylation levels of Smad7.D, Representative Western blot bands. Compared with sham group, *P<0.05. Compared with model group, #P<0.05.Figure 5 Western blot detection of TGF-β1 protein expression and phosphorylation of Smad3 and Smad7 in rat heart tissues
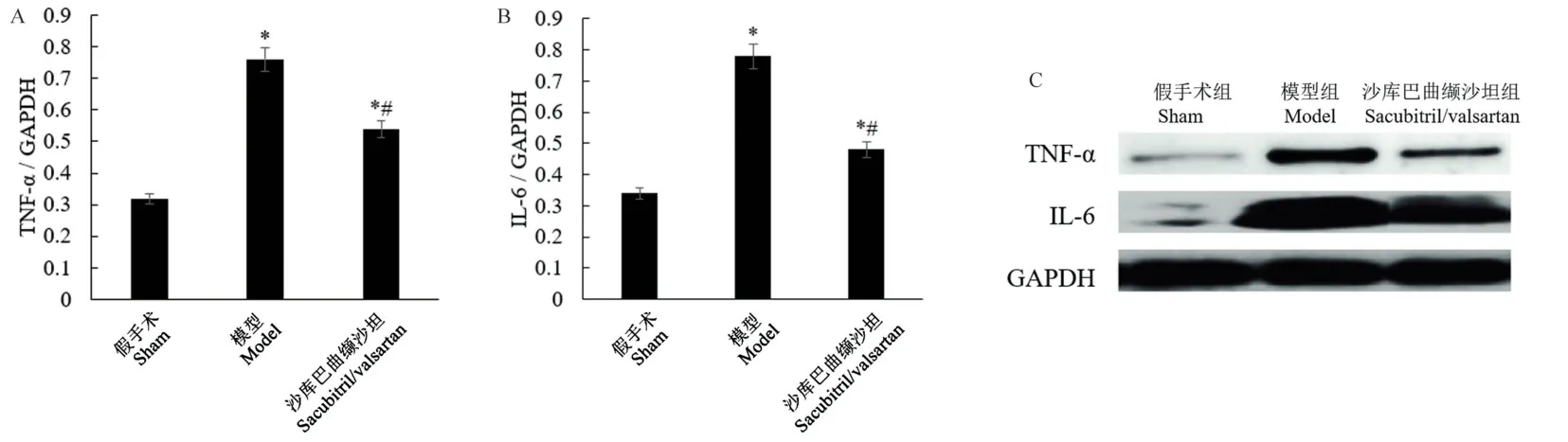
注:A:TNF-α 的蛋白相对表达量;B:IL-6 的蛋白相对表达量;C:Western blot 代表性条带;与假手术组比较,*P<0.05;与模型组比较,#P<0.05。图6 Western blot 检测大鼠心脏组织TNF-α 和IL-6 的蛋白表达Note. A, Relative protein expression of TNF-α. B, Relative protein expression of IL-6. C, Representative Western blot bands. Compared with sham group, *P<0.05. Compared with model group, #P<0.05.Figure 6 Western blot detection of TNF-α and IL-6 protein expression in rat heart tissues
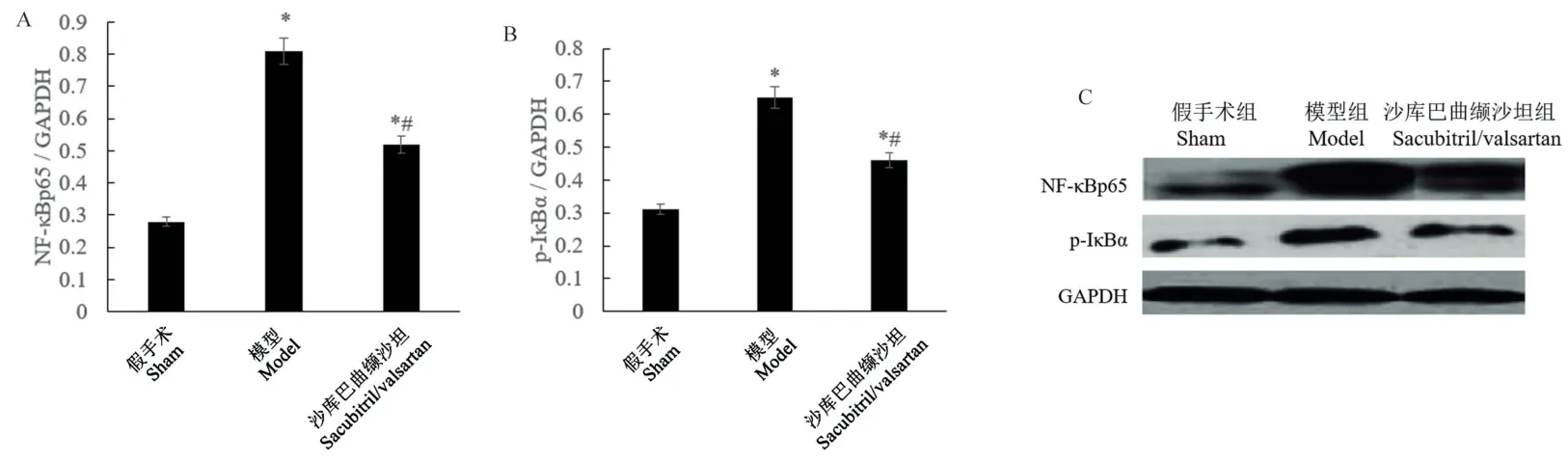
注:A:NF-κBp65 的蛋白相对表达量;B:p-IκBα 的蛋白相对表达量;C:Western blot 代表性条带;与假手术组比较,*P<0.05;与模型组比较,#P<0.05。图7 Western blot 检测大鼠心脏组织NF-κBp65 和p-IκBα 的蛋白表达Note. A, Relative protein expression of NF-κBp65. B,Relative protein expression of p-IκBα. C,Representative Western blot bands. Compared with sham group, *P<0.05. Compared with model group,#P<0.05.Figure 7 Western blot detection of NF-κBp65 and p-IκBα protein expression in rat heart tissues
TGF-β1 是一种局部产生的细胞因子,也是组织纤维炎性变化的主要刺激因子。 在心肌梗死后的大鼠心脏中观察到TGF-β1 明显高表达,它与成纤维细胞向成肌纤维细胞的转化以及典型的Smad 信号通路的激活有关[11]。 作为TGF-β1 的主要下游信号转导子,Smad3 可被激活的TGF-β1 的I 型受体磷酸化,然后与Smad4 形成复合物并易位进入细胞核,在其中它作为转录因子并促进靶基因的表达,包括Collagen I 和Collagen III。 有研究表明,TGF-β的大多数促纤维化活性是由Smad3 介导的[12-13]。Smad7 是一种抑制性Smad 蛋白,能够与Smad3 和TGF-β 受体复合物TGF-βRI 结合竞争,从而阻止随后的信号传导过程。 外源性Smad7 的高表达可以抑制Smad3 的磷酸化[14]。 在本研究中,沙库巴曲缬沙坦均抑制了心力衰竭大鼠心脏中的TGF-β1/ psmad3 信号通路和下游Collagen I 的表达。 同时,在经沙库巴曲缬沙坦治疗的心力衰竭大鼠中,α-SMA表达水平受到抑制。 而p-smad7 表达上调。 这些结果表明,沙库巴曲缬沙坦通过上调Smad7 的蛋白表达来抑制TGF-β1/ Smad3 的信号通路,并进一步抑制成肌纤维细胞的增殖和Collagen I 的上调。
尽管促炎性细胞因子的表达可能与心肌梗死后的伤口愈合有关,但即使在非梗死的心肌中,细胞因子的过表达也会损害心脏组织并引起纤维化成分的过量沉积。 NF-κB 信号通路是炎症的“主要调控者”。 它主要存在于与其抑制剂IκB 蛋白结合的胞质溶胶中。 受细胞因子或其他诱导物刺激后,IκB 蛋白被IκB 激酶降解。 IκB 降解后,NF-κB 易位至细胞核,并与促炎基因调控区域κB 位点的DNA结合并促进其转录[15-16]。 活化的NF-κB 会增加TGF-β1、TNF-α、IL-6 和IL-1β 的表达,从而激活胶原蛋白沉积和心肌纤维化,导致心肌重塑[17-20]。NF-κB 在细胞因子和纤维化因子的协同反式激活中起着关键作用,这些因子与心力衰竭后法心肌损伤有关。 在本研究中,沙库巴曲缬沙坦抑制了心力衰竭大鼠心脏中的NF-κBp65、p-IκB 和下游TGF-β1、TNF-α 和IL-6 的表达。 这些结果表明,沙库巴曲缬沙坦至少部分通过抑制IκB 磷酸化来抑制NF-κB的信号通路并进一步抑制促炎细胞因子的表达。
总之,本研究发现沙库巴曲缬沙坦可预防心力衰竭过程总的心脏重塑。 潜在的机制可能与沙库巴曲缬沙坦对心肌的抗纤维化和抗炎作用有关。沙库巴曲缬沙坦通过抑制胶原蛋白的产生、心脏成纤维细胞的活化和成纤维细胞的形成有效地减轻了心肌纤维化。 沙库巴曲缬沙坦主要通过抑制TGF-β1/ Smad3 信号传导途径来发挥其抗纤维化作用。 另外,沙库巴曲缬沙坦可通过抑制NF-κB 信号传导从而抑制促炎性细胞因子的过度表达。
