Prpf40b 基因缺失诱发大鼠心脏结构异常
2021-05-18刘梦迪董伟张旭陈炜高翔高珊张连峰吕
刘梦迪董 伟张 旭陈 炜高 翔高 珊张连峰吕 丹*
(1.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021; 2.中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021)
剪接体在真核细胞新生RNA 转录物的加工中起重要作用。 剪接体是小核RNA 和蛋白质的复合物,可从初级转录本(pre-mRNA)中去除(剪接)内含子和非常规外显子,从而将识别的外显子组装(剪接)成成熟的mRNA。 它主要是基因特异性的,并且是由于顺式调控序列中的突变指导了外显子的剪接识别[1]。 但是,已知有越来越多的突变靶向剪接体的组分,因此潜在地产生了全局而非基因特异性的RNA 剪接变化。 剪接位点的识别可以通过跨越内含子以及跨越外显子两种机制进行,该方式可极大的增加蛋白质的多样性和基因表达的复杂程度[2-3]。
近十年来,已有多篇研究报道剪接复合体相关基因突变与多种临床疾病相关[4-5]。 而PRPF40B是已发现的编码剪接体化合物的基因之一,该类基因还包括, SF3B1, SRSF2, U2AF1, ZRSR2, SF1,SF3A1 及U2AF2。 前mRNA 加工因子(Pre-mRNA processing factor,PRPF)是研究发现的一种参与前mRNA 剪接的蛋白质。 人PRPF 基因编码一个1007个氨基酸的蛋白质,包含一个N-末端340 个氨基酸的富含Arg/Ser 的结构域,该结构域通常存在于前mRNA 剪接因子中。 PRPF 的催化结构域与细胞周期蛋白依赖性激酶和丝裂原活化蛋白激酶具有同源性[6]。
PRPF40B 属于U2 核糖核蛋白体依赖型剪接复合体相关基因,目前,已有研究表明PRPF40B 基因突变, 与骨髓增生异常综合征(myelodysplastic syndromes,MDS),慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)和急性粒细胞白血病(acute myeloid leukemia,AML)有关[7-10]。 在患有骨髓恶性肿瘤的患者中,已经描述了八个核心剪接体基因中的体细胞突变-SF3B1, SRSF2, U2AF35( U2AF1 ), ZRSR2, SF3A1, PRPF40B, U2AF65(U2AF2),其中PRPF40B 的突变发生频率为1%左右[1,11-12]。 此外,有研究表明PRPF40B 基因突变还与多种实体肿瘤发生相关,包括乳腺癌,肝癌,胰腺癌和黑色素瘤等[2,13]。
所以, 为深入研究剪接复合体相关基因PRPF40B 的生物学作用,动物模型是重要的工具,本实验室依托研究所和基因工程技术平台,利用CRISPR/Cas9 技术首次构建了PRPF40B 基因敲除大鼠模型,为开展该基因的生物学功能研究,以及其在多种疾病病理进程中所扮演角色的深入研究,提供了体内动物模型工具。 并且在初步的研究分析中,发现该基因敲除可诱发心脏结构形态异常改变。
1 材料和方法
1.1 实验动物
12 月龄雄性SPF 级Prpf40b 基因敲除SD 大鼠及同窝对照大鼠各6 只,体重550 ~720 g,由中国医学科学院医学实验动物研究所实验动物资源研究中心建立及培育,同时敲除大鼠培育过程中使用的SD 大鼠,均购自北京维通利华实验动物技术有限公司[SCXK(京)2019-0011]。 大鼠饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK(京)2019-0014],同时动物饲养间采用12 h交替明暗照明,动物自由饮水摄食。 同时,动物实验中涉及的动物操作程序已得到中国医学科学院医学实验动物研究所实验动物使用及管理委员会(IACUC)的批准(ZLF18003),实验过程中遵循了3R 原则。
1.2 主要试剂与仪器
PCR 引物由北京天一辉远生物科技有限公司合成;4%甲醛溶液购自北京益利精细化学品有限公司;DNA 提取试剂盒购自北京全式金生物技术有限公司;琼脂糖购自西班牙Biowest Agarose 公司;凝胶电泳仪购自美国伯乐公司;组织脱水机、石蜡包埋机、石蜡切片机购自德国徕卡公司;PCR 仪购自美国伯乐公司;气体麻醉机购自英国斯特普科技有限公司;病理切片扫描机购自德国徕卡公司;小动物成像系统Vevo3100 购自加拿大VisualSonics 公司。
1.3 实验方法
1.3.1 载体构建及基因型鉴定(vector construction and genotyping)
利用本实验室已经建立的成熟的CRISPR/Cas9技术操作平台[14],构建Prpf40b 基因敲除大鼠。 首先研究人员依据Prpf40b 基因第二外显子,设计sgRNA,并利用MEGAshortscript T7 转录试剂盒(AM1354,Ambion,美国)。 将Cas9 蛋白(30 ng/μL)和sgRNA(皆10 ng/μL)混合后,经显微注射到受精卵、移植至假孕母子子宫内,手术完成后常规饲养。
对出生后仔鼠,制备组织基因组,经PCR 鉴定其基 因 型, PCR 引 物: 5’ TCCTCGACAGCCACA TACTCAG3’ 及5’ GTCTTCACTTCGACCTGGTTCA G3’。 PCR 条件:94℃预变性4 min,94℃变性20 s,60℃退火1 min,72℃延伸1.5 min,35 个循环。 野生条带和敲除条带分别是1890 bp 和809 bp。
1.3.2 超声影像分析技术(echocardiography analysis)
大鼠经异氟烷(1.5%~2.5%)麻醉,胸前区脱毛,仰卧位固定于加热板上,保持体温恒定,同时四肢固定,待呼吸平稳后,利用16 兆赫兹探头(Vevo3100, 加拿大),经胸前区长轴和短轴两个切面,采集B-mode 和M-mode 信号,经3100 信号及数据分析系统,导出超声参数,包括左室收缩末期内径 ( LVESD, left ventricular ( LV ) end-systole diameter); 左室 舒张 末 期内 径( LVEDD, left ventricular(LV)end-diastole diameter);左室收缩末期容积(LVESV, left ventricular (LV) end-systole volume); 左室舒张末期容积( LVEDV, left ventricular(LV)end-diastole volume);每搏输出量(SV, stroke volume)等。
1.3.3 病理组织学分析(histological analysis)
大鼠经安乐死后,摘取心脏,经生理盐水清洗后,固定于4%甲醛中固定48 h。 随后经脱水后的心脏组织经智能石蜡包埋机包埋制备成蜡块,推拉式切片机进行切片(切片厚度4 μm),恒温烤箱将切片烤干后,经全自动染色机完成HE(hematoxylineosin stain)染色,自动封片机完成封片。 切片扫描(徕卡TCS SP2, 德国) 后经Aperio ImageScope v8.2.5 软件分析并导出病理图片。
1.4 统计学方法
数据采用GraphPad Prism 7 统计软件处理,数据以平均数±标准误差(±s)来表示,均数间采用Student’st-tests 分析,P<0.05 为有显著性差异。
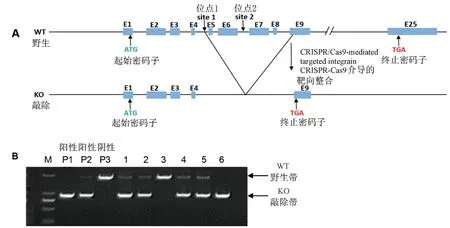
注:A:利用CRISPR/Cas9 技术,Prpf40b 基因敲除大鼠构建示意图,site1、site2:靶点设计位置。 B:Prpf40b 基因敲除大鼠基因型PCR 鉴定电泳凝胶图像,P1~P3 分别是敲除纯合子,杂合子及同窝野生型对照孔;1、2、4、5:敲除杂合子大鼠基因型条带;3:同窝野生型基因型条带;6:敲除纯合子大鼠基因型条带。图1 Prpf40b 基因敲除大鼠构建及鉴定Note. A, Schematic diagram of Prpf40b knockout rat with CRISPR/Cas9 technology. site1/site2,target design sites.B,Genotyping identification of Prpf40b knockout rat through PCR. P1 ~P3, Sample for reference of homozygosis,heterozygosis and wild-type. 1,2,4 and 5, Heterozygosis band. 3, Wild-type band. 6, Homozygosis band.Figure 1 Establishment and genotyping of Prpf40b knockout rat
2 结果
2.1 Prpf40b 基因敲除大鼠的建立及繁育
利用CRISPR/Cas9 技术,建立Prpf40b 基因敲除大鼠,经测序及PCR 技术鉴定,敲除大鼠第5、6、7、8 以及部分第9 外显子已敲除,构建示意图见图1A。
将首建鼠与野生型SD 大鼠进行杂交,PCR 技术鉴定仔代鼠基因型,仔代敲除杂合子大鼠间再进行第二轮杂交,仔代大鼠即可获得敲除纯合子,PCR鉴定示意图见图1B。
观察至12 月龄时,Prpf40b 基因敲除杂合子和纯合子大鼠外观形态及体重等,未见明显异常。 随后的心脏超声影像学及病理组织学实验,皆选取Prpf40b 基因敲除纯合子大鼠及同窝阴性大鼠进行观察及分析。
2.2 Prpf40b 基因敲除大鼠心脏结构及功能分析
经基因型鉴定后,选用2 月龄Prpf40b 基因敲除大鼠和同窝阴性对照大鼠,进行心脏超声影像分析,结果显示,与同窝阴性大鼠相比,敲除大鼠心脏结构及形态各参数未见明显异常(数据未列出)。
随后选用12 月龄敲除大鼠和同窝阴性对照大鼠,进行心脏超声影像分析,同时采集B-mode 和Mmode 影像。 通过M-mode 影像观察,12 月龄敲除大鼠,左室内径明显减小(图2)。
随后通过Veov3100 分析系统分析并导出各超声参数,结果显示,左室舒张末期内径(LVEDD, left ventricular(LV)end-diastole diameter)显著变小,减少了15.6%(图3A,P=0.0069);左室收缩末期内径 ( LVESD, left ventricular ( LV ) end-systole diameter)显著变小,减少了22.2%(图3B,P=0.0134); 左室舒张末期容积( LVEDV, left ventricular(LV)end-diastole volume)显著降低,降低了31.5%(图3C,P=0.0068);左室收缩末期容积(LVESV, left ventricular(LV)end-systole volume)显著降低,降低了44.1%(图3D,P=0.0057);同时,每搏输出量(SV, stroke volume)和心输出量(CO,cardiac output)显著降低,分别降低了26.1%(图3E,P= 0.0229)和25.9%(图3F,P= 0.0306)。
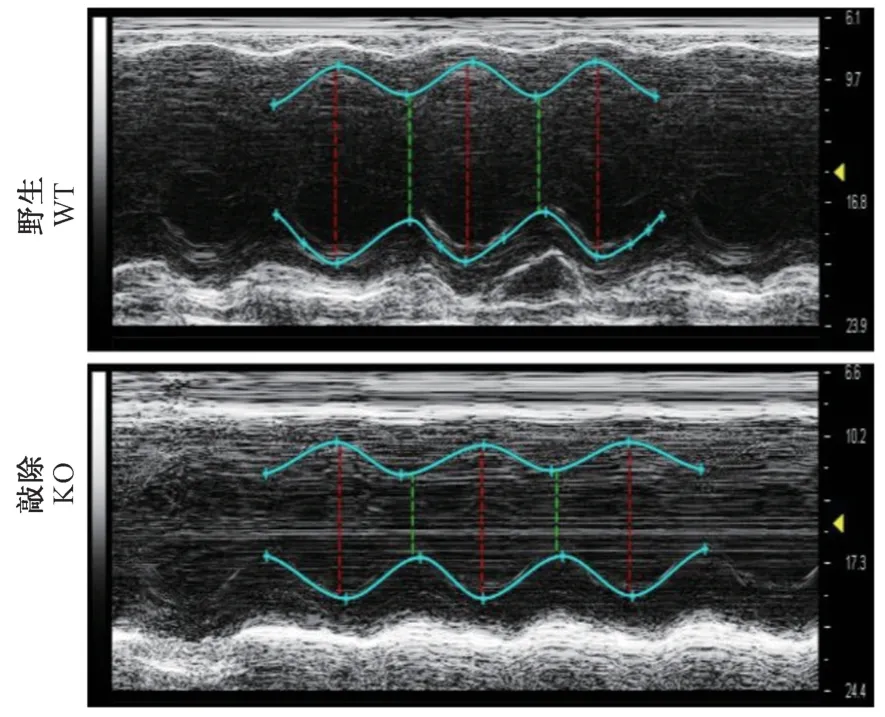
图2 Prpf40b 基因敲除大鼠超声影像分析M-mode 截图Figure 2 M-mode screenshot from echographic analysis in Prpf40b knockout rat
2.3 Prpf40b 基因敲除大鼠心肌组织学观察
通过超声影像分析,12 月龄Prpf40b 基因敲除大鼠心脏结构形态出现异常,随后我们选取12 月龄敲除大鼠,经摘取心脏,常规固定并制备心肌组织石蜡切片,随后进行HE 染色,切片扫描后经Aperio分析心肌组织学改变。
与同窝阴性对照大鼠相比,敲除大鼠心脏整体变小,心室腔变小(图4A),这与敲除大鼠通过超声影像学观察到的结果一致。 在显微水平,与同窝阴性对照大鼠相比,敲除大鼠心肌纤维出现排列不齐,心肌纤维粗细不均一,同时,心肌纤维间肌浆网明显扩张,以及心肌纤维染色着色不均一等现象(图4B)。
同时,我们通过统计12 月龄敲除大鼠心脏湿重与体重比值,即心重体重比(HW/BW, heart weight/body weight),进一步确认心脏形态学改变。 结果我们发现,敲除大鼠心重体重比显著下降,下降了15.6%(图4C,P=0.0348),与超声影像学及病理组织学观察结果一致。
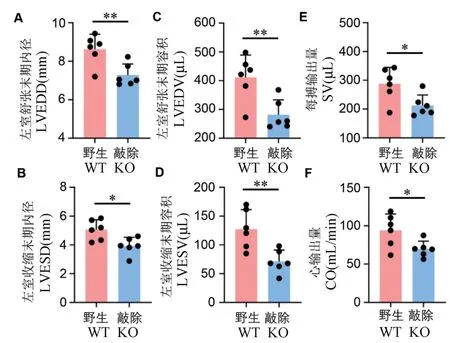
注:A:LVEDD,左室舒张末期内径;B:LVESD,左室收缩末期内径;C:LVEDV,左室舒张末期容积;D:LVESV,左室收缩末期容积;E:SV,每搏输出量;F:CO,心输出量。 与野生对照组比较,*P<0.05,**P<0.01。图3 Prpf40b 基因敲除大鼠超声影像参数分析Note. A, LVEDD, left ventricular(LV)end-diastole diameter. B,LVESD,left ventricular(LV)end-systole diameter. C, LVEDV, left ventricular(LV)end-diastole volume. D, LVESV, left ventricular(LV)end-systole volume. E, SV, stroke volume. F, CO, Cardiac output. Compared with wild type rats, *P<0.05, **P<0.01.Figure 3 Echography parameter analysis in Prpf40b knockout rat
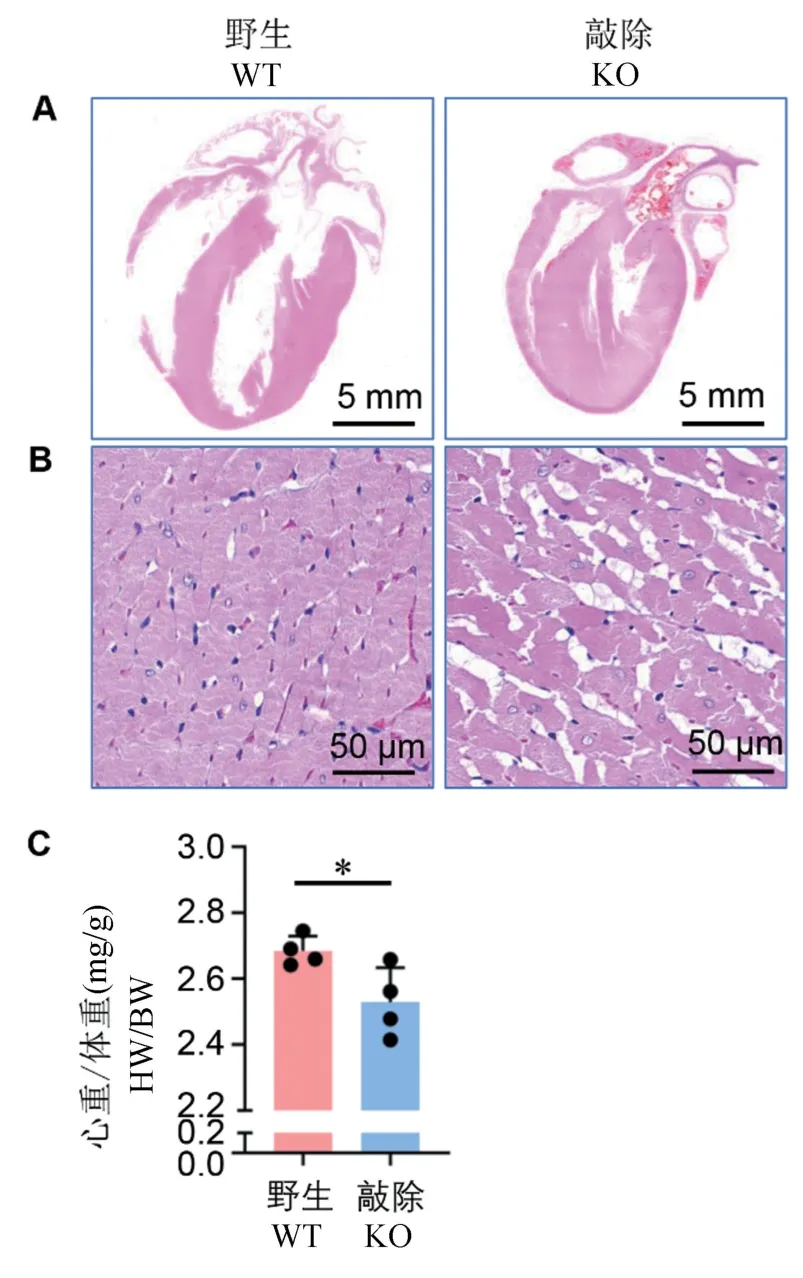
注:A:12 月龄Prpf40b 敲除大鼠心脏长轴整体切片HE 染色;B:敲除大鼠心脏长轴整体切片HE 染色高倍截图;C:敲除大鼠心重体重比。 与野生对照组比较,*P<0.05。图4 Prpf40b 基因敲除大鼠病理组织学分析Note. A, The whole-heart longitudinal sections with HE staining from Prpf40b knockout rat at 12 months old. B, Magnification of the whole-heart longitudinal sections with HE staining from Prpf40b knockout rat. C, Ratio of heart weight/ body weight.Compared with wild type rats, *P<0.05.Figure 4 Histological analysis in myocardial of Prpf40b knockout rat
3 讨论
酵母剪接因子Prp40 是一种必需的U1-snRNP相关蛋白,作为支架参与剪接体复合物形成的早期步骤。 Prp40 的两种哺乳动物同源基因包括PRPF40A,也被称为HYPA(亨廷顿相互作用蛋白A) 或 FBP11 ( formin-binding protein 11 ) 和PRPF40B,即已知的HYPC(亨廷顿相互作用蛋白C)[15]。
研究表明PRPF40A 和PRPF40B 参与剪接体的早期组装,但功能尚不清楚。 PRPF40B 与神经系统疾病的发病机制有关,包括亨廷顿病和Rett 综合征。 此外, 近几年骨髓增生异常综合征(myelodysplastic syndromes,MDS)中检测到参与剪接位点识别的剪接体成分的突变[16]。 PRPF40B 是剪接体突变检测到的靶点之一,在整个开放阅读框架中,PRPF40B 的变化以错义突变的形式出现,提示这些突变可能导致功能丧失。 PRPF40B 定位于富含剪接因子的核斑点,结合SF1 和U2AF65,并在体内调节多种剪接事件。 研究显示PRPF40B 缺失增加了Fas/CD95 受体数量和细胞凋亡,表明PRPF40B 能够改变关键凋亡基因的选择性剪接来调节细胞存活。 这些结果支持了PRPF40B 在导致外显子选择性剪接的早期事件中的作用,并可能为PRPF40B 相关疾病的分子机制提供重要参考[17]。
以往的研究表明,PRPF 的突变导致细胞周期中前mRNA 的积累和G1/S 转换受损。 PRPF 对激酶、转录因子、染色质重塑因子、纺锤体检查点蛋白和癌细胞生长具有不同的作用。 PRPF 被证明是U5 snRNP 相关激酶,PRPF 与BRG1 和N-CoR 相互作用,这是核激素共激活和共抑制复合物的两个组成部分。 PRPF 与U5-snRNP 和N-CoR 脱乙酰酶复合物相关,被认为可以协调转录调控中的前mRNA剪接和染色质重塑事件[18-20]。 PRPF 可触发上皮间质转化(epithelial-mesenchymal transition, EMT),降低HCT116、PC3、B16-F10 黑色素瘤细胞的侵袭性。PRPF 可通过激活细胞生存信号通路、重新排列肌动蛋白骨架和诱导EMT 来阻断白藜芦醇的凋亡作用。
PRPF40B 可抑制髓系细胞缺氧,其低表达可能导致白血病的发生[21]。 目前已有报道PRP6、SWAP 和PNN 与PRPF 相互作用,并且PRPF 被证明是U5 snRNP 相关激酶。 特别是,小核糖核蛋白复合物的成员PRPF6 被证明能促进结肠癌的增殖。最近的研究表明,各种选择性剪接事件模式的改变在结肠癌的发生和发展中起着重要的作用[6]。
Prp40 蛋白结构与人类中相对少量的蛋白(包括PRPF40A,PRPF40B 和hTCERG1)共有,它们均参与剪接和转录延伸的偶联。 最接近的人类直系同源物PRPF40A 的功能与酵母Prp40 类似。PRPF40A 的WW 域对于其定位到核斑点至关重要。 PRPF40A 与SF1 和U2AF 相互作用,它存在于剪接体复合体A 和B 中,但不存在于C 中,这与Prp40 在早期剪接体组装中的作用一致。 PRPF40A与U2-snRNP 和参与转录延伸的蛋白质可发生免疫共沉淀。
PRPF40A 和PRPF40B 都通过Pol II CTD 与延伸复合物相互作用调节共转录剪接,并且都与亨廷顿氏病大脑中扩展的亨廷顿多谷氨酰胺束结合,并参与其他神经退行性综合征。 即使PRPF40B 不具有任何RNA 识别基序(RRM),它也可能通过桥接5′s 的U1 和与BPS 结合的SF1 来调节AS。 此外,PRPF40B 控制重要凋亡基因(例如Fas)的其他剪接位点的选择。 PRPF40B KO 上调了低氧信号,再加上其在AML 中的低表达,提示该SF 在髓样白血病中的作用。 在 Akt/MAPK 通路中发现了PRPF40B 调控的酶的PPI 聚集,这是已知的相互调节缺氧的途径[21]。
在本研究中我们发现PRPF40B 基因敲除可诱发模型大鼠心脏结构形态的改变,包括整体结构形态及显微形态的改变,其机制可能与该基因控制重要凋亡基因相关,但具体的诱导机制,还需要后续深入的分子机制研究。 同时本文建立的PRPF40B基因敲除大鼠为该基因参与多种疾病病理进程调控的作用研究,提供了体内工具动物,为剪接复合体相关基因的功能研究提供了实验基础。
