基于网络药理学研究杨桃根防治糖尿病肾病的作用机制
2021-05-11张宏亮黄天敏黄光明黄仁彬黄振光
张宏亮,蒋 霞,黄天敏,丘 岳,黄光明,黄仁彬,黄振光
广西医科大学第一附属医院药学部,南宁 530021
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病的主要并发症之一,亦是发达国家和地区终末期肾病(end-stage renal disease,ESRD)的首要原因[1]。目前对于DKD,尚缺乏特异性的治疗药物。临床上主要通过控制血糖、血压、血脂、尿酸以及使用肾素-血管紧张素系统抑制剂、改善肾脏微循环药物等延缓DKD进展[2]。
中草药由于其多组分、多途径、多靶点的优势,在复杂疾病的防治方面显示了良好的效果。我们前期开展了若干抗DKD中草药及其活性成分的研究,发现酢浆草科属植物杨桃根(the root ofAverrhoacarambolaL.,RAC)在防治DKD方面显示了良好的优势[3],但作用机制不明。网络药理学是基于整体性与系统性的一种研究方法,将药物-靶点与生物信息网络相结合,类似于中医提出的整体、辨证的观点[4]。基于此,我们将采用网络药理学方法,构建杨桃根主要成分与DKD共有靶点,探讨杨桃根防治DKD的潜在作用机制。
1 研究方法
1.1 杨桃根有效成分筛选
根据我们课题组前期关于杨桃根物质基础的研究结果[5,6],结合查询关于杨桃根成分的文献,建立成分库。通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/search/)和Chemspider数据库(http://www.chemspider.com/Default.aspx),查询已鉴定的成分的Canonical SMILES 字符串。
1.2 靶点筛选
杨桃根成分的靶点预测采用Swiss Target Prediction数据库( http://www.swisstargetprediction.ch/)。该数据库通过2D和3D结构相似性的特点,间接预测化合物的作用靶点[7]。具体操作为,将上一步查询到的Canonical SMILES字符串输入Swiss TargetPrediction网站,从而获得每一成分的潜在靶点。
DKD疾病靶点预测采用GeneCards数据库(https://www.genecards.org/)。分别以“Diabetic Kidney Disease”,“Diabetic nephropathy”作为关键词进行检索,以相关性分数(Relevance score≥30)作为筛选条件,从而得到DKD相关靶点。
进一步,利用网络平台绘制韦恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/),获得杨桃根主要成分与DKD的共有基因靶点信息,即得到杨桃根防治DKD的潜在作用靶点。
1.3 活性成分-靶点网络构建
参考目前发表的文献,用Cytoscape 3.8.0软件构建活性成分-靶点的可视化网络,然后对该网络进行拓扑分析获得各节点的中心度值(degree)[8]。
1.4 靶点蛋白PPI网络构建及关键靶点筛选
利用String11.0在线数据库对靶点蛋白相互作用(protein protein interaction,PPI)进行分析。具体操作为,将靶点输入String,物种选择“Homo sapiens”,以得分>0.4作为筛选条件,得到PPI网络图。
进一步,将PPI数据导入Cytoscape软件,利用Cytoscape的CytoHubba插件筛选hub gene。
1.5 GO和KEGG通路富集分析
利用WebGestalt在线数据库对关键靶点进行GO和KEGG分析,以P≤0.05为临界,获取GO及KEGG信号通路结果。
1.6 动物实验验证
1.6.1 实验动物
SPF级KM雄性小鼠60只,体重20±2 g,购自广西医科大学实验动物中心,动物合格证号SCXK(桂)2015-0001。小鼠饲养条件为:温度25±2 ℃,相对湿度50%±20%,光照/黑暗交替12/12h,且自由进食、饮水。
1.6.2 杨桃根有效成分提取
杨桃根药材粉碎,加8倍量60%乙醇-水浸泡30 min,常压下加热回流提取3次,每次1 h,滤过合并提取液;减压回收乙醇,即得杨桃根提取物。
1.6.3 动物建模及给药干预
所有小鼠适应性喂养1周后,随机地分为两组,空白对照组及模型组。空白对照组给予水和普通饲料,模型组给予高糖高脂饲料。高糖高脂饲料配方见本课题组以前发表的文献[3]。连续喂养4周后,禁食过夜,单次腹腔注射链脲佐菌素(streptozotocin,STZ)110 mg/kg;当血糖维持在11.2~16.7 mmol/L时即为造模成功。
除10只空白对照组小鼠外,其余50只小鼠随机分为5组(模型组,阳性对照组,杨桃根高、中、低剂量组),每组各10只。
杨桃根提取物高、中、低剂量组(RAC-H、RAC-M、RAC-L)分别给予1.2、0.6、0.3 g/kg/d灌胃,并同时给予高糖高脂饲料。阳性对照组(GQ)给予格列喹酮溶液灌胃(10 mg/kg/d并同时给予高糖高脂饲料。模型组(DM)仅给予高糖高脂饲料,空白对照组(NC)仅给予蒸馏水灌胃。
1.6.4 样品的采集和处理
连续干预4周后,小鼠隔夜禁食12 h,测量空腹血糖,取血检测相关指标,并用Western blot法检测相关蛋白的表达。
1.6.5 统计学分析
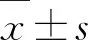
2 结果
2.1 活性成分筛选
根据我们课题组前期关于杨桃根物质基础的研究结果,结合查询关于杨桃根成分的文献,目前杨桃根的主要成分有24个,根据结构信息查询得到所有成分的Canonical SMILES字符串,结果见表1。

表1 杨桃根主要活性成分及Canonical SMILES字符串

续表1(Continued Tab.1)
2.2 活性成分治疗疾病相关靶点的筛选
根据Swiss Target Prediction 网站对24个活性成份进行靶基因预测,共得到2 331个相关靶点,进一步排除重复靶点,共得到潜在靶点281个。整理“成分-靶点”对,然后导入Cytoscape 3.8.0,建立“成分-靶点”网络,如图1。由图可知,该网络共有663条边,305个节点。305个节点中,24个红色节点代表杨桃根的每一个成分,281个蓝色节点代表与成分对应的靶点,即潜在相关靶点。
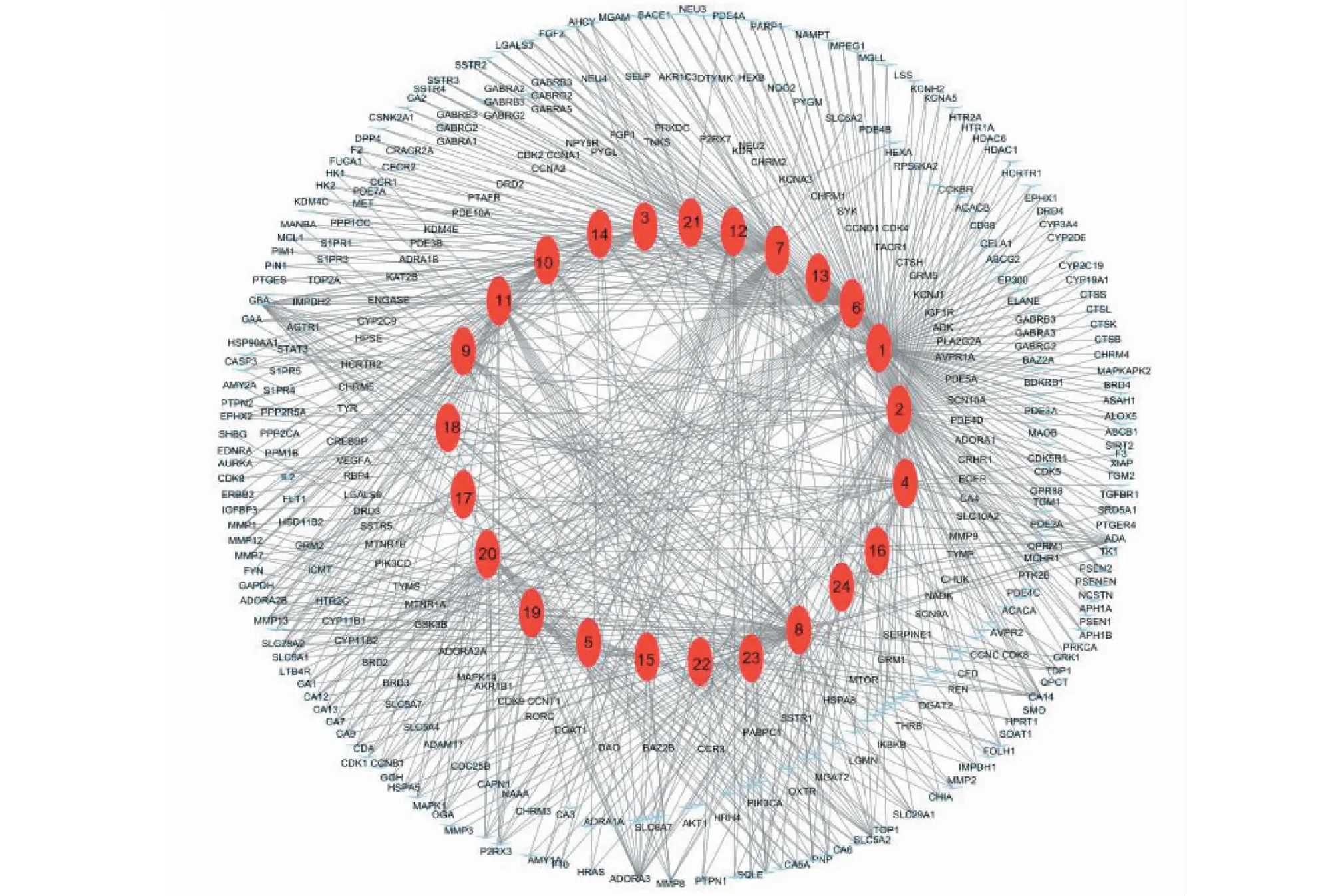
图1 成分-潜在相关靶点网络图
2.3 DKD靶点预测结果
从Genecards数据库中筛选得到14 329个DKD相关靶点,去除重复后得到662个潜在靶点。然后根据281个成分靶点与662个疾病靶点绘制韦恩图(见图2),从而获得DKD共性靶点基因59个。
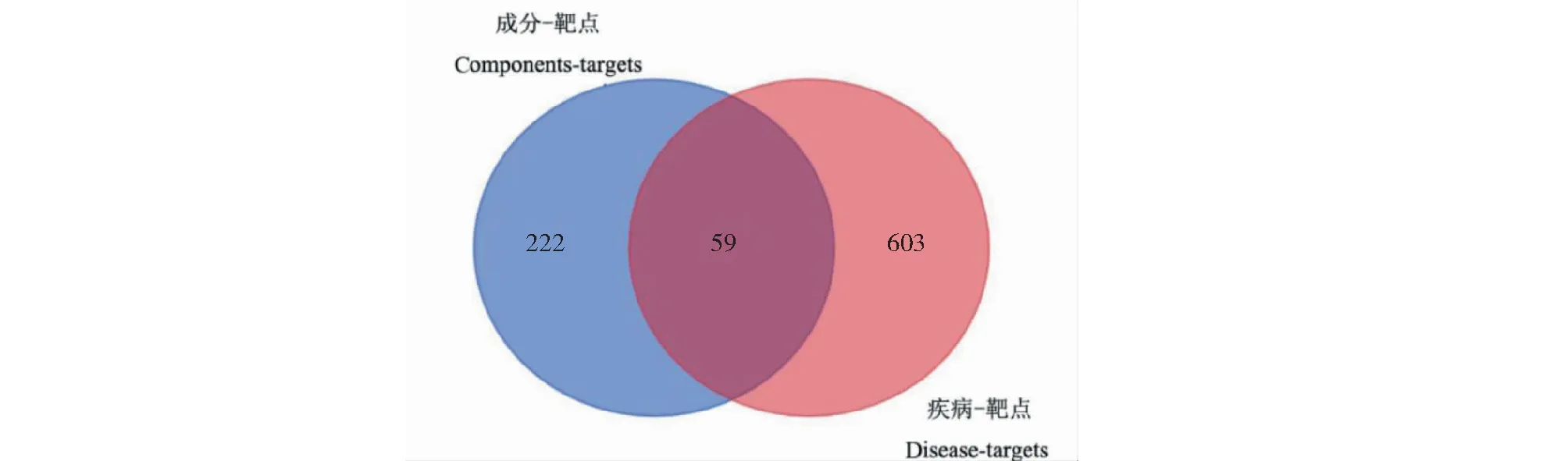
图2 杨桃根提取物成分与DKD靶点韦恩图
2.4 疾病靶蛋白相互作用网络构建
将DKD共性靶点基因导入STRING在线数据库,查询59个共性靶点的相互作用关系,进行可视化分析后获得疾病靶蛋白相互作用(PPI)网络(图3),其节点数为59,边数为461,平均节点度为15.6。
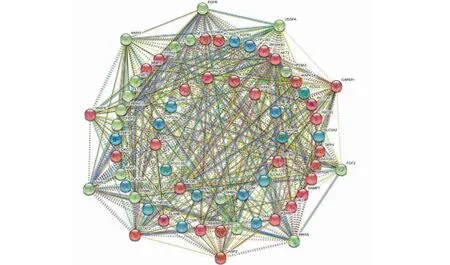
图3 杨桃根防治DKD潜在靶点的PPI网络图
2.5 关键靶点的筛选
将PPI数据导入Cytoscape软件中,利用CytoHubba插件中的MCC算法筛选最重要的10个关键基因(图4)。这些关键基因包括:基质金属蛋白酶9(MMP9)、表皮生长因子受体(EGFR)、成纤维细胞生长因子2(FGF2)、信号转导和转录激活子3(STAT3)、丝裂原激活的蛋白激酶1(MAPK1)、基质金属肽酶2(MMP2)、血管内皮生长因子A(VEGFA)、半胱天冬酶3(CASP3)、原癌基因Hras(HRAS)和甘油醛-3-磷酸脱氢酶(GAPDH)。
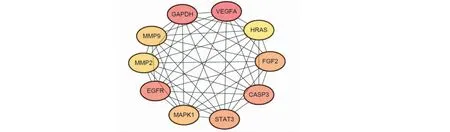
图4 CytoHubba筛选关键靶点的网络图
2.6 活性成分-关键靶点网络分析
根据筛选得到的活性成分和10个关键靶点,利用Cytoscape软件构建活性成分-靶点网络图,见图5所示。由图可知,该网络共有节点24个,边32条,其中14个节点代表杨桃根成分,用红色标示,10个节点代表潜在关键靶点,用蓝色标示。
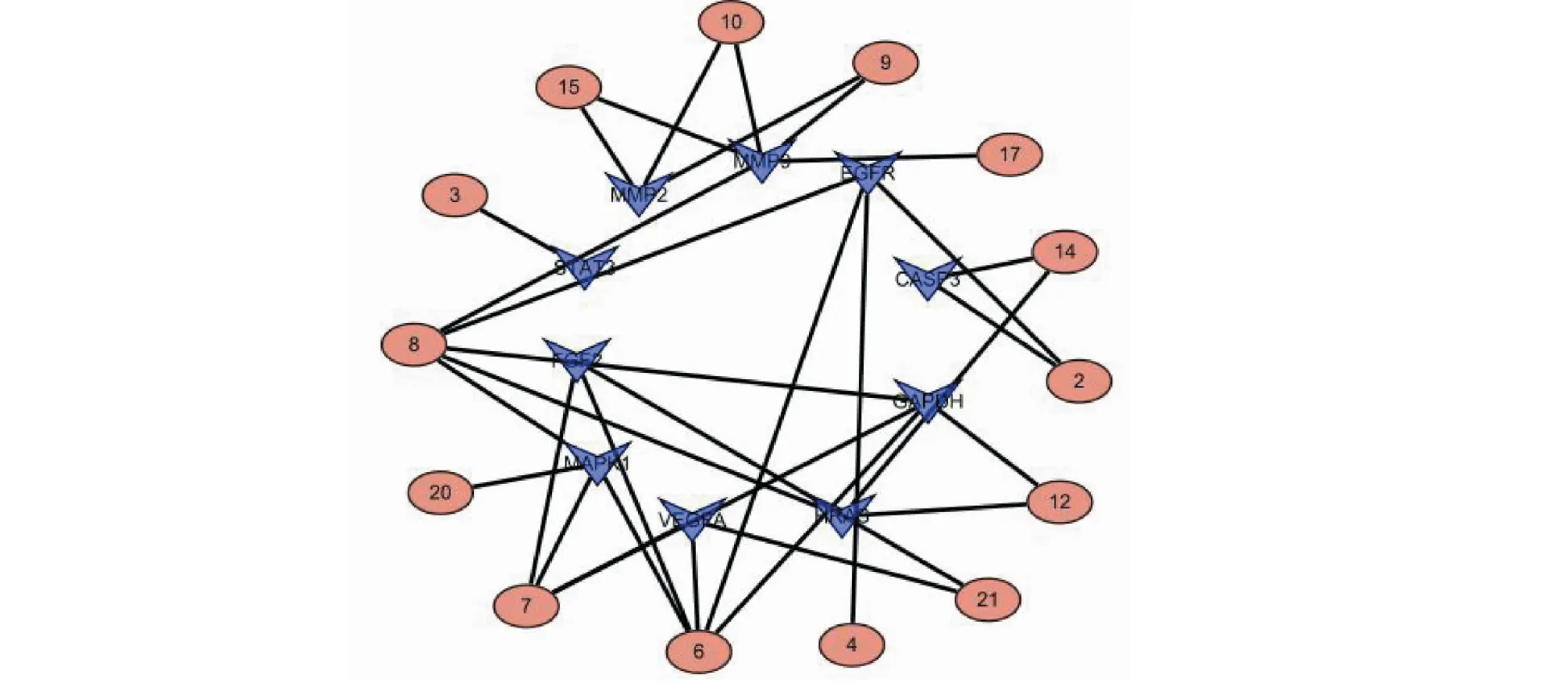
图5 杨桃根防治DKD活性成分-关键靶点网络图
2.7 靶点的 GO 生物功能注释
GO富集分析主要包括生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)三部分。利用WebGestalt对10个关键靶基点进行GO生物功能注释,并分别对前10个条目进行可视化分析,见图6。图中横坐标为标准化富集分数,纵坐标表示富集条目。
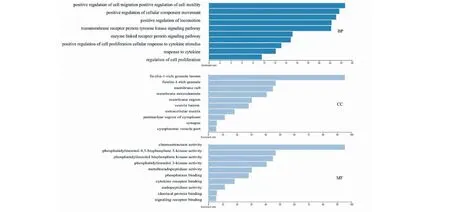
图6 杨桃根防治DKD关键靶点GO富集柱状图
在生物过程(BP)中,主要富集条目为:调控细胞迁移(positive regulation of cell migration)、调控细胞运动(positive regulation of cell motility)、调控细胞成分的运动(positive regulation of cellular component movement)、运动调控(positive regulation of locomotion)、跨膜受体蛋白酪氨酸激酶信号通路(transmembrane receptor protein tyrosine kinase signaling pathway)、酶联受体蛋白信号通路(enzyme linked receptor protein signaling pathway)、细胞增殖调控(positive regulation of cell proliferation)等。
在细胞组成(CC)中,富集条目主要分布于:富含纤维胶凝蛋白的颗粒内腔(ficolin-1-rich granule lumen)、膜筏(membrane raft)、膜微区(membrane microdomain)、膜区(membrane region)、囊泡腔(vesicle lumen)等。
在分子功能(MF))中,富集条目主要分布于:趋化活性(chemoattractant activity)、磷脂酰肌醇-4,5-双磷酸3-激酶活性(phosphatidylinositol-4,5-bisphosphate 3-kinase activity)、磷脂酰肌醇二磷酸激酶活性(phosphatidylinosital bisphosphate kinase activity)、磷脂酰肌醇3-激酶活性(phosphatidylinasitol 3-kinase activity)、金属内肽酶活性(metalloendopeptidase activity)、磷酸酶结合(phasphatase binding)、细胞因子受体结合(cytokine receptor binding)、内肽酶活性(endopeptidase actirity)等。
2.8 KEGG通路富集分析
利用WebGestalt在线数据库对10个关键靶基点进行KEGG富集分析,结果进行可视化分析,得到KEGG富集分析柱状图(见表2)。由表可知,关键靶点主要富集通路如下:蛋白聚糖与肿瘤(proteoglycans in cancer)、膀胱癌(bladder cancer)、肿瘤相关microRNA(microRNAs in cancer)、EGFR酪氨酸激酶抑制剂耐药(EGFR tyrosine kinase inhibitor resistance)、癌症通路(pathways in cancer)、糖尿病并发症AGE-RAGE通路(AGE-RAGE signaling pathway in diabetic complications)、松弛素信号通路(relaxin signaling pathway)、卡波西氏肉瘤相关疱疹病毒感染(kaposi sarcoma-associated herpesvirus infection)、内分泌抵抗(endocrine resistance)、缺氧诱导因子信号通路(HIF-1 signaling pathway)。
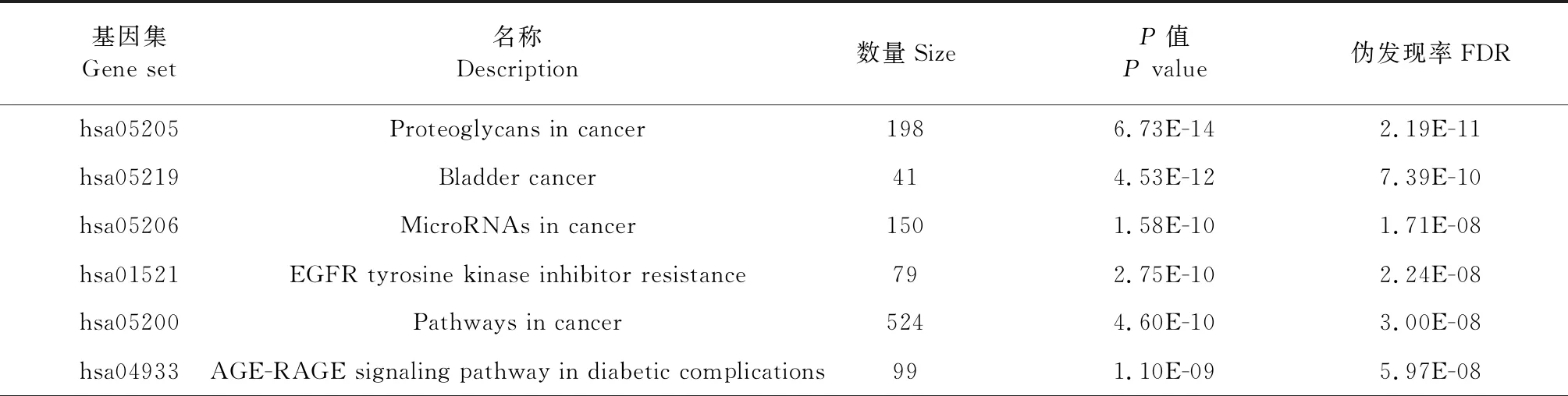
表2 杨桃根防治DKD关键靶点的KEGG富集分析图

续表2(Continued Tab.2)
2.9 动物实验验证结果
2.9.1 小鼠肾功能变化
胱抑素C(CysC)作为一种敏感性好、特异性高的标志物,可以在肾损伤早期做出准确的预测。在本研究中,模型组的CysC水平均明显增加(P<0.05);当给予不同剂量的杨桃根提取物干预后,各组的CysC水平均明显下降,且呈剂量依赖性(P<0.05)。尤其是中、高剂量的DMDD,结果见图7。
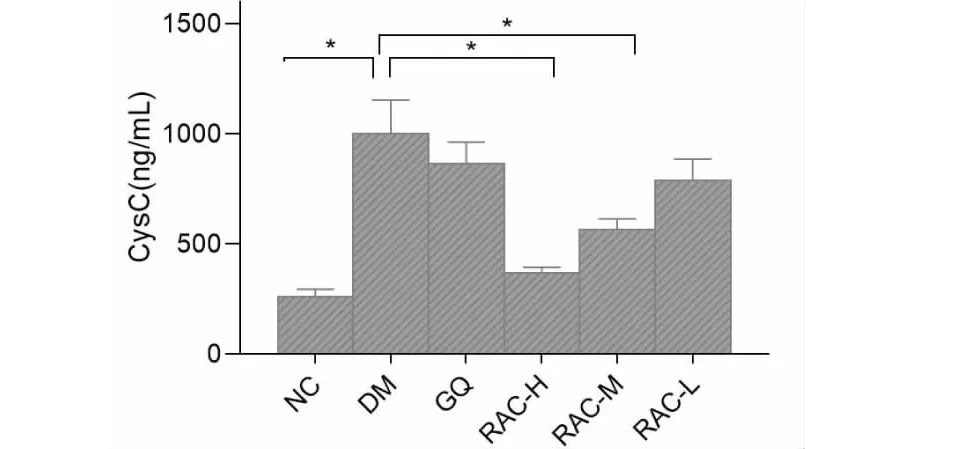
图7 杨桃根对糖尿病小鼠肾功能的影响
2.9.2 Western blot检测结果
Western blot结果如图9所示,模型组的TGFβ1蛋白表达明显上调,差异均具有统计学意义(P<0.05);当给予杨桃根提取物预后,其表达水平均下调,且有剂量依赖趋势。而TGFβ1与AGE-RAGE信号通路相关,提示AGE-RAGE信号通路在杨桃根提取物防治DKD的过程中发挥重要作用。
3 讨论
DKD患病率高,心脑血管并发症风险大,是糖尿病患者死亡的重要风险因素[9]。然而,由于DKD发生机制复杂,目前关于DKD的治疗尚未取得突破性进展[10]。关于杨桃根治疗DKD,我们课题组前期进行了大量的研究。发现杨桃根及其主要成分改善糖尿病及肾损害相关并发症可能与调节糖代谢和脂代谢紊乱、胰岛素抵抗以及氧化应激等有关[11]。
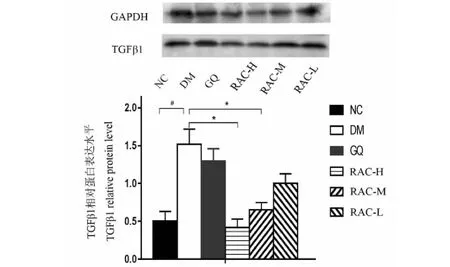
图8 小鼠肾组织TGFβ1蛋白表达水平
进一步发现,其发生机制可能与TLR4/NF-κB、TGFβ/Smad2/3等多条信号通路相关[12]。然而,具体的作用机制尚待进一步阐明。
中药具有成分复杂,药理作用广泛的特点。杨桃根发挥防治DKD作用,取决于哪些活性成分以及其对应的靶点是什么是我们关注的重点。我们课题组前期对杨桃根的有效成分进行了提取分离纯化分析,共得到24个活性化合物。在这些化合物中,我们发现化合物2(杨桃根环己二酮)在DKD的防治过程中发挥了重要的作用,是潜在的主要活性成分[13]。然而其他成分是否在DKD的防治过程中发挥重要作用,还需进一步研究。通过网络药理学筛选,我们发现,除了杨桃根环己二酮之外,苦瓜苷C、樱桃素、胡萝卜甾醇等成分亦与多个DKD关键靶点相关。提示我们,这些成分在DKD的防治过程也发挥了重要的作用,有待我们后续的进一步验证。
关键靶点筛选方面,我们筛选出了10个关键靶标,分别为:基质金属蛋白酶9(MMP9)、基质金属肽酶2(MMP2)、表皮生长因子受体(EGFR)、成纤维细胞生长因子2(FGF2)、信号转导和转录激活子3(STAT3)、丝裂原激活的蛋白激酶1(MAPK1)、血管内皮生长因子A(VEGFA)、半胱天冬酶3(CASP3)、原癌基因Hras(HRAS)和甘油醛-3-磷酸脱氢酶(GAPDH)。在这10个关键靶标中,MMP2和MMP9为基质金属蛋白酶的重要成员,作用底物主要为细胞外基质(ECM)的Ⅳ型胶原,其功能与降解和重构细胞外基质(ECM)动态平衡密切相关[14]。DKD患者早期有肾小球基底膜和肾小球系膜区ECM累积的临床表现,MMP9和MMP2及其组织抑制因子(TIMPs)在ECM降解过程中发挥非常重要的作用[15]。此外,MMP9结合CD44可释放储存的TGF-β1[16],MMP9亦可通过释放血管内皮生长因子(VEGF)以参与血管生成[17]。
KEGG富集分析显示关键靶点主要富集于蛋白聚糖与肿瘤、膀胱癌、肿瘤相关MicroRNA、EGFR酪氨酸激酶抑制剂耐药、癌症通路、糖尿病并发症中AGE-RAGE信号通路、松弛素(属于胰岛素家族)信号通路、卡波西氏肉瘤相关疱疹病毒感染、内分泌抵抗、缺氧诱导因子相关信号通路上。在这些信号通路中,AGE-RAGE信号通路、松弛素信号通路、内分泌抵抗、缺氧诱导因子等均与糖尿病的发生和发展密切相关。
晚期糖基化终末产物(AGEs)-糖基化终末产物受体(RAGEs)信号通路是糖尿病肾病发生发展的重要环节。在DKD的发生和发展过程中,AGE-RAGE主要通过激活NF-κB,引起大量黏附分子、生长因子、促炎细胞因子等的表达和释放,最终引起慢性细胞活化和组织损伤。我们前期研究也发现,杨桃根提取物DMDD可以通过抑制NF-κB的激活,从而减轻一系列的炎症损伤来达到防治糖尿病的相关并发症的作用[12]。AGE-RAGE还可刺激VEGF的表达,从而增加血管的通透性,导致蛋白尿的发生。另AGE-RAGE还可刺激TGF-β1的产生,诱导单核细胞趋化蛋白MCP-1表达的增强来引起DKD的发生和发展[18]。我们通过动物实验验证了该信号通路,TGFβ1和NF-κB在糖尿病模型组的蛋白表达均明显上调,当给予杨桃根提取物预后,它们的表达水平均下调,且有剂量依赖趋势,提示AGE-RAGE信号通路在杨桃根提取物防治DKD的过程中发挥重要作用。
综上,本研究运用网络药理学的方法,筛选出了杨桃根发挥药理作用的的主要活性成分包括杨桃根环己二酮、苦瓜苷C、樱桃素和胡萝卜甾醇等。这些活性成分主要通过MMP9、MMP2、EGFR、FGF2、STAT3、MAPK1、VEGFA和CASP3等关键靶点,参与AGE-RAGE信号通路、Relaxin信号通路、胰岛素抵抗信号通路和缺氧诱导因子信号通路发挥防治DKD的作用。通过本研究,初步阐明了杨桃根的主要药效成分及其作用靶点和相关通路在DKD防治中的作用。这些研究不仅与我们课题组的前期研究相互验证,还为更多后续的研究提供了思路和方向。
