双载体制备青蒿素速释型固体分散体工艺优化研究
2021-05-11苏婧钰陈文君申雨玫王可轩
薛 昊,苏婧钰,陈文君,申雨玫,王可轩,李 鑫,陈 靖,3*,杨 波*
1哈尔滨商业大学药学院,哈尔滨 150076;2扬州大学医学院(转化医学研究院);3江苏省中西医结合老年病防治重点实验室,扬州 225001
疟疾是一种由疟原虫引起、按蚊传播且在世界范围内广泛流行的一种致死率很高的恶性传染病,疟原虫的循环性传播及其复杂的生命周期,使疟疾一直难以彻底根除,大多数传统抗疟药如氯喹、奎宁、伯氨喹和哌喹等都先后出现耐药性而失效,而青蒿素(artemisinin,ART)类抗疟药作用迅速,目前公认毒性较低,尚未出现明显耐药性而成为一线抗疟药[1,2]。ART为黄花蒿(ArtemisiaannuaL.)叶中提取的一种倍半萜内酯类化合物[3,4],不仅是目前治疗疟疾的唯一一线抗疟药物[5,6],还具有抗病毒、免疫调节、抗炎、抗寄生虫、抗真菌及抗肿瘤等多种生物活性[7-12],但由于其水溶性和脂溶性均较差,属难溶性药物,体内吸收不完全,生物利用度较低,为有效解决这些制约青蒿素临床应用的难题,近年来很多新方法被运用到青蒿素类药物制剂中,其中固体分散体技术得到了人们的关注。
固体分散体(solid dispersion,SD)是将固体疏水原料药以分子或微晶态分散在固体亲水性惰性载体中所形成的分散系统[13],可显著增加药物溶解度与溶出度,促进药物的口服吸收,提高生物利用度[14],还可通过选用适宜的载体及辅料,使药物较为稳定的高度分散甚至进一步达到缓控释效果。Ansari等[15]以PVP K30为单载体制备了二氢青蒿素固体分散体,发现二氢青蒿素与载体以非晶体复合物存在,溶解度比原料药增加了50倍;Yang等[16]以泊洛沙姆188为最佳载体制备了吴茱萸碱固体分散体,可在不影响药物含量与形态的基础上大大提高药物的溶出;Li等[17,18]分别以PEG 6000-卵磷脂为双载体和Ⅲ号丙烯酸树脂为单载体制得ART固体分散体(ART-SD)和缓释型ART-SD。与单一载体相比,双载体或二种以上载体组成混合载体制备固体分散体在调节药物释放速度及改善药物溶出度方面可能更具优势[19],但目前为止载体类型是否对ART溶出度存在影响尚不明确,且以双载体制备速释型ART-SD工艺条件也未得到优化。本文选用固体分散体常用载体卵磷脂与PEG 6000或PVP K30为双载体,比较了不同载体类型及比例对药物溶出度的影响,优化了双载体速释型ART-SD制备工艺,并通过IR、DSC方法明确最优处方制备的固体分散体中药物-载体的存在状态,为提高难溶性药物临床疗效奠定重要基础。
1 材料与仪器
1.1 实验材料
ART(纯度>98%,批号:20190112)购于阿拉丁试剂有限公司;PVP K30、氢氧化钠购于国药集团化学试剂有限公司;PEG 6000购于北京化工厂天津市福晨化学试剂厂;大豆卵磷脂购于上海蓝季科技发展有限公司;无水乙醇购于天津市科密欧化学试剂有限公司;以上原辅料和试剂均为分析纯,药用辅料标准符合《中国药典》(2020版)相关规定。
1.2 仪器
LE204E102电子天平(梅特勒-托利多仪器有限公司);RE-52CS旋转蒸发仪(上海亚荣生化仪器厂);RCZ-6B2型智能溶出度试验仪(山东利达信仪器仪表设备有限公司);200F3差示扫描量热仪(德国Netzsch公司);Lambda750紫外分光光度计(Perkin Elmer 公司);DZF-6050真空干燥箱(郑州长城科工贸有限公司)。
2 实验方法
2.1 样品制备
2.1.1 ART-SD制备
溶剂法制备:按一定质量比精密称取ART与载体材料(大豆卵磷脂、PVP K30或PEG 6000)适量,加入到适量95%乙醇中溶解,并在20 ℃下搅拌30 min后,将其置于旋转蒸发仪减压蒸去溶剂至粘稠,于真空干燥箱50 ℃干燥24 h,最后将样品置于预先清洗的研钵中,研磨均匀后,过80目筛,密封并于4 ℃保存。
2.1.2 物理混合物(physical mixture,PM)
按一定质量比精密称取ART与载体材料适量,过80目筛,室温下置于研钵内搅拌至混合均匀即得,密封并4 ℃保存。
2.2 固体分散体中ART定量分析
2.2.1 溶液配制
2.2.1.1 ART标准品溶液配制
精密称取ART对照品5.00 mg,置于50 mL量瓶中,加入95%乙醇充分溶解并定容,即为0.1 mg/mL对照品贮备液。
分别精密吸取ART对照品贮备液1、2、4、6、8 mL于50 mL量瓶中,依次加入95%乙醇9、8、6、4、2 mL,0.2% NaOH溶液定容至50 mL,分别配成系列浓度分别为2、4、8、12、16 μg/mL的标准品溶液,50 ℃水浴加热0.5 h,迅速取出冷却,备用。
2.2.1.2 辅料空白溶液配制
精密称取大豆卵磷脂、PVP K30与PEG 6000各5.00 mg,按照“2.2.1.1”项下配制辅料空白溶液。
2.2.1.3 供试品溶液配制
精密称取ART-SD适量(0.100 0 g),置于50 mL容量瓶中,加入95%乙醇待充分溶解后定容至刻度。精密吸取该样品母液6 mL,置于50 mL容量瓶中,加入95%乙醇4 mL,0.2% NaOH溶液定容至50 mL,50 ℃水浴加热0.5 h,迅速取出冷却,配制成ART-SD供试品溶液,备用。
2.2.2 检测波长选择
以1 mL 95%乙醇与9 mL 0.2% NaOH混合液作为空白对照,扫描波长范围200~500 nm,测定载体材料及ART对照品溶液吸收曲线,确定反应产物最大吸收波长,并考察载体材料是否对主药检测存在干扰。
2.2.3 方法学考察
2.2.3.1 标准曲线制备
按照“2.2.2”项下确定的最适波长进行测定,以1 mL 95%乙醇与9 mL 0.2% NaOH混合液作为空白对照,测定不同浓度标准品溶液经反应后的吸光度值,以浓度(C)-吸光度(A)绘制标准曲线。
2.2.3.2 精密度试验
取“2.2.1.1”项下16 μg/mL的标准品溶液,在最大吸收波长处于紫外分光光度计上连续测定吸光度值6次,计算日内精密度(RSD)。
2.2.3.3 稳定性试验
取“2.2.1.1”项下16 μg/mL的标准品溶液,室温下放置,分别于0、2、4、6、8、10、12、24 h,测定吸光度值,计算RSD。
2.2.3.4 重复性试验
精密称取同一批次ART-SD适量(含ART 5.00 mg),取3份,按“2.2.1.3”项制备供试品溶液,测定吸光度值,标准曲线法测得样品中ART浓度,并计算平均百分含量和RSD。
2.2.3.5 加样回收率试验
精密称取已知含量ART-SD样品9份(0.15 g),分别加入高(12.0 μg/mL)、中(8.0 μg/mL)、低浓度(4.0 μg/mL)标准品溶液各3份适量,按“2.2.1.3”项制备供试品溶液,计算平均加样回收率(%)和RSD。
2.2.3.6 样品含量测定
取“2.2.1.3”项制备的供试品溶液,平行测定3次,标准曲线法测定样品中ART浓度,分别按理论投料量及原料药占制剂质量百分比,计算样品中ART百分含量(%)及RSD。
2.3 体外溶出度的测定
ART-SD溶出度测定:根据2020版《中国药典》第四部浆法通则。待溶出介质(超纯水900 mL)温度稳定为37 ℃,取适量ART-SD(相当于ART20 mg)粉末置于超纯水中,转速为100 rpm。分别于10、20、30、40、50 min取样5 mL,及时补充溶出介质5 mL,样品0.45 μm滤膜过滤。得续滤液适量,按上述含量测定方法测定ART浓度,计算累积溶出度并绘制溶出曲线。
2.4 处方筛选与优化
2.4.1 载体种类
按照8∶1固定比例精密称取载体混合物和ART(分别以大豆卵磷脂与PEG 6000或大豆卵磷脂与PVP K30比例为1∶7作为载体混合物),按“2.1.1”项制备,考察载体种类对ART-SD溶出的影响。
2.4.2 大豆卵磷脂∶PVP K30复合载体比例
固定ART与大豆卵磷脂比例为1∶1,大豆卵磷脂和PVP K30比例分别为1∶5、1∶7、1∶9,按“2.1.1”项制备ART-SD,并考察复合载体比例对ART溶出度影响。
2.4.3 搅拌时间
载体∶药物固定比例为8∶1,复合载体比例选取大豆卵磷脂与PVP K30比例为1∶7,选取搅拌时间分别为20、30、40 min,考察反应时间对ART溶出度影响。
2.4.4 溶剂用量
载体∶药物固定比例为8∶1,复合载体比例选取大豆卵磷脂与PVP K30比例为1∶7,分别加入到溶液体积分别20、30、40 mL的95%乙醇中,按“2.1.1”项制备,并考察溶剂用量对ART溶出度影响。
2.5 物相表征
2.5.1 差示扫描量热法(DSC)
将ART、PVP K30、大豆卵磷脂、PM及ART-SD粉末分别进行DSC分析。以一只坩埚作为空白参比,另一只坩埚中放入5.00~6.00 mg样品,测量条件:氛围气为氮气,10 ℃/min升温,温度范围20~200 ℃扫描,得到不同样品的DSC曲线。
2.5.2 红外光谱(IR)
采用溴化钾压片法将ART、PVP K30、大豆卵磷脂、PM及ART-SD粉末分别制备成样品后进行红外扫描,扫描范围4 000~400 cm-1,得到不同样品的红外光谱,进行光谱分析。
2.6 统计方法
3 结果与分析
3.1 检测波长的确定
由图1A可以看出,ART在292 nm处吸光度最强,仅在紫外区203 nm处有较弱的末端吸收,这是由于50 ℃时ART在0.2% NaOH溶液中,定量生成α,β-不饱和酮酸盐,得到一吸收峰在292 nm处的产物。而由图1B、C、D可以看出,辅料在292 nm处无吸收,对测定无干扰,故本实验选择292 nm为ART含量检测波长。
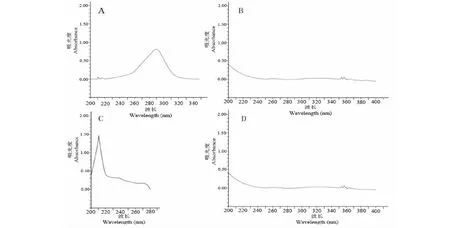
图1 紫外扫描图
3.2 方法学考察
3.2.1 标准曲线的绘制
不同浓度标准品吸光度值见表1,标准曲线如图2,回归方程为:A=0.055C+0.108 5,r2=0.999 6(n=5),结果表明ART在2.0~16.0 μg/mL范围内浓度与吸光度线性关系良好。
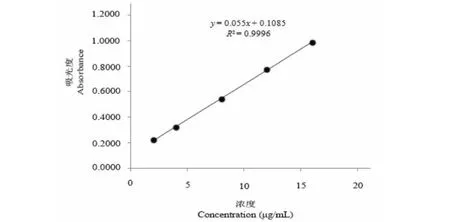
图2 ART标准曲线

表1 不同浓度标准品吸光度值
3.2.2 精密度
如表2所示精密度实验结果,RSD小于1%,表明方法精密度良好。
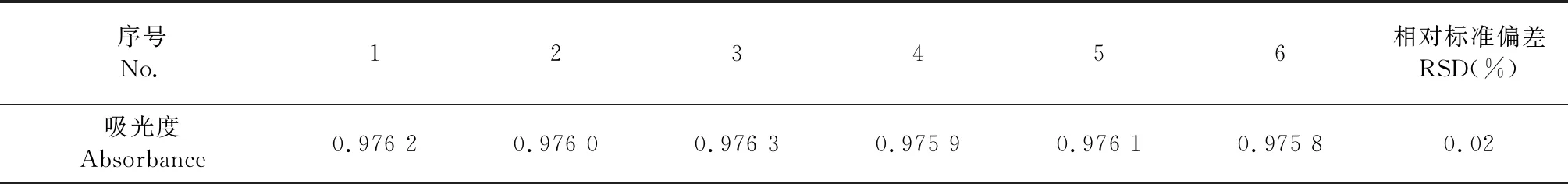
表2 精密度实验(n=6)
3.2.3 稳定性
如表3稳定性实验结果,RSD小于1%,表示测定标准品溶液在24 h内稳定性良好。
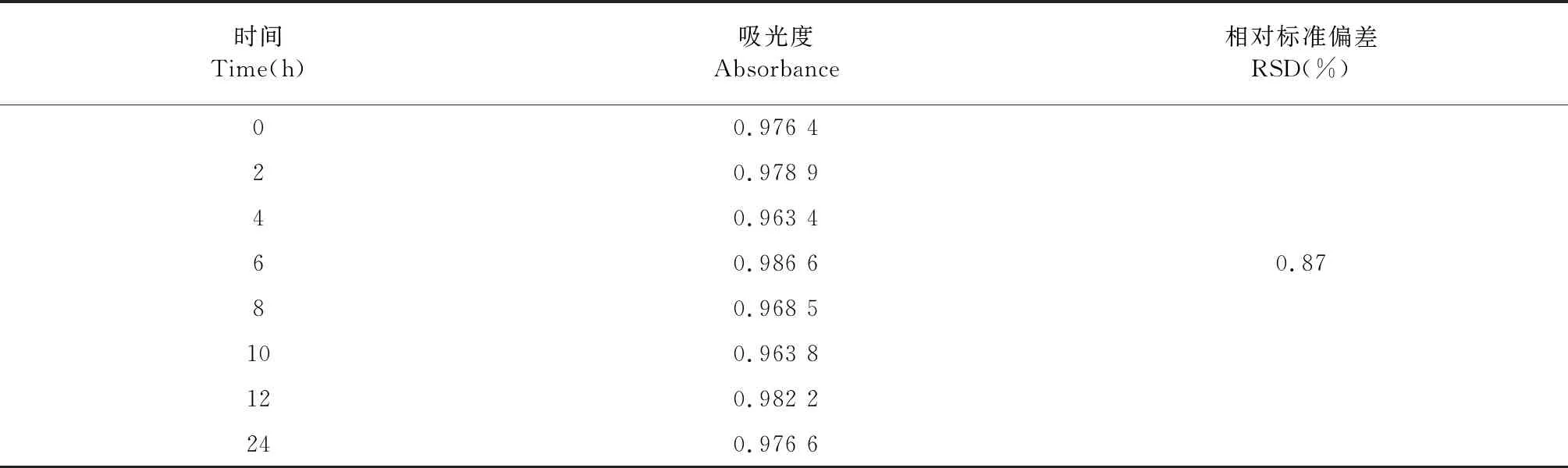
表3 稳定性测定结果(n=8)
3.2.4 重复性
如表4重复性实验结果,按理论投料量或占总制剂含量计算RSD均小于2%,表明方法重复性良好。
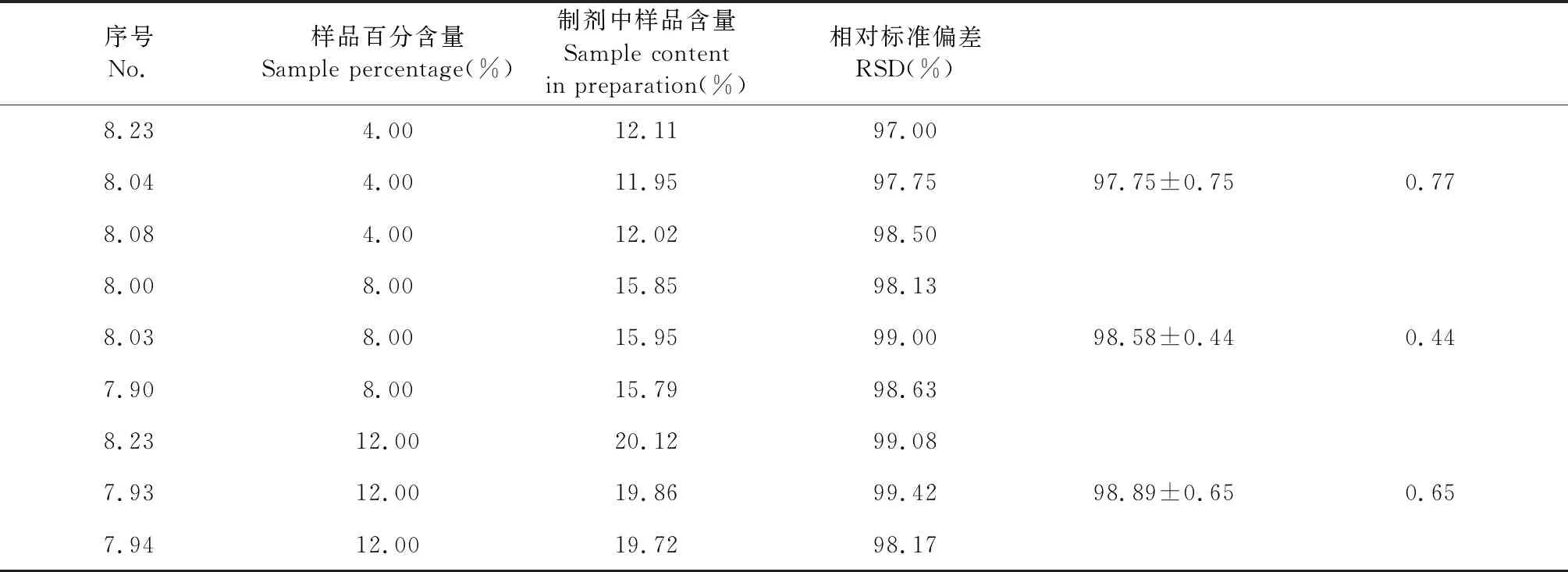
表4 重复性测定结果(n=5)
3.2.5 加样回收率
如表5所示,低、中、高浓度的溶液平均加样回收率分别为98.33%、98.11%、98.12%,RSD小于2%,符合方法学要求。
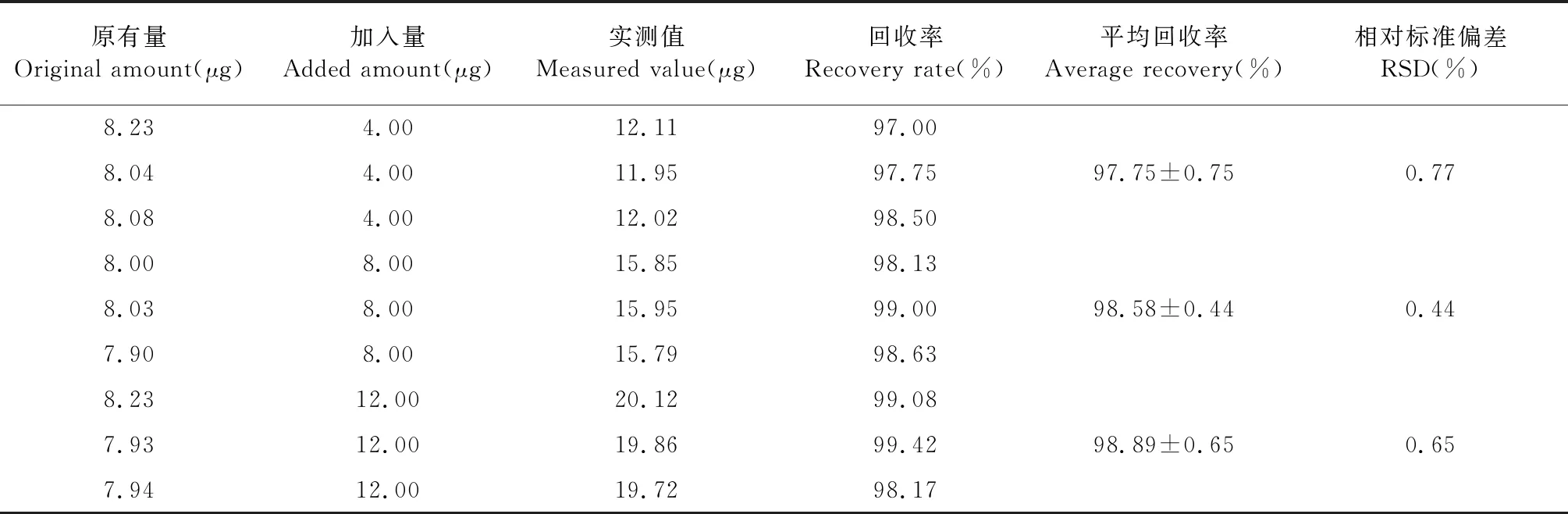
表5 加样回收率(n=3)
3.3 含量测定
由表6数据可知,按“2.2.1.3”项制备的ART-SD中ART含量均值按理论投料量计算为94.97%±0.31%,按原料药占制剂总质量百分比为10.55%±0.04%,RSD为0.28%。
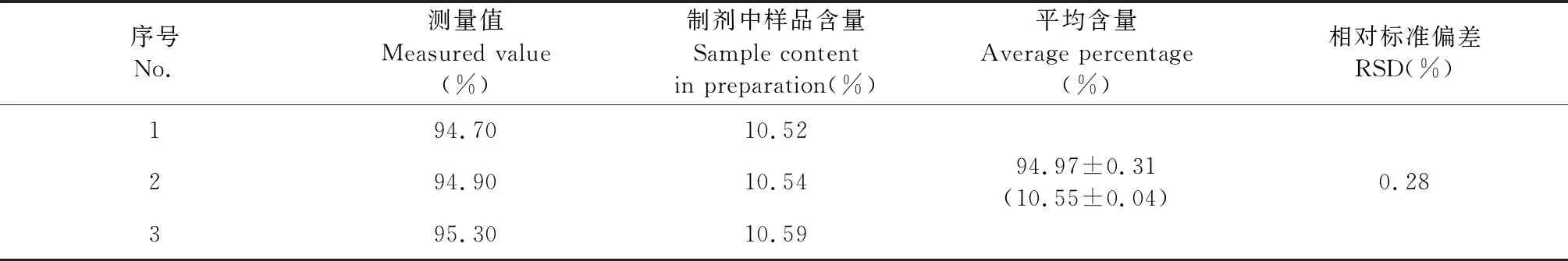
表6 ART-SD中ART含量测定结果(n=3)
3.4 处方优化结果
3.4.1 双载体种类筛选
由图3和表7可以看出,在50 min内,使用大豆卵磷脂和PVP K30作为双载体的溶出度和溶出速率均高于大豆卵磷脂和PEG 6000,故选择大豆卵磷脂和PVP K30为复合载体。
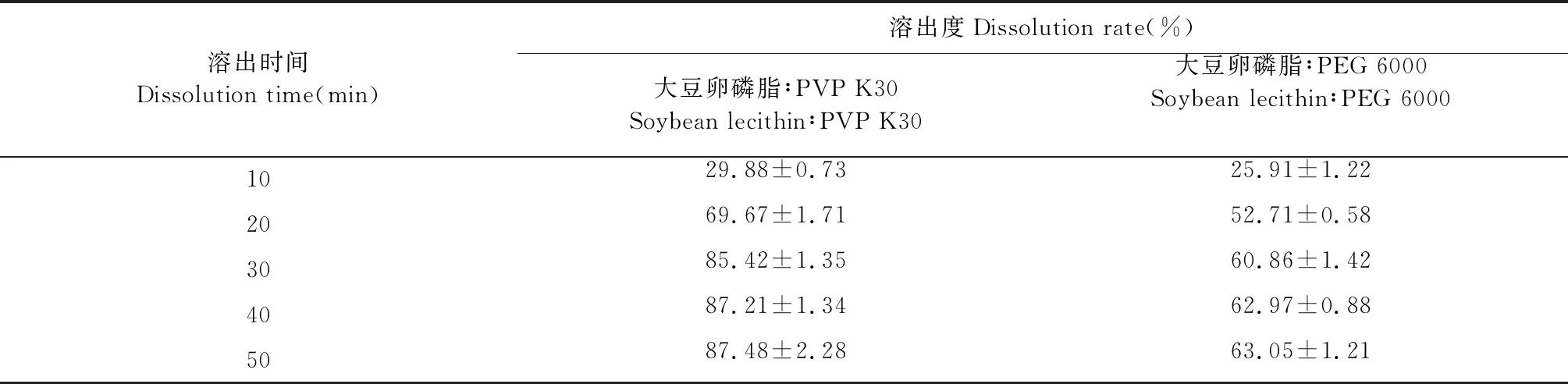
表7 不同双载体影响ART累积溶出百分率测定结果(n=3)
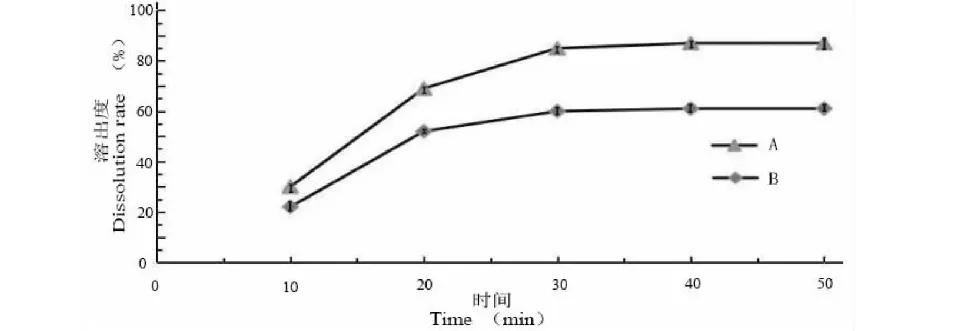
图3 不同双载体影响ART累积溶出曲线
3.4.2 复合载体比例筛选
由图4和表8可以看出,溶出速率和溶出度均有差异,且在溶出30 min后,溶出度趋于稳定。当大豆卵磷脂和PVP K30比例低于1∶7时,固体分散体的溶出度和溶出速率与载体比例成正比。当大豆卵磷脂和PVP K30比例高于1∶7时,固体分散体的溶出速率和溶出度基本不变,分析原因是青蒿素已充足分散于载体中,故增加PVP K30用量对分散度无影响。故选择混合载体大豆卵磷脂和PVP K30比例为1∶7。
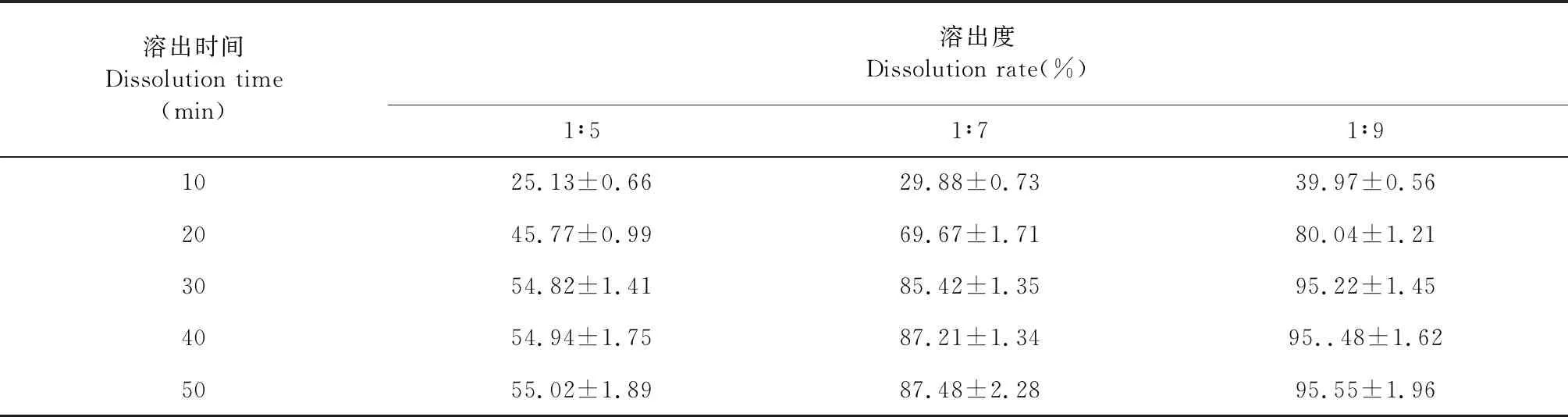
表8 不同载体比例影响ART累积溶出百分率测定结果(n=3)
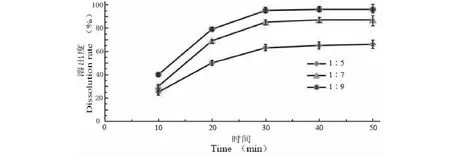
图4 不同载体比例影响ART溶出曲线
3.4.3 搅拌时间筛选
由图5和表9可以看出,搅拌时间在20~30 min之间时,随着搅拌时间的延长,溶出度也随之增加。但搅拌时间在30~40 min之间时,溶出度基本无变化。分析原因可能是当搅拌时间小于30 min时,ART部分以微晶形式存在,达到30 min后,ART多以无定型形态分散于载体中,故选择30 min为反应时间。
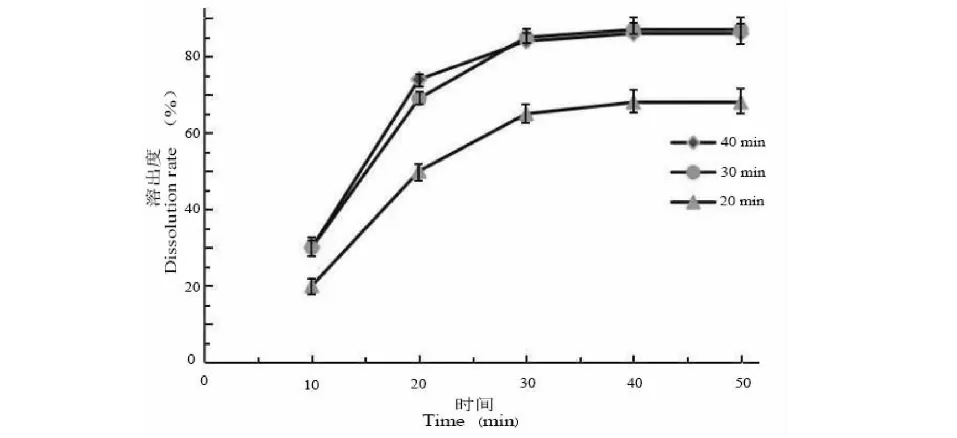
图5 不同搅拌时间影响ART溶出曲线
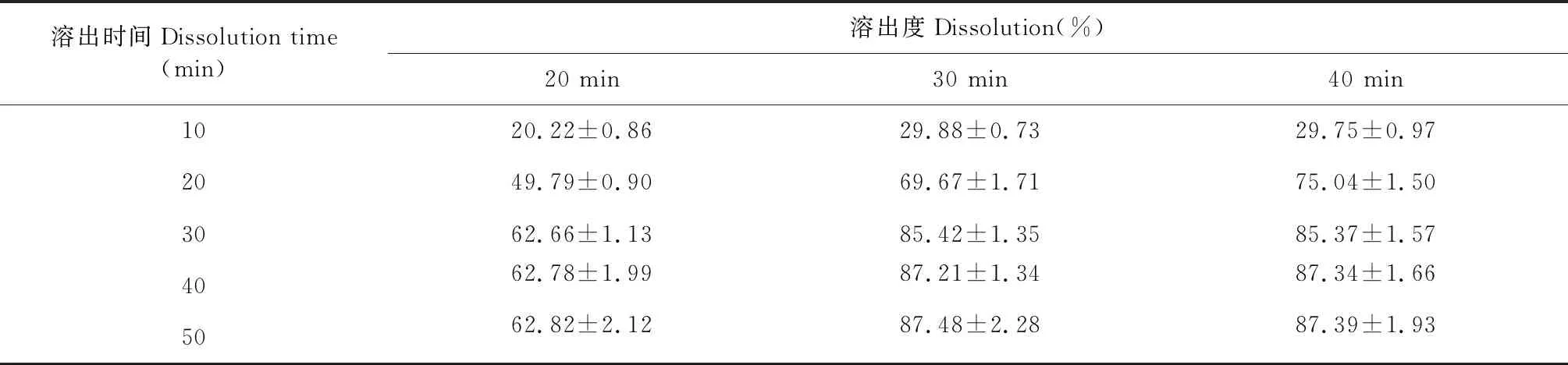
表9 不同搅拌时间影响ART累积溶出百分率测定结果(n=3)
3.4.4 溶剂用量筛选
由图6和表10可以看出,当ART和载体充分溶解在溶剂中,在一定限度内,溶剂量的增加并不会影响溶出度。考虑到成本及安全性,故选择95%乙醇量为20 mL。
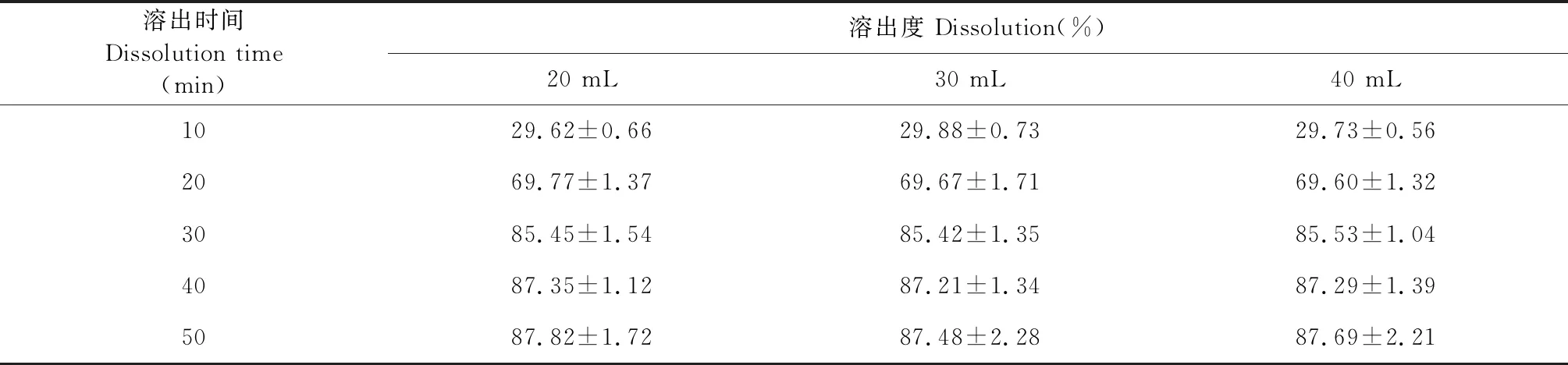
表10 不同溶剂用量影响ART累积溶出百分率测定结果(n=3)
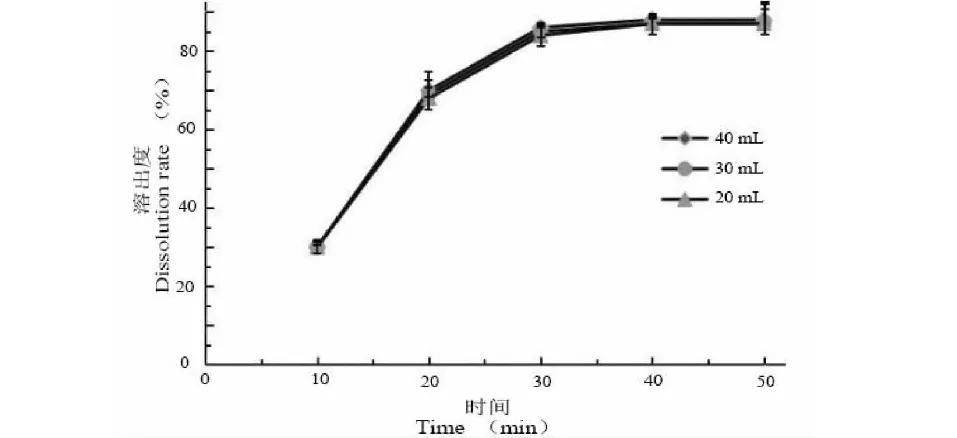
图6 不同溶剂用量影响ART溶出曲线
3.4.5 ART-SD最优处方
通过上述实验,ART-SD最优处方为:称取50 mg ART,50 mg大豆卵磷脂,350 mgPVP K30(ART∶大豆卵磷脂∶PVP K30 = 1∶1∶7),溶于20 mL 95%乙醇中,搅拌30 min后于旋转蒸发仪上蒸发至粘稠后置于真空干燥箱中,50 ℃干燥24 h,研磨均匀后,过80目筛后,密封并在4 ℃冰箱保存。
3.4.6 最优处方验证
由图7和表11可知ART-SD在30 min内快速溶出,30 min后达到溶出平衡,总溶出度超过87%,且三批样品的溶出曲线一致,说明该方法制剂重现性良好。ART原料药50 min内溶出度小于0.06%,说明双载体制备的速释型ART-SD能显著提高ART溶出度。
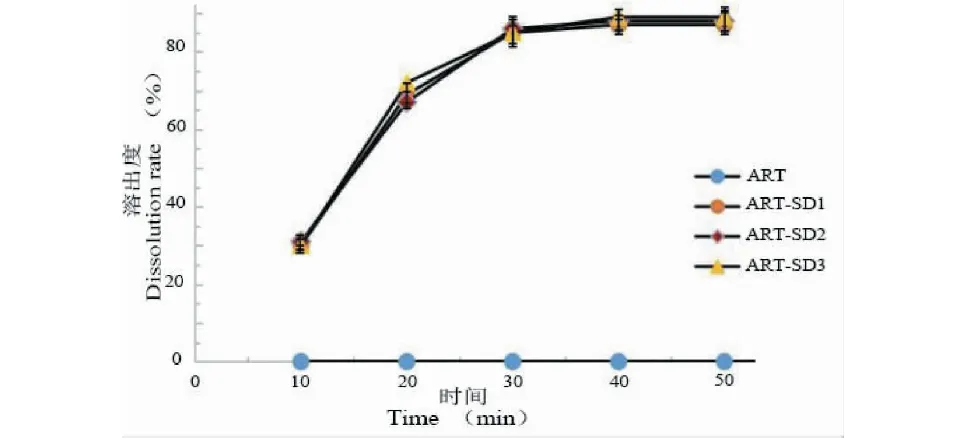
图7 不同批次制备ART-SD和ART原料药溶出度曲线差异
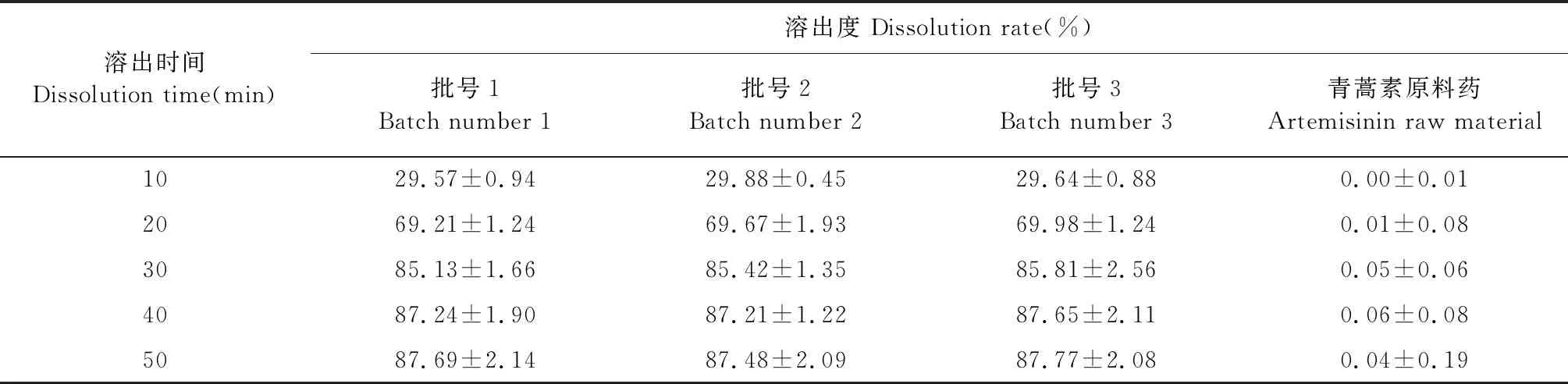
表11 不同批次制备ART-SD和ART原料药累积溶出百分率测定结果(n=3)
3.5 物相表征
3.5.1 体外溶出对比
由图8不同样品的溶出曲线可以看出,在50 min内,ART原料药在溶出介质中不溶,制备成ART-SD后,明显改善了溶出度。相比于ART原料药,物理混合物(PM)中药物的溶出度基本不变,说明载体对主药只起到轻微的助溶作用。
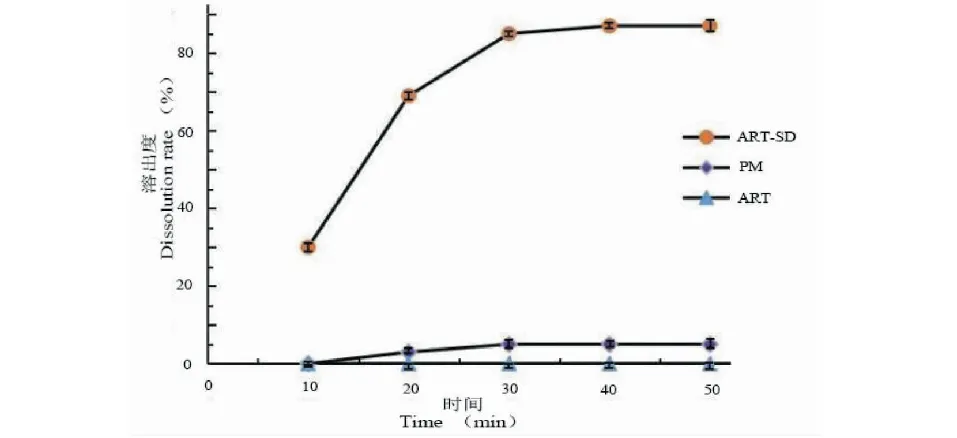
图8 青蒿素固体分散体、物理混合物及原料药累积溶出曲线差异
3.5.2 差示扫描量热法(DSC)
由图9可见,ART在152.6 ℃存在尖锐的吸热峰,PVP K30在108 ℃左右有一个峰宽不对称的吸收峰,由于它是亲水性聚合物,在该温度下脱水而产生的峰。大豆卵磷脂没有明显的吸收峰,由于它具有无熔点且无固定形态的特性。PM在150 ℃和105 ℃附近有两个吸收峰,说明ART与载体只是混合且并未改变晶型。ART-SD无明显吸收峰,说明药物晶型发生了改变,载体与ART间形成了固体分散体。
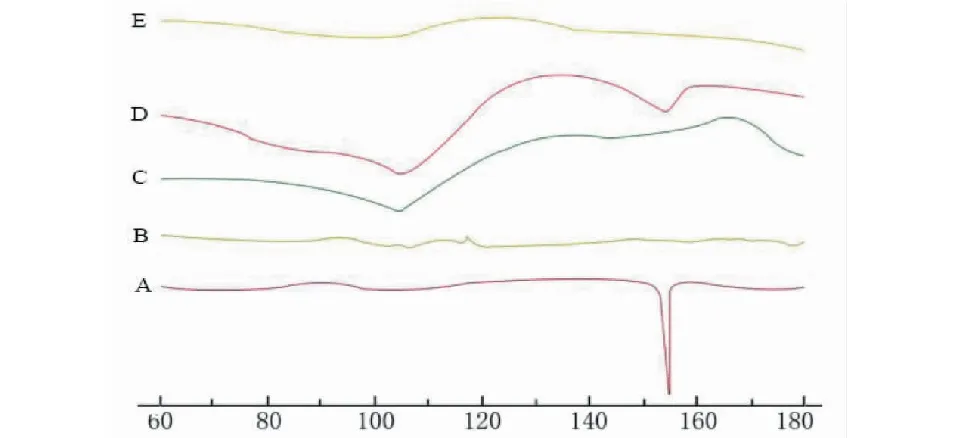
图9 差示扫描图
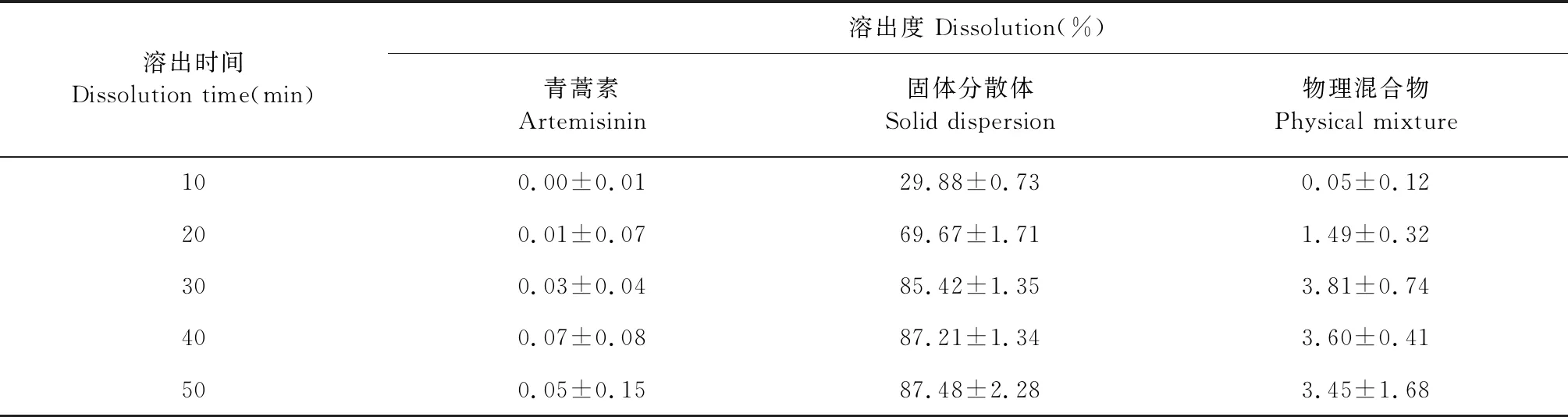
表12 青蒿素固体分散体、物理混合物及原料药累积溶出百分率测定结果(n=3)
3.5.3 红外光谱法(IR)
由图10可见,ART在1 738、1 116、724、2 870~3 000、1 450~1 380 cm-1有吸收峰,分别是C=O、C-O-C、O-O、C-H,C-H键的伸缩振动;只有1 738 cm-1的C-O伸缩振动峰较强,峰形较好,周围无其他干扰峰。PVP K30在1 655、2 950、1 289 cm-1有吸收峰,分别是C=O的伸缩振动、C-H的伸缩振动、C-N的伸缩振动,在3 446 cm-1宽且强的吸收峰是由于分子吸收了水分。大豆卵磷脂在1 738 cm-1有吸收峰(C=O的伸缩振动)。PVP分子和大豆卵磷脂中均有羰基,因而可以和ART分子中苯环上的氢形成氢键。PM的羰基峰仍与PVP分子和大豆卵磷脂一致(1 655、1 738 cm-1),说明ART与载体只是简单的混合。而ART-SD的羰基峰在1 653、1 735 cm-1,表明ART与载体间可能形成氢键,生成了固体分散体,使吸收峰发生了红移。
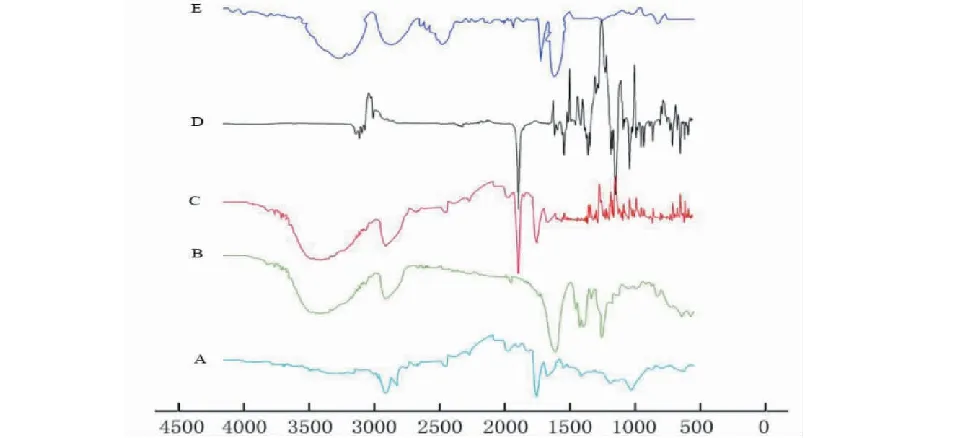
图10 红外吸收光谱图谱
4 讨论
固体分散体技术通过将药物高度分散在适宜的载体材料中,并以无定型态、微晶态、分子分散态或胶体分散态存在,与胃肠液接触后,药物溶出速度加快,促进药物吸收,提高生物利用度,以改善难溶性药物口服吸收差的难题。根据载体性质和释药特点的不同,固体分散体又分为速释型、缓控释型和肠溶型固体分散体。本文选取亲水性载体材料,利用其良好的润湿性,使ART从速释型ART-SD中快速被释放,50 min内溶出度远高于物理混合物和ART原料药,有利于解决ART口服给药吸收不完全的缺点。
其次,双载体较单一载体可更大程度地增加药物的溶出,大豆卵磷脂具有增溶性,PVP K30具有增加润湿性、降低溶出介质的表面张力、抑制药物结晶的特点[20,21],在提高难溶性药物的溶出方面广泛选用PVP K30,而PEG 6000亦被用来与卵磷脂混合作为双载体用于制备ART-SD,但不同复合载体对ART从ART-SD中溶出度影响目前并不明确,双载体制备ART-SD工艺条件也尚未进行优化。本文通过考察卵磷脂分别与PVP K30、PEG 6000组合成双载体后对ART溶出度影响,发现卵磷脂-PVP K30更优,并确定了二者的比例,在此基础上,进行了双载体溶剂法制备速释型ART-SD工艺条件优化,为ART新剂型开发奠定重要基础。
5 结论
本实验以ART溶出度为评价指标,通过单因素筛选双载体种类、复合载体比例、反应时间、溶剂用量等,确定双载体制备速释型ART-SD的最优处方为:50 mg ART,50 mg大豆卵磷脂,350 mg PVP K30(大豆卵磷脂和PVP K30比例1∶7),按最优工艺制得固体分散体中药物含量为10.55%±0.04%,在30 min时达到溶出平衡,50 min内溶出度为87.21%±2.28%,显著高于PM 3.45%±1.68%和ART原料药0.05%±0.15%。DSC和IR分析表明ART与载体之间形成氢键且以新的无定型状态存在,后续将深入研究ART-SD是否能够改善ART作为难溶性药物口服生物利用度低的不足,提高抗疟活性,为临床提供更为有效的抗疟药物。
