糙叶五加正丁醇萃取部位抗炎活性成分研究
2021-05-11唐思琪吴贤哲金伦喆刘向前李小军
唐思琪,罗 姣,黄 浩,吴贤哲,金伦喆,刘向前*,李小军*
1赣南医学院药学院 国家中药现代化工程技术研究中心客家中医药资源研究分中心,赣州 341000;2湖南中医药大学药学院,长沙 410208;3圆光大学药学院,韩国 益山 54538
糙叶五加Acanthopanaxhenryi(Oliv.) Harms为五加科五加属植物,它是一种生长在海拔1 000~3 200 m的林缘或灌木丛中的落叶灌木或乔木。作为中国的特产植物,其广泛分布于湖南、四川、安徽、浙江等地[1]。五加属植物在中国、韩国、日本等国家的传统医药中占有重要地位。它的干燥根皮和茎皮是著名的传统药物,民间常用于治疗风湿、关节炎、瘫痪、筋骨痛等;其叶通常被作为茶饮或民间医药中的一种多功能蔬菜汤料食用[2]。糙叶五加根皮(也称五加皮)收载于湖南省中药材地方标准,具有祛风利湿、活血舒筋、理气止痛等功效,主要用于治疗风湿痹痛、拘挛麻木、筋骨痞软、水肿、跌打损伤、疝气腹痛等[3]。在我们的前期研究中,从糙叶五加的果实、叶、根、根皮、茎及花中分离鉴定出单萜[4]、三萜皂苷[5]、黄酮[5,6]、咖啡酰基奎宁酸衍生物[6]、木脂素[7,8]、甾体化合物[5,7]、苯丙素类[7]、二萜[8]、脂肪酸及其他化合物[9-11]。同时,我们对这些从中药糙叶五加中得到的单体化合物相关的抗神经炎[4,7,11]、抗炎[9-12]、抗脂肪生成[13]、抗菌[14]、抗氧化和抗乙酰胆碱酯酶活性[6]也进行了相继研究和报道。然而,到目前为止,对糙叶五加果实的研究多集中于乙酸乙酯部位[4,11],而对其正丁醇萃取部位的物质基础研究鲜见报道,对于糙叶五加果实中极性较大的化学成分的研究与发现亟待进一步的关注。
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁外壁的组成成分,是由脂质和多糖构成的物质(糖脂质)。当LPS作用于RAW264.7巨噬细胞上表达的Toll样受体时,会导致各种炎症信号通路被激活。这些被激活的巨噬细胞常常会产生并释放大量的促炎介质和细胞因子,如一氧化氮(NO)、前列腺素E2(PGE2)、肿瘤坏死因子-α(TNF-α)、白细胞介素(ILs)等[12]。在前期的研究基础之上[11],为了进一步阐明中药糙叶五加果实的抗炎药效物质基础,深入挖掘其极性较大的成分的潜力,以期拓展该植物资源的药用部位,我们首次基于LPS诱导的RAW264.7巨噬细胞模型对糙叶五加果实的正丁醇萃取部位进行抗炎活性成分研究。
1 材料与方法
1.1 仪器与材料
NMR波谱(1D和2D)测试采用JEOL JNM ECP-400核磁共振仪(日本,东京);HMQC和HMBC实验参数设置分别为1JCH=140 Hz和nJCH=8 Hz;ESI-MS测试采用Q-TOF micro LC-MS/MS质谱仪(美国,Waters);高相液相色谱仪为YL9100 HPLC系统(韩国,英麟);正相和反相TLC采用Kieselgel 60 F254和RP-18 F254s(德国,默克);常规柱色谱硅胶(Kieselgel 60,70~230目和230~400目,默克);反相柱色谱材料YMC-C18(德国,默克);Dulbecco’s modified Eagle’s medium(DMEM)和胎牛血清(fetal bovine serum,FBS)购自Gibco BRL Co.(Grand Island,NY,USA);脂多糖(LPS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲基亚砜(DMSO)、Griess试剂购自美国Sigma-Aldrich公司(St.Louis,MO);阳性对照紫铆因(butein)来自于韩国圆光大学药学院生药及天然产物研究室(HPLC纯度≥98.5%)。
本实验样品于2015年10月份采自湖南省新化,经湖南中医药大学药学院刘向前教授鉴定为五加科五加属植物糙叶五加Acanthopanaxhenryi(Oliv.) Harms的果实,标本保存于湖南省重点实验室中药新药研究与开发实验室,标本号为AHF201510。
1.2 提取与分离
阴干后的糙叶五加果实(5 kg),粉碎至粗粉,用甲醇回流提取3次后合并提取液(3 × 20 L),减压回收溶剂得总浸膏。总浸膏加入适量蒸馏水分散后依次用石油醚(60~90)、乙酸乙酯、正丁醇萃取,分别回收溶剂,得石油醚萃取部分(40 g)、乙酸乙酯萃取部分(20 g)、正丁醇萃取部分(100 g)。所得正丁醇部位经RP-C18柱色谱分离,以甲醇-水(1∶9→1∶0,V/V)为梯度洗脱溶剂系统,得到12个组份Fr.B1~Fr.B12。组份Fr.B5(5.6 g)经正相硅胶柱色谱,三氯甲烷-甲醇-水(4∶1∶0.1→1∶1∶0.2,V/V/V)梯度洗脱后得亚组份Fr.B5.1~Fr.B5.8。亚组份Fr.B5.2(104 mg)用正相硅胶柱色谱纯化,以三氯甲烷-甲醇-水(3∶1∶0.1→2∶1∶0.1,V/V/V)梯度洗脱,得化合物1(20 mg)和化合物2(30 mg);亚组份Fr.B5.4(696 mg)用正相硅胶柱色谱分离纯化,以三氯甲烷-甲醇-水(洗脱梯度为4∶1∶0.1→3∶1∶0.1,V/V/V)为流动相,得化合物4(54 mg)和化合物6(15 mg);亚组份Fr.B5.5(145 mg)先用正相硅胶柱色谱分离,以三氯甲烷-甲醇-水(3∶1∶0.1,V/V/V)为流动相,再用RP-HPLC(乙腈-水=1∶4→3∶7,V/V)进行制备,得化合物5(3.5 mg,tR=24.8 min)、7(2.5 mg,tR=28.1 min)、8(2.8 mg,tR=30.1 min)、9(2.7 mg,tR=31.0 min);类似地,亚组份Fr.B5.4.2(99 mg)先用正相硅胶柱色谱分离,以三氯甲烷-甲醇(15∶1→10∶1,V/V)为流动相,再用C18-HPLC(乙腈-水-0.1%甲酸=1∶4→1∶3,V/V)进行制备纯化,得化合物12(3.2 mg,tR=15.2 min);亚组份Fr.B5.6.1(50 mg)进一步用制备型HPLC(乙腈-水-0.1%甲酸=1∶4→1∶3,V/V)进行纯化得化合物14(4.3 mg,tR=12.7 min)。组份Fr.B6(2.38 g)经Sephadex LH-20柱色谱,三氯甲烷-甲醇(1∶1,V/V)为流动相,得亚组份Fr.B6.1~B6.5;亚组份Fr.B6.2(1.24 g)经正相硅胶柱色谱,二氯甲烷-甲醇(10∶1→6∶1,V/V)梯度洗脱后得亚组份Fr.B6.2.1~B6.2.7;Fr.B6.2.4(30 mg)经正相HPLC(正己烷-乙醇=4∶1→3∶2,V/V)制备纯化后得化合物11(2.0 mg,tR=27.0 min)、15(5.0 mg,tR=27.5 min)、16(4.4 mg,tR=22.0 min)、17(1.9 mg,tR=23.7 min)。亚组份Fr.B6.3(184 mg)由硅胶柱色谱分离纯化,二氯甲烷-甲醇(15∶1,V/V)为洗脱剂,得到化合物10(8.6 mg)。组份Fr.B7(5.76 g)先经凝胶Sephadex LH-20(三氯甲烷-甲醇=1∶1,V/V)柱色谱分离,然后再经硅胶柱色谱(二氯甲烷-甲醇=10∶1→1∶1,V/V)纯化,最后用正相HPLC(正己烷-乙醇=4∶1→3∶2,V/V)制备得化合物13(2.3 mg,tR=25.0 min)。亚组份Fr.B7.2.8经甲醇反复重结晶和脱色处理后得黄色粉末3(15 mg)。
1.3 MTT法细胞毒性试验
取对数生长期RAW264.7巨噬细胞接种于96孔板中(1×105个细胞/孔),37 ℃、5% CO2条件下温孵培养12 h后,给药组分别加入不同浓度的待测样品(终浓度分别为20、40、80 μM),同时每种药物均设加入或不加入LPS(1 μg/mL)两组。溶剂对照组均不加入受试药物及LPS,但加入体积分数为0.1%的DMSO。继续温孵培养48 h后,每孔取出100 μL上清液,加入终质量浓度为100 mg/mL的MTT工作液孵育0.5 h。形成的甲臜盐使用酸化异丙醇溶解,在酶标仪(Bio-Rad,Hercules,CA,USA)540 nm处测定各孔吸光度(A)值,以正常组细胞(未处理)的A值所对应的细胞存活率为100%,计算细胞存活率。每组重复3次独立实验。
1.4 NO抑制试验
采用Griess法[28]检测对LPS刺激下的RAW264.7细胞分泌NO的抑制作用。取对数生长期RAW264.7细胞接种于96孔板中(1×105个细胞/孔),37 ℃、5% CO2条件下温孵培养12 h后加入100 μL不同浓度的待测样品(终浓度分别为20、40、80 μM),温孵培养0.5 h后加入100 μL的LPS(1 μg/mL),同时设模型组(LPS+培养液)、阳性对照组(紫铆因+LPS+培养液)、空白对照组(培养液),继续温孵培养24 h。每组重复3次独立实验。将上清液(100 mL)与等体积的格氏试剂混合,用酶联免疫检测仪测定混合物在540 nm处的A值,计算NO抑制率。
2 实验结果
2.1 结构鉴定
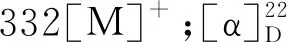
化合物1黄色粉末(甲醇);EI-MS:m/z464[M]+;1H NMR(400 MHz,CD3OD)δ:7.71(1H,d,J=2.0 Hz,H-2′),7.56(1H,dd,J=8.4,2.0 Hz,H-6′),6.85(1H,d,J=8.4 Hz,H-5′),6.32(1H,d,J=1.6 Hz,H-8),6.14(1H,d,J=2.0 Hz,H-6),5.23(1H,d,J=7.6 Hz,Glc-H-1′′),3.86~3.23(6H,m,H-2′′~6′′);13C NMR(100 MHz,CD3OD)δ:157.0(C-2),134.4(C-3),178.0(C-4),161.6(C-5),98.6(C-6),164.6(C-7),93.5(C-8),157.7(C-9),104.3(C-10),121.7(C-1′),114.7(C-2′),144.5(C-3′),148.5(C-4′),116.3(C-5′),121.9(C-6′),103.2(Glc-C-1′′),74.4(C-2′′),76.8(C-3′′),69.9(C-4′′),77.0(C-5′′),61.2(C-6′′)。以上数据与文献[15]报道一致,故鉴定化合物1为槲皮素-3-O-β-D-吡喃葡萄糖苷。
化合物2黄色粉末(甲醇);EI-MS:m/z464[M]+;1H NMR(400 MHz,CD3OD)δ:7.84(1H,d,J=2.4 Hz,H-2′),7.55(1H,dd,J=8.4,2.4 Hz,H-6′),6.84(1H,d,J=8.4 Hz,H-5′),6.32(1H,d,J=1.6 Hz,H-8),6.14(1H,d,J=2.0 Hz,H-6),5.14(1H,d,J=7.6 Hz,Gal-H-1′′),3.86~3.23(6H,m,H-2′′~6′′);13C NMR(100 MHz,CD3OD)δ:157.0(C-2),134.5(C-3),178.0(C-4),161.5(C-5),98.6(C-6),164.6(C-7),93.5(C-8),157.4(C-9),103.2(C-10),121.5(C-1′),114.8(C-2′),144.4(C-3′),148.6(C-4′),116.6(C-5′),121.7(C-6′),104.2(Gal-C-1′′),71.9(C-2′′),73.8(C-3′′),68.7(C-4′′),75.8(C-5′′),60.7(C-6′′)。以上数据与文献[16]报道一致,故鉴定化合物2为槲皮素-3-O-β-D-吡喃半乳糖苷。
化合物3黄色粉末(甲醇);1H NMR(400 MHz,CD3OD)δ:7.66(1H,d,J=2.0 Hz,H-2′),7.61(1H,dd,J=8.4,2.0 Hz,H-6′),6.85(1H,d,J=8.4 Hz,H-5′),6.38(1H,d,J=2.4 Hz,H-8),6.19(1H,d,J=2.0 Hz,H-6),5.10(1H,d,J=7.6 Hz,Glc-H-1′′),4.51(1H,d,J=1.6 Hz,Rha-H-1′′′),3.81(1H,dd,J=11.0,1.2 Hz,H-6′′a),3.63(1H,m,H-6′′b),3.55~3.24(8H,m,Glc-H-2′′~5′′,Rha-H-2′′′~5′′′),1.12(3H,d,J=6.0 Hz,H-6′′′,Rha-CH3);13C NMR(100 MHz,CD3OD)δ:157.2(C-2),134.3(C-3),178.1(C-4),161.6(C-5),98.7(C-6),164.8(C-7),93.6(C-8),158.0(C-9),104.3(C-10),121.8(C-1′),114.7(C-2′),144.5(C-3′),148.5(C-4′),116.4(C-5′),122.2(C-6′),103.4(Glc-C-1′′),74.4(C-2′′),75.9(C-3′′),70.1(C-4′′),76.9(C-5′′),67.2(C-6′′),101.1(Rha-C-1′′′),70.8(C-2′′′),70.9(C-3′′′),72.6(C-4′′′),68.4(C-5′′′),16.6(C-6′′′,Rha-CH3)。以上数据与文献[10]报道一致,故鉴定化合物3为芦丁。
化合物4黄色无定型粉末(甲醇);EI-MS:m/z516[M]+;1H NMR(400 MHz,DMSO-d6)δ:7.49(1H,d,J=15.6 Hz,H-7′′),7.40(1H,d,J=15.6 Hz,H-7′),7.05(1H,br s,H-2′′),7.01(1H,br s,H-2′),6.94(1H,d,J=8.0 Hz,H-6′′),6.90(1H,d,J=8.0 Hz,H-6′),6.74(2H,br s,H-5′′,H-5′),6.25(1H,d,J=15.6 Hz,H-8′′),6.18(1H,d,J=16.0 Hz,H-8′),5.28(1H,br s,H-3),4.01(1H,br s,H-5),3.54(1H,d,J=8.4 Hz,H-4),2.58(1H,m,H-6a),2.38(1H,m,H-2a),2.19(1H,m,H-6b),1.81(1H,m,H-2b);13C NMR(100 MHz,DMSO-d6)δ:175.8(C-7),166.9(C-9′′),165.6(C-9′),149.9(C-4′′),149.1(C-4′),146.6(C-3′′),146.5(C-3′),145.5(C-7′′),144.3(C-7′),126.1(C-1′′),125.6(C-1′),121.9(C-6′′),121.2(C-6′),116.5(C-5′′),116.5(C-5′),115.3(C-2′′),115.2(C-2′),116.5(C-8′),114.7(C-8′′),82.4(C-1),73.2(C-4),70.9(C-3),69.6(C-5),38.3(C-2),35.3(C-6)。以上数据与文献[17,18]报道一致,故鉴定化合物4为1,3-双咖啡酰奎宁酸。
化合物5黄色无定型粉末(甲醇);EI-MS:m/z516[M]+;1H NMR(400 MHz,DMSO-d6)δ:7.50(2H,d,J=15.6 Hz,H-7′,7′′),7.02(2H,m,H-2′,2′′),6.95(2H,m,H-6′,6′′),6.75(2H,m,H-5′,H-5′′),6.24(2H,d,J=15.6 Hz,H-8′,8′′),5.55(1H,br s,H-3),4.98(1H,br s,H-4),4.24(1H,br s,H-5),2.15(3H,m,H-6a,6b,2a),1.87(1H,br s,H-2b);13C NMR(100 MHz,DMSO-d6)δ:177.6(C-7),166.8(C-9′′),166.6(C-9′),149.2(C-4′′),149.2(C-4′),146.2(C-3′′),146.2(C-3′),146.1(C-7′′),146.1(C-7′),126.1(C-1′′),125.8(C-1′),122.0(C-6′′),122.0(C-6′),116.4(C-5′′),116.4(C-5′),115.4(C-2′′),115.4(C-2′),114.2(C-8′′),114.2(C-8′),76.8(C-1),76.1(C-4),68.4(C-3),69.1(C-5),40.2(C-2),38.3(C-6)。以上数据与文献[17,19]报道一致,故鉴定化合物5为1,4-双咖啡酰奎宁酸。
化合物6黄色无定型粉末(甲醇);EI-MS:m/z516[M]+;1H NMR(400 MHz,DMSO-d6)δ:7.50(1H,d,J=16.0 Hz,H-7′′),7.38(1H,d,J=16.0 Hz,H-7′),7.03(2H,br s,H-2′,2′′),6.94(2H,t,J=8.0 Hz,H-6′,6′′),6.73(2H,t,J=8.0 Hz,H-5′,H-5′′),6.23(1H,d,J=16.0 Hz,H-8′′),6.20(1H,d,J=16.4 Hz,H-8′),5.18(1H,d,J=10.8 Hz,H-5),3.68(1H,br s,H-3),3.65(1H,br s,H-4),2.25(1H,t,J=12.0 Hz,H-6a),1.98(3H,m,H-2a,2b,6b);13C NMR(100 MHz,DMSO-d6)δ:174.2(C-7),166.4(C-9′′),165.7(C-9′),148.9(C-4′′),148.6(C-4′),146.3(C-3′′),146.2(C-3′),145.3(C-7′′),144.3(C-7′),126.3(C-1′′),126.1(C-1′),121.6(C-6′′),121.0(C-6′),116.3(C-5′′),116.3(C-5′),115.5(C-2′′),115.4(C-2′),115.1(C-8′′),116.2(C-8′),83.1(C-1),71.4(C-4),69.3(C-3),70.1(C-5),40.0(C-2),34.0(C-6)。以上数据与文献[17,18]报道一致,故鉴定化合物6为1,5-双咖啡酰奎宁酸。
化合物7黄色无定型粉末(甲醇);EI-MS:m/z516[M]+;1H NMR(400 MHz,DMSO-d6)δ:7.45(1H,d,J=16.0 Hz,H-7′),7.42(1H,d,J=16.0 Hz,H-7′′),7.01(2H,br s,H-2′,2′′),6.94(2H,dd,J=8.0,1.6 Hz,H-6′,6′′),6.74(1H,d,J=8.0 Hz,H-5′),6.72(1H,d,J=8.0 Hz,H-5′′),6.21(1H,d,J=16.0 Hz,H-8′),6.16(1H,d,J=16.0 Hz,H-8′′),5.52(1H,m,H-3),4.88(1H,m,H-4),4.15(1H,br s,H-5),2.11-1.71(4H,m,H2-2,H2-6);13C NMR(100 MHz,DMSO-d6)δ:177.5(C-7),168.0(C-9′),168.0(C-9′′),150.1(C-4′),150.1(C-4′′,147.2(C-3′),147.2(C-3′′),147.3(C-7′),147.2(C-7′′),127.2(C-1′),127.2(C-1′′),123.4(C-6′),123.4(C-6′′),117.5(C-5′),117.5(C-5′′),116.3(C-2′),116.3(C-2′′),115.6(C-8′),115.6(C-8′′),77.7(C-1),77.0(C-4),70.5(C-5),70.1(C-3),40.6(C-2),39.5(C-6)。以上数据与文献[18,20]报道一致,故鉴定化合物7为3,4-双咖啡酰奎宁酸。
化合物8黄色无定型粉末(甲醇);EI-MS:m/z516[M]+;1H NMR(400 MHz,DMSO-d6)δ:7.50(1H,d,J=16.0 Hz,H-7′′),7.46(1H,d,J=16.0 Hz,H-7′),7.10(1H,d,J=1.6 Hz,H-2′′),7.08(1H,d,J=1.6 Hz,H-2′),7.02(2H,dd,J=8.0,1.6 Hz,H-6′,6′′),6.83(1H,d,J=8.0 Hz,H-5′′),6.80(1H,d,J=8.0 Hz,H-5′),6.29(1H,d,J=16.0 Hz,H-8′′),6.20(1H,d,J=16.0 Hz,H-8′),5.22(1H,m,H-3),5.15(1H,br s,H-5),3.85(1H,m,H-4),2.20~1.97(4H,m,H2-2,H2-6);13C NMR(100 MHz,DMSO-d6)δ:175.5(C-7),166.6(C-9′′),166.0(C-9′),148.4(C-4′′),148.3(C-4′),145.6(C-3′′),145.2(C-3′),145.7(C-7′′),145.7(C-7′),125.9(C-1′′),125.8(C-1′),122.0(C-6′′),121.8(C-6′),116.2(C-5′′),116.1(C-5′),114.8(C-2′′),114.5(C-2′),115.1(C-8′′),115.0(C-8′),72.8(C-1),71.2(C-3),71.2(C-5),71.0(C-4),36.1(C-2),35.0(C-6)。以上数据与文献[18,20]报道一致,故鉴定化合物8为3,5-双咖啡酰奎宁酸。
化合物9黄色无定型粉末(甲醇);EI-MS:m/z516[M]+;1H NMR(400 MHz,DMSO-d6)δ:7.50(1H,d,J=16.0 Hz,H-7′′),7.40(1H,d,J=16.0 Hz,H-7′),7.03(2H,br s,H-2′,2′′),6.94(2H,dd,J=8.0,2.0 Hz,H-6′,6′′),6.73(2H,d,J=8.0 Hz,H-5′,H-5′′),6.23(1H,d,J=16.0 Hz,H-8′′),6.20(1H,d,J=16.0 Hz,H-8′),5.40(1H,m,H-5),4.91(1H,m,H-4),4.07(1H,m,H-3),2.20-1.90(4H,m,H2-2,H2-6);13C NMR(100 MHz,DMSO-d6)δ:175.5(C-7),165.7(C-9′),165.6(C-9′′),148.3(C-4′),148.2(C-4′′),145.2(C-3′),145.0(C-3′′),145.3(C-7′),145.3(C-7′′),125.3(C-1′),125.2(C-1′′),121.3(C-6′),121.2(C-6′′),115.4(C-5′),115.4(C-5′′),114.4(C-2′),114.5(C-2′′),114.0(C-8′),114.1(C-8′′),73.2(C-1),72.4(C-4),68.0(C-3),64.0(C-5),39.7(C-6),35.4(C-2)。以上数据与文献[18,20]报道一致,故鉴定化合物9为4,5-双咖啡酰奎宁酸。
化合物10黄色粉末(甲醇);EI-MS:m/z368[M]+;1H NMR(400 MHz,CD3OD)δ:7.54(1H,d,J=16.0 Hz,H-7′),7.03(1H,d,J=2.0 Hz,H-2′),6.95(1H,dd,J=8.0,2.0 Hz,H-6′),6.78(1H,d,J=8.0 Hz,H-5′),6.23(1H,d,J=16.0 Hz,H-8′),5.29(1H,m,H-3),4.14(1H,m,H-5),3.74(1H,dd,J=7.6,3.2 Hz,H-4),3.68(3H,s,7-OCH3),2.23(3H,m,H-2a,6a,6b),2.02(1H,m,H-2b);13C NMR(100 MHz,CD3OD)δ:74.5(C-1),36.7(C-2),69.0(C-3),70.8(C-4),71.2(C-5),36.4(C-6),174.1(C-7),126.3(C-1′),113.7(C-2′),145.5(C-3′),148.4(C-4′),115.2(C-5′),121.6(C-6′),145.9(C-7′),113.8(C-8′),166.9(C-9′),51.6(C-7-OCH3)。以上数据与文献[21]报道一致,故鉴定化合物10为绿原酸甲酯。





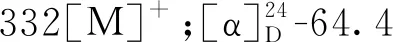
2.2 MTT法细胞毒性试验结果
MTT法细胞毒性试验结果表明,在0~80 μM的浓度范围内,被测试化合物(1~17)均无明显的细胞毒性(见图2)。
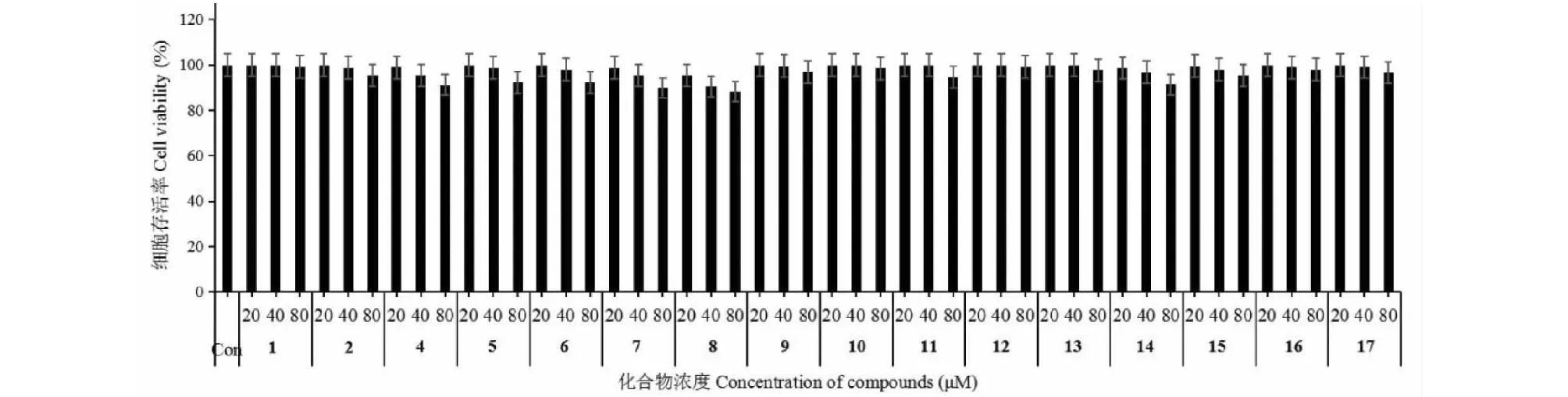
图2 用化合物1~17处理后的RAW264.7巨噬细胞的细胞存活率
2.3 NO抑制试验结果
NO抑制试验结果表明,化合物10和16具有较好的NO抑制活性且呈剂量相关,当测试浓度达到80 μM时,其NO抑制率分别为53.3%和55.6%;化合物6和17则表现出了适度的NO抑制活性且抑制率分别为40.1%和41.3%;其它被测试化合物表现出微弱或者无NO抑制效果(NO抑制率< 40%),结果见图3。另外,对于这些单体化合物的潜在抗炎活性需要进一步的研究来评估。
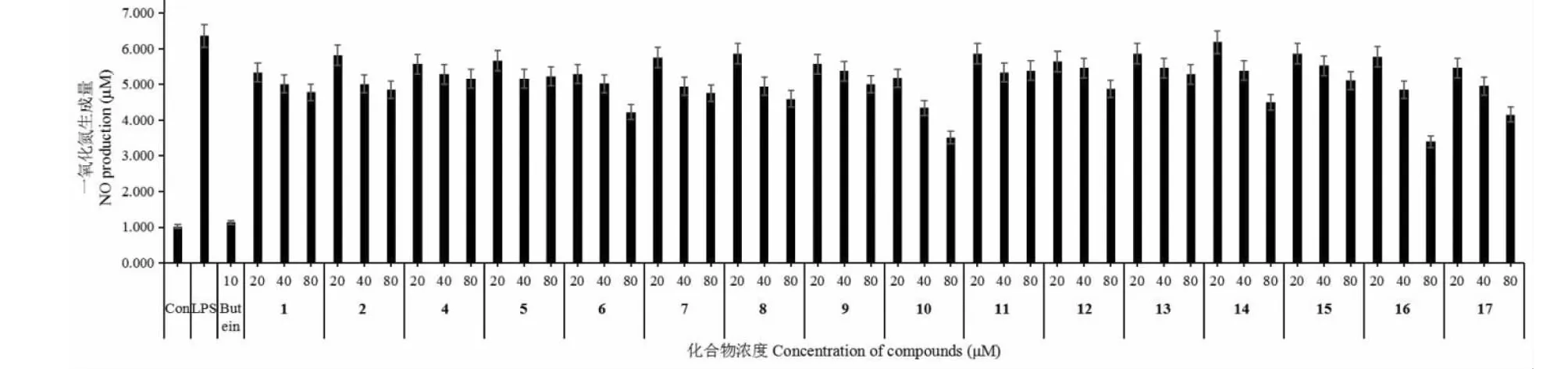
图3 化合物1~17对LPS刺激的RAW264.7巨噬细胞产生NO的影响。
3 讨论
本实验首次以脂多糖(LPS)诱导的巨噬细胞RAW264.7为生物活性筛选模型对糙叶五加果实正丁醇萃取部位进行抗炎药效物质基础研究,从中分离鉴定出17个化合物,包括3个黄酮苷类、7个咖啡酰基奎宁酸类、7个单萜苷类(见图1)。我们前期对糙叶五加的根及根皮进行了相关研究并报道了22个化合物,包括9个木脂素、4个咖啡酰基奎宁酸、3个酚酸类、2个甾体类、1个二萜、1个香豆素、1个长链脂肪酸、1个生物碱[7,8],其主要成分为木脂素、咖啡酰基奎宁酸、酚酸类及甾体类。为了进一步拓展糙叶五加资源的药用部位,探究其果实部位是否可以替代其传统的药用部位(根)入药,结合我们的前期研究基础,从糙叶五加果实乙酸乙酯萃取部位分离鉴定了18个单体化合物,包括5个木脂素、4个单萜、2个黄酮苷、1个酚酸、1个香豆素、1个苯丙素苷、1个糠醛、1个麦芽酚类、1个苯甲苷和1个三萜苷,其主要成分类型为木脂素和单萜类[11];从中我们发现糙叶五加果实的主要药效物质基础为黄酮类、咖啡酰基奎宁酸类、单萜类及木脂素类。比较果实和根的化学成分初步发现,它们的物质基础存在一定的差异,说明各部位有不同的用途,因此,在使用上应该加以区分。本文进一步丰富了中国特产植物糙叶五加的化学内涵,为以后对该植物的进一步研究提供一定的科学依据和理论参考。
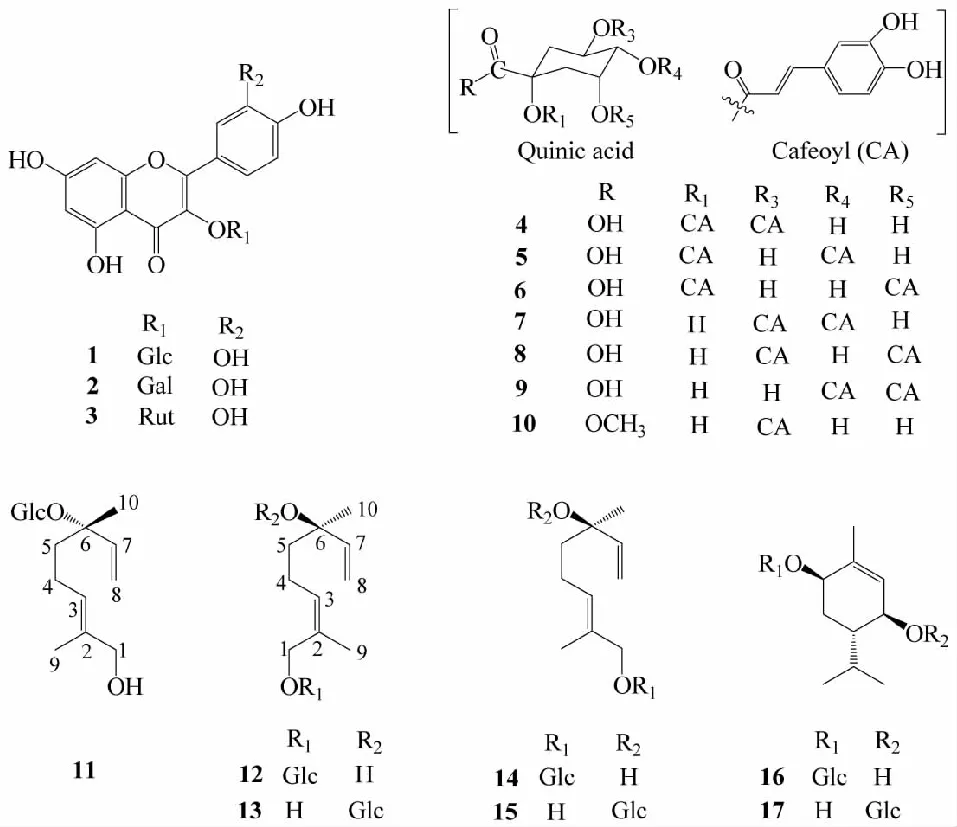
图1 化合物1~17的化学结构
