红豆树枝条化学成分及抗炎活性研究
2021-05-11张琳婧全颖萱李林海张小琴黄鸣清邱亚铁徐会有
张琳婧,全颖萱,李林海,张小琴,黄鸣清,邱亚铁,倪 林,3*,徐会有*
1福建农林大学植物保护学院,福州 350002;2福建中医药大学药学院,福州 350122;3自然生物资源保育利用福建省高校工程研究中心,福州 350002
红豆树(OrmosiahosieiHemsl.& E.H.Wilson)为豆科(Fabaceae)红豆属(Ormosia)植物,又称何氏红豆树、鄂西红豆树等[1],主要分布于福建、广东、广西、云南等地,是福建省重点推广的珍贵乡土树种[2],人工种植面积大,资源丰富,药用价值高,其根、茎、叶和种子均可入药,可用于治疗跌打损伤、风湿性关节炎和血滞经闭等[3],福建龙岩、宁德等畲族聚居区有食用红豆树枝叶汤药防治心脑血管疾病的用法。然而,围绕这些药效的相关研究却鲜有报道。化学成分研究方面,国内外学者已从红豆树及其同属植物中分离鉴定出包括生物碱类、萜类、黄酮类、木脂素类和挥发油成分等多种类型成分[4-8]。课题组一直致力于红豆树的药用价值开发与利用研究,前期已从红豆树根、种子及枝条提取物中分离鉴定多种具有抑菌、抗肿瘤等活性成分[5-8]。本文对红豆树枝条化学成分继续研究,又分离纯化、鉴定11个黄酮及其苷类化合物,并采用脂多糖(LPS)诱导的小鼠BV-2小胶质细胞模型,测定炎症细胞因子白介素-6(IL-6)分泌量,对化合物的抗炎活性进行初探,以期为该植物药用价值的进一步开发提供理论依据。
1 材料与方法
1.1 仪器与材料
W2695-QDA高效液相色谱-质谱联用仪(美国Waters公司);LC-20AP制备型高效液相色谱仪(日本Shimadzu公司);Bruker AV400核磁共振仪(德国Bruker公司);Agilent 6520型高分辨质谱仪(美国Agilent科技公司);C18分析型反相色谱柱(150 mm×4.6 mm,5 μm,北京迪马科技公司);ODS-A制备型反相色谱柱(250 mm×10 mm,5 μm,日本YMC公司);Opti-Chiral A1镜像手性分析柱(250 mm×4.6 mm,5 μm);CPA225D型电子分析天平(德国Sartorius集团);细胞培养箱、PrimoR高速台式冷冻离心机(美国Thermo Fisher公司);4 ℃离心机(德国Eppendorf公司);酶标仪(瑞士TECAN公司);电泳仪、化学发光成像仪(美国BIO-RAD公司)。
D101型大孔吸附树脂(北京聚福树脂厂);柱色谱层析硅胶(200~300目,青岛海洋化工公司);Sephadex LH-20凝胶(美国GE公司);分析纯有机试剂乙醇、甲醇、二氯甲烷等(国药化工有限公司);色谱级甲醇、乙腈、正己烷、异丙醇(默克公司);氘代甲醇、二甲亚砜(美国CIL公司);超纯水(实验室自制)。小鼠BV-2小胶质细胞(中国典型培养物保存中心);RPMI-1640培养基(美国Gibco公司);LPS、MTT(美国Sigma公司);ELISA试剂盒(武汉博士德公司)。
红豆树枝条(标本号20170415)于2017年4月采自福建省福州市晋安区北峰山区(119.34°E,26.15°N;海拔526 m)的一棵30年生红豆树,经福建农林大学林学院邹双全教授鉴定为豆科红豆属植物红豆树OrmosiahosieiHemsl.& E.H.Wilson的树枝。树枝干燥后,枝叶分离,枝条部分粉碎备用。
1.2 提取与分离
干燥红豆树枝条粉末12.5 kg,用70%乙醇回流提取(125 L×2,每次3 h),滤液减压浓缩,得到粗提物1.2 kg。用48 L水溶解,水溶物过D101大孔吸附树脂(水∶乙醇 = 100∶0、70∶30、40∶60、5∶95梯度洗脱),得到5个部位(Pt.1~5)。Pt.4(160.0 g)经过硅胶柱色谱(二氯甲烷∶乙醇 = 1∶0→0∶1梯度洗脱),得到17个组分(Pt.4.1~17)。
Pt.4.9(3.9 g)经凝胶柱色谱(甲醇),得到12个组分(Pt.4.9.1~12)。Pt.4.9.7(98.3 mg)经半制备高效液相色谱(C18,甲醇∶水 = 43∶57,3.0 mL/min,210 nm),得到化合物1(tR= 24.821 min,3.7 mg)。Pt.4.9.11(57.6 mg)经制备高效液相色谱(C18,甲醇∶水 = 44∶56,8.0 mL/min,210 nm),得到化合物2(tR=40.468 min,10.5 mg)。
Pt.4.11(7.0 g)经硅胶柱色谱(二氯甲烷∶甲醇 = 8∶1→1∶1梯度洗脱),得到7个组分(Pt.4.11.1~7),Pt.4.11.2(4.0 g)经凝胶柱色谱(甲醇),得到6个组分(Pt.4.11.2.1~6)。Pt.4.11.2.4(306.4 mg)经制备高效液相色谱(C18,乙腈∶水 = 22∶78,8.0 mL/min,254 nm),得到化合物3(tR= 29.688 min,4.2 mg)。Pt.4.11.2.6(156.7 mg)经制备高效液相色谱(C18,甲醇∶水 = 38∶62,8.0 mL/min,210 nm)纯化得到化合物9(tR= 34.278 min,25.5 mg)。
Pt.4.12(5.5 g)经凝胶柱色谱(甲醇),得到8个组分(Pt.4.12.1~8)。Pt.4.12.4(1.5 g)经制备高效液相色谱(C18,甲醇∶水 = 45∶55,8.0 mL/min,210 nm)纯化得到化合物5(tR= 56.788 min,13.1 mg)。Pt.4.12.5(33.4 mg)经重结晶得到化合物4(10.9 mg)。Pt.4.12.7(111.9 mg)经制备高效液相色谱(C18,甲醇∶水 = 45∶55,8.0 mL/min,210 nm)纯化得到化合物8(tR= 15.385 min,3.0 mg)。Pt.4.12.8(226.9 mg)经制备高效液相色谱(C18,乙腈∶水 = 20∶80,8.0 mL/min,210 nm)纯化得到化合物6(tR= 23.933 min,12.7 mg)和7(tR= 34.830 min,2.4 mg)。
Pt.4.15(4.0 g)经凝胶柱色谱(甲醇)得到7个组分(Pt.4.15.1~7);Pt.4.15.4(248.9 mg)经制备高效液相色谱(C18,乙腈∶水 = 18∶82,8.0 mL/min,290 nm)纯化得到化合物11(tR=10.774 min,22.8 mg)。Pt.4.15.5(1.9 g)经制备高效液相色谱(C18,乙腈∶水 = 20∶80,8.0 mL/min,210 nm)纯化得到化合物10(tR= 26.940 min,241.4 mg)。
1.3 抗炎活性测定
1.3.1 供试品溶液配制
取化合物3、4和9,用DMSO溶解,配制成浓度为50 mol/L的供试品溶液。
1.3.2 细胞培养
复苏小鼠BV-2小胶质细胞,在37 ℃、5% CO2培养箱内,将细胞培养于RPMI-1640完全培养基(含10% 胎牛血清和1%青霉素-链霉素),每天换液,隔天传代,备用。
1.3.3 模型建立与分组
将处于对数生长期、状态良好的BV-2细胞接种于孔板,继续培养12 h后用LPS(终浓度100 ng/mL)刺激BV-2细胞12 h。
实验分组:正常对照组、LPS模型组(100 ng/mL)和单体组(20 μmol/L)。
1.3.4 ELISA法检测细胞上清中促炎因子IL-6的水平
参考文献[9]中的方法,将BV-2细胞接种于24孔板,种板浓度为5×104个/mL,每孔500 μL,按照组别加入对应的供试品和LPS,每组3个复孔,继续培养12 h后收集细胞上清液,于4 ℃离心机离心(12 000 rpm,5 min)后取上清。按照ELISA试剂盒说明书进行操作,于450 nm处测定吸光度(A)值,根据标准曲线计算各样品中IL-6的含量。
2 结果与分析
2.1 结构鉴定
化合物1淡黄色粉末;UVλmax(MeOH-H2O):254.5、290.1 nm;HR-ESI-MS:m/z299.055 9[M-H]-(计算值299.056 1),提示相对分子质量为300;分子式为C16H12O6,不饱和度为11。IR(cm-1):3 196、2 924、1 633、1 583、1 285、1 202、1 081、830。在1H NMR(400 MHz,DMSO-d6)谱中,较低场区δH:10.69(1H,s),8.96(1H,s),8.89(1H,s)存在3个活泼氢信号,推测含有3个羟基;δH:3.79(3H,s)提示存在1个甲氧基;δH:8.02(1H,s),6.38(1H,d,J= 2.0 Hz),6.37(1H,d,J= 2.0 Hz),6.92(1H,overlapped),6.72(1H,overlapped),6.71(1H,overlapped)为6个芳香质子信号。在13C NMR(100 MHz,DMSO-d6)谱中显示了16个碳信号,结合DEPT谱,确定该化合物有1个甲氧基(δC:55.9)、6个次甲基(均为烯碳,δC:94.8、96.5、115.2、116.8、119.9;δC:150.3为连氧碳)和9个季碳(δC:124.8、123.3、107.9;δC:173.8为羰基碳;δC:162.3、161.2、159.1、145.1、144.7为连氧碳)。化合物1的13C NMR数据与已知化合物香豌豆酚(orbol)[10]相近,仅多出一个甲氧基,推测其为异黄酮且在已知化合物结构基础上羟基被甲氧基取代。化合物1的平面结构通过2D NMR得到进一步确证。HMBC谱显示H-6(6.37,d,2.0 Hz)与C-8(δC:94.8)、C-7(δC:162.3)和C-10(δC:107.9)相关;H-8(6.38,d,2.0 Hz)与C-6(δC:96.5)、C-9(δC:159.1)和C-10(δC:107.9)相关;H-2(8.02,s)与C-9(δC:159.1)、C-4(δC:173.8)和C-1′(δC:123.3)相关;H-2′(6.72,overlapped)与C-3(δC:124.8)、C-1′(δC:123.3)和C-4′(δC:145.1)相关;H-5′(6.71,m)与C-1′(δC:123.3)和C-3′(δC:144.7)相关;H-6′(6.92,overlapped)与C-3(δC:124.8)、C-2′(δC:119.9)、C-4′(δC:145.1)和C-5′(δC:115.2)相关;甲氧基质子(δH:3.79)与C-5(δC:161.2)和C-6(δC:96.5)相关,证实连接在C-5上。1H-1H COSY谱显示,H-5′(6.71,overlapped)与H-6′(6.92,overlapped)相关。综合以上信息,确定化合物1的平面结构为3′,4′,7-三羟基-5-甲氧基异黄酮(3′,4′,7-trihydroxy-5-methoxyisoflavone)。经SciFinder数据库检索确定为新化合物。1H NMR(400 MHz,DMSO-d6)及13C NMR(100 MHz,DMSO-d6)核磁数据见表1。化合物1和2的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
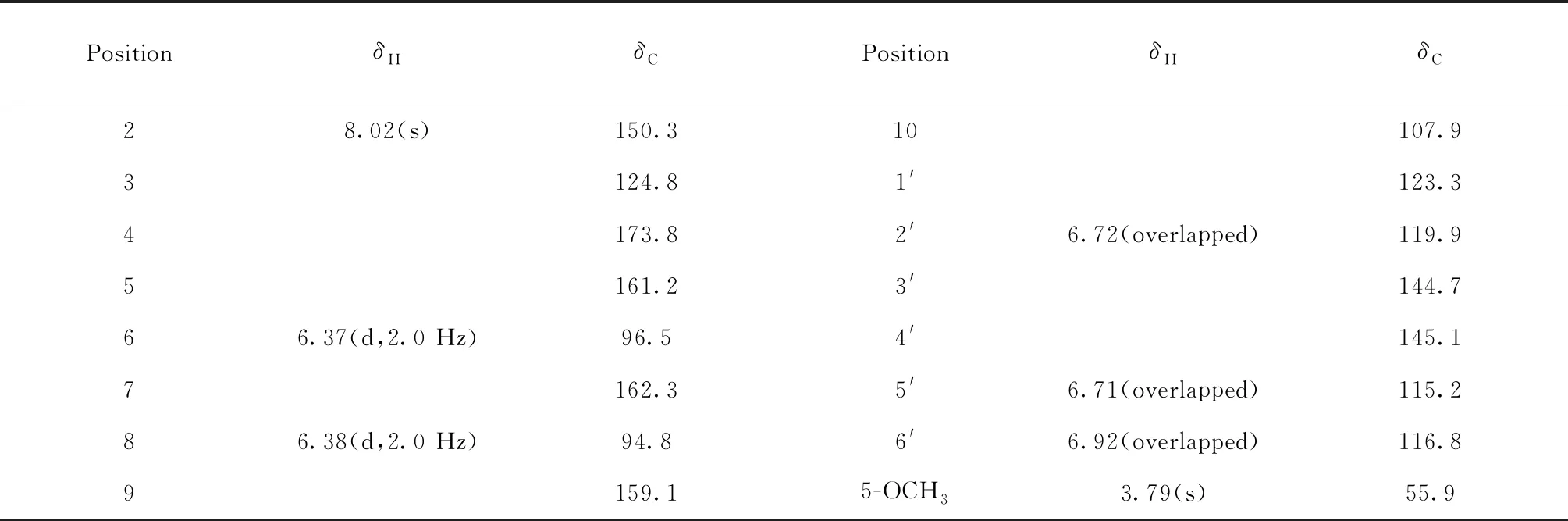
表1 化合物1的1H NMR(400 MHz)和13C NMR(100 MHz)数据
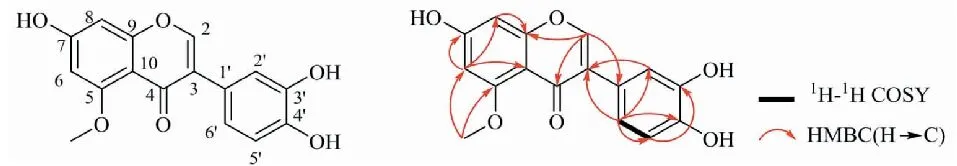
图1 化合物1的结构式、HMBC和1H-1H COSY主要相关
化合物2白色粉末;分子式为C15H12O6;UVλmax(MeOH-H2O):287.7 nm;HR-ESI-MS:m/z289.071 9[M﹢H]﹢;1H NMR(400 MHz,CD3OD)δ:4.54(1H,t,J= 10.8 Hz,H-2),4.37(1H,dd,J= 10.8,5.6 Hz,H-2),4.18(1H,dd,J= 10.8,5.6 Hz,H-3),5.89(1H,d,J= 2.0 Hz,H-6),5.87(1H,d,J= 2.0 Hz,H-8),6.32(1H,d,J= 2.4 Hz,H-2′),6.84(1H,d,J= 8.4 Hz,H-5′),6.26(1H,dd,J= 8.4,2.4 Hz,H-6′);13C NMR(100 MHz,CD3OD)δ:71.5(C-2),48.0(C-3),199.5(C-4),165.8(C-5),97.0(C-6),168.2(C-7),95.9(C-8),165.2(C-9),103.8(C-10),113.9(C-1′),103.7(C-2′),157.6(C-3′),159.2(C-4′),131.9(C-5′),107.7(C-6′)。该成分的平面结构通过2D NMR进一步确定为3′,4′,5,7-四羟基二氢异黄酮(3′,4′,5,7-tetrahydroxy dihydro isoflavone),HMBC及1H-1H COSY相关信息如图2所示,CD谱信号为0,推测为一对对映体。课题组首次提供了该成分的NMR数据,并进行了手性拆分(条件:正己烷∶异丙醇 = 80∶20,检测波长:220 nm),保留时间分别为tR2a=17.2 min、tR2b=29.3 min。由于成分的量较少,未能得到足够的对映体。
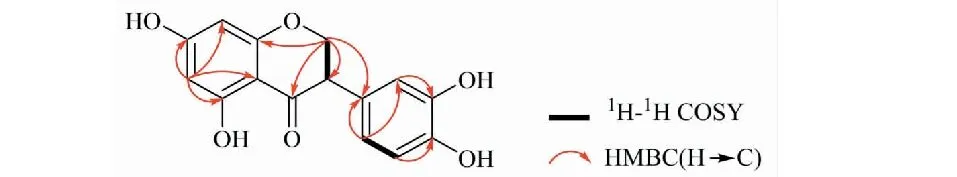
图2 化合物2的HMBC和1H-1H COSY主要相关
化合物3淡黄色粉末;分子式为C23H24O10;UVλmax(MeOH-H2O):249.7 nm;1H NMR(400 MHz,DMSO-d6)δ:8.21(1H,s,H-2),6.60(1H,d,J= 2.0 Hz,H-6),6.74(1H,d,J= 2.0 Hz,H-8),7.44(2H,d,J= 8.8 Hz,H-2′,6′),6.97(2H,d,J= 8.8 Hz,H-3′,5′),5.08(1H,d,J= 7.2 Hz,H-1′′),3.84(3H,s,5-OCH3),3.78(3H,s,4′-OCH3);13C NMR(100 MHz,DMSO-d6)δ:151.2(C-2),124.6(C-3),173.8(C-4),160.8(C-5),97.2(C-6),161.5(C-7),95.7(C-8),158.9(C-9),109.6(C-10),124.3(C-1′),130.3(C-2′,6′),113.5(C-3′,5′),158.9(C-4′),99.9(Glc-1′′),73.2(Glc-2′′),76.6(Glc-3′′),69.8(Glc-4′′),77.4(Glc-5′′),60.7(Glc-6′′),56.2(5-OCH3),55.2(4′-OCH3)。上述核磁数据与文献[11]报道基本一致,化合物3鉴定为染料木苷-5,4′-二甲醚,英文名为genistin-5,4′-methyl ether。
化合物4白色粉末;分子式为C27H30O14;UVλmax(MeOH-H2O):271.1 nm;ESI-MS:m/z579[M﹢H]﹢;1H NMR(400 MHz,DMSO-d6)δ:8.43(1H,s,H-2),6.47(1H,d,J= 2.4 Hz,H-6),6.74(1H,d,J= 2.4 Hz,H-8),7.52(2H,d,J= 8.8 Hz,H-2′,6′),7.02(2H,d,J= 8.8 Hz,H-3′,5′),5.05(1H,d,J= 7.2 Hz,H-1′′),12.90(1H,s,5-OH),3.79(3H,s,4′-OCH3);13C NMR(100 MHz,DMSO-d6)δ:155.0(C-2),122.8(C-3),180.5(C-4),161.6(C-5),99.7(C-6),163.0(C-7),94.6(C-8),157.3(C-9),106.2(C-10),122.2(C-1′),130.3(C-2′,6′),113.8(C-3′,5′),159.2(C-4′),99.8(Glc-1′′),73.0(Glc-2′′),76.4(Glc-3′′),69.9(Glc-4′′),75.6(Glc-5′′),67.8(Glc-6′′),109.4(Api-1′′′),76.0(Api-2′′′),78.7(Api-3′′′),73.3(Api-4′′′),63.2(Api-5′′′),55.2(4′-OCH3)。上述核磁数据与文献[12]报道基本一致,化合物4鉴定为澳白檀苷,英文名为lanceolarin。
化合物5白色粉末;分子式为C28H32O14;UVλmax(MeOH-H2O):260.4、325.8 nm;ESI-MS:m/z591[M-H]-;1H NMR(400 MHz,DMSO-d6)δ:8.45(1H,s,H-2),6.45(1H,d,J= 2.4 Hz,H-6),6.74(1H,d,J= 2.4 Hz,H-8),7.52(2H,d,J= 8.8 Hz,H-2′,6′),7.02(2H,d,J= 8.8 Hz,H-3′,5′),5.03(1H,d,J= 7.2 Hz,H-1′′),4.52(1H,br s,H-1′′′),1.10(3H,d,J= 6.4 Hz,H-6′′′),12.86(1H,s,5-OH),3.79(3H,s,4′-OCH3);13C NMR(100 MHz,DMSO-d6)δ:155.2(C-2),122.8(C-3),180.5(C-4),161.5(C-5),99.8(C-6),162.9(C-7),94.7(C-8),157.3(C-9),106.2(C-10),122.3(C-1′),130.3(C-2′,6′),113.8(C-3′,5′),159.3(C-4′),100.7(Glc-1′′),73.1(Glc-2′′),76.5(Glc-3′′),70.0(Glc-4′′),75.7(Glc-5′′),66.5(Glc-6′′),99.9(Rha-1′′′),70.3(Rha-2′′′),70.7(Rha-3′′′),72.2(Rha-4′′′),68.4(Rha-5′′′),17.9(Rha-6′′′),55.2(4′-OCH3)。上述核磁数据与文献[13]报道基本一致,化合物5鉴定为鹰嘴豆芽素A-7-O-芸香糖苷,英文名为biochanin A-7-O-rutinoside。
化合物6无色针状结晶;分子式为C21H20O10;UVλmax(MeOH-H2O):259.2、325.8 nm; ESI-MS:m/z433[M﹢H]﹢;1H NMR(400 MHz,DMSO-d6)δ:8.44(1H,s,H-2),6.47(1H,d,J= 2.0 Hz,H-6),6.72(1H,d,J= 2.0 Hz,H-8),7.40(2H,d,J= 8.4 Hz,H-2′,6′),6.82(2H,d,J= 8.4 Hz,H-3′,5′),5.07(1H,d,J= 7.2 Hz,H-1′′),12.95(1H,s,5-OH),9.64(1H,s,4′-OH);13C NMR(100 MHz,DMSO-d6)δ:154.7(C-2),122.6(C-3),180.6(C-4),161.7(C-5),99.6(C-6),163.0(C-7),94.6(C-8),157.3(C-9),106.1(C-10),121.0(C-1′),130.3(C-2′,6′),115.1(C-3′,5′),157.5(C-4′),99.8(Glc-1′′),73.2(Glc-2′′),76.5(Glc-3′′),69.6(Glc-4′′),77.2(Glc-5′′),60.6(Glc-6′′)。上述核磁数据与文献[14]报道基本一致,化合物6鉴定为染料木苷,英文名为genistin。
化合物7淡黄色粉末;分子式为C21H20O10;UVλmax(MeOH-H2O):245.4、266.4、299.6 nm;ESI-MS:m/z433[M﹢H]﹢;1H NMR(400 MHz,DMSO-d6)δ:6.91(1H,s,H-3),6.20(1H,d,J= 2.0 Hz,H-6),6.52(1H,d,J= 2.0 Hz,H-8),8.04(2H,d,J= 8.8 Hz,H-2′,6′),7.18(2H,d,J= 8.8 Hz,3′,H-5′),5.03(1H,d,J= 7.2 Hz,H-1′′),12.91(1H,s,5-OH);13C NMR(100 MHz,DMSO-d6)δ:163.1(C-2),103.9(C-3),181.9(C-4),161.5(C-5),99.0(C-6),164.3(C-7),94.1(C-8),157.4(C-9),103.8(C-10),123.9(C-1′),128.2(C-2′,6′),116.6(C-3′,5′),160.3(C-4′),99.8(Glc-1′′),73.2(Glc-2′′),76.5(Glc-3′′),69.6(Glc-4′′),77.2(Glc-5′′),60.6(Glc-6′′)。上述核磁数据与文献[15]报道基本一致,化合物7鉴定为芹菜素-4′-O-β-D-吡喃葡萄糖苷,英文名为apigenin-4′-O-β-D-glucoside。
化合物8淡黄色粉末;分子式为C21H20O10;UVλmax(MeOH-H2O):214.3、268.7、337.8 nm;ESI-MS:m/z431[M﹢H]﹢;1H NMR(400 MHz,DMSO-d6)δ:6.79(1H,s,H-3),6.27(1H,s,H-6),8.03(2H,d,J= 9.2 Hz,H-2′,6′),6.89(2H,d,J= 9.2 Hz,H-3′,5′),4.68(1H,d,J= 10.0 Hz,H-1′′),13.17(1H,s,5-OH),10.85(1H,s,7-OH),10.36(1H,s,4′-OH);13C NMR(100 MHz,DMSO-d6)δ:163.9(C-2),102.5(C-3),182.1(C-4),161.1(C-5),98.1(C-6),162.5(C-7),104.6(C-8),156.0(C-9),104.0(C-10),121.6(C-1′),129.0(C-2′,6′),115.8(C-3′,5′),160.4(C-4′),73.4(Glc-1′′),70.8(Glc-2′′),78.7(Glc-3′′),70.5(Glc-4′′),81.9(Glc-5′′),61.3(Glc-6′′)。上述核磁数据与文献[16]报道基本一致,化合物8鉴定为牡荆素,英文名为vitexin。
化合物9白色粉末;分子式为C21H22O10;UVλmax(MeOH-H2O):213.2、282.9、329.4 nm;ESI-MS:m/z433[M-H]-;1H NMR(400 MHz,DMSO-d6)δ:5.50(1H,dt,J= 2.8,12.8 Hz,H-2),2.73(1H,dt,J= 2.8,17.2 Hz,H-3),6.14(1H,d,J= 2.4 Hz,H-6),6.15(1H,d,J= 2.4 Hz,H-8),7.33(2H,d,J= 8.8 Hz,H-2′,6′),6.80(2H,d,J= 8.8 Hz,H-3′,5′),4.99(1H,d,J= 7.6 Hz,H-1′′),12.06(1H,s,5-OH),9.65(1H,s,4′-OH);13C NMR(100 MHz,DMSO-d6)δ:78.8(C-2),42.1(C-3),197.3(C-4),163.0(C-5),96.5(C-6),165.3(C-7),95.5(C-8),162.8(C-9),103.3(C-10),128.7(C-1′),128.5(C-2′,6′),115.2(C-3′,5′),157.9(C-4′),99.6(Glc-1′′),77.1(Glc-2′′),73.0(Glc-3′′),69.5(Glc-4′′),76.3(Glc-5′′),60.6(Glc-6′′)。上述核磁数据与文献[17]报道基本一致,化合物9鉴定为江户樱花苷,英文名为prunin。
化合物10淡黄色结晶;分子式为C27H32O14;UVλmax(MeOH-H2O):213.2、282.9、328.2 nm;ESI-MS:m/z579[M-H]-;1H NMR(400 MHz,DMSO-d6)δ:5.50(1H,td,J= 2.8,13.2 Hz,H-2),6.09(1H,dd,J= 2.0,2.8 Hz,H-6),6.11(1H,d,J= 2.0 Hz,H-8),7.33(2H,dd,J= 3.2,8.4 Hz,H-2′,6′),6.80(2H,dd,J= 1.6,8.4 Hz,H-3′,5′),5.15(1H,m,H-1′′),5.10(1H,dd,J= 1.6,5.2 Hz,H-1′′′),2.73(1H,ddd,J= 2.8,9.6,17.2 Hz,H-3),1.15(3H,dd,J= 1.2,6.4 Hz,H-6′′′),12.06(1H,d,J= 2.4 Hz,5-OH),9.62(1H,d,J= 1.6 Hz,4′-OH);13C NMR(100 MHz,DMSO-d6)δ:78.6(C-2),42.1(C-3),197.4(C-4),162.9(C-5),96.3(C-6),164.9(C-7),95.2(C-8),162.8(C-9),103.3(C-10),128.7(C-1′),128.6(C-2′,6′),115.2(C-3′,5′),157.9(C-4′),100.5(Glc-1′′),77.1(Glc-2′′),76.2(Glc-3′′),69.6(Glc-4′′),76.9(Glc-5′′),60.4(Glc-6′′),97.4(Rha-1′′′),70.5(Rha-2′′′),70.4(Rha-3′′′),71.8(Rha-4′′′),68.3(Rha-5′′′),18.1(Rha-6′′′)。上述核磁数据与文献[18]报道基本一致,化合物10鉴定为柚皮苷,英文名为naringin。
化合物11淡黄色结晶;分子式为C27H32O15;UVλmax(MeOH-H2O):284.1 nm; ESI-MS:m/z595[M-H]-;1H NMR(400 MHz,DMSO-d6)δ:5.45(1H,ddd,J= 3.2,12.0,17.6 Hz,H-2),3.19(1H,m,H-3),2.73(1H,dd,J= 3.2,18.0 Hz,H-3),6.08(1H,d,J= 2.4 Hz,H-6),6.10(1H,d,J= 2.4 Hz,H-8),6.75(2H,br d,J= 2.8 Hz,H-2′,H-5′),6.89(1H,d,J= 6.0 Hz,H-6′),5.15(1H,d,J= 7.2 Hz,H-1′′),5.11(1H,br s,H-1′′′),1.16(3H,d,J= 2.0,6.4 Hz,H-6′′′),12.07(1H,s,5-OH),9.12(2H,br s,3′-OH,4′-OH);13C NMR(100 MHz,DMSO-d6)δ:79.0(C-2),42.2(C-3),197.4(C-4),164.8(C-5),96.3(C-6),164.9(C-7),95.2(C-8),163.0(C-9),103.4(C-10),129.2(C-1′),115.4(C-2′),145.3(C-3′),146.0(C-4′),114.6(C-5′),118.3(C-6′),100.5(Glc-1′′),77.2(Glc-2′′),76.2(Glc-3′′),69.6(Glc-4′′),76.9(Glc-5′′),60.5(Glc-6′′),97.4(Rha-1′′′),70.5(Rha-2′′′),70.4(Rha-3′′′),71.9(Rha-4′′′),68.3(Rha-5′′′),18.1(Rha-6′′′)。上述核磁数据与文献[19]报道基本一致,化合物11鉴定为新北美圣草苷,英文名为neoeriocitrin。
2.2 化合物的抗炎活性评价
采用LPS诱导的BV-2小胶质细胞模型中分泌IL-6的影响,对化合物3、4和9的抗炎活性进行评价。实验结果显示,在浓度为20 μmol/L时,上述单体化合物对BV-2小胶质细胞分泌IL-6的抑制率分别为37.67%±3.27%、36.02%±5.48%和50.10%±1.58%。
3 结论
本文从红豆树枝条中分离鉴定了11个黄酮及其苷类化合物,分别属于异黄酮类(1~6)、黄酮类(7,8)和二氢黄酮类(9~11),化合物1为新化合物,并首次提供了化合物2的氢谱与碳谱数据。
天然黄酮类化合物具有广泛的抗氧化、抗炎、抗肿瘤、心血管系统保护、抑菌以及神经保护等药理活性,已报道化合物4、9和10具有较好的抗氧化活性[20,21],化合物6具有抗炎及抗肿瘤活性[22],化合物8具有抗炎、降尿酸及抗氧化活性[23]。本文首次报道红豆树枝条化合物3、4和9抑制炎症因子IL-6的活性,结果显示潜在的抗炎活性,验证了红豆树的民间抗炎效果,为进一步开发红豆树的抗炎药效成分奠定基础。
