静电纺胶原/聚环氧乙烷纳米纤维膜的制备及其性能
2021-04-30赵新哲王绍霞
赵新哲, 王绍霞, 高 晶, 王 璐
(东华大学 纺织学院, 上海 201620)
皮肤作为人体面积最大的器官,承担了抵御外界伤害,调整人体内温度和体液以及免疫防御的功能[1]。当皮肤损伤时,正常情况下机体会启动修复机制以恢复皮肤结构和功能的完整性。创面修复过程大概可分为:止血阶段、炎症反应阶段、细胞增殖阶段和成熟阶段,但一部分烧伤伤口、深度的急性伤口以及溃疡、压疮等会使伤口愈合过程失去有序调控能力,导致创面愈合缓慢或者难以愈合,给患者带来各种伤害和不便[2-3]。开发针对此类愈合周期较长的伤口护理敷料具有很重要的现实意义。
胶原作为皮肤表层细胞中重要的蛋白质,其在细胞外基质中以纤维形式存在,尺寸在50~500 nm之间[1,4],因此,胶原纳米纤维可从组成和结构上模拟细胞外基质,从而促进细胞的黏附增殖,在外用敷料中有很大的应用前景[1,5]。此外,纳米纤维具有很高的比表面积和多孔结构,这赋予了敷料很多优异的性能,如对伤口轮廓更好的贴合性,良好的透气性和透湿性,可为伤口提供合适的湿润环境以及充足的氧气等[6-7]。由于胶原的三螺旋分子结构,其分子链的刚度较大,因此,可和其他聚合物如聚环氧乙烷(PEO)混纺,从而大大改善胶原的纺丝性能。此外,静电纺胶原纳米纤维由于缺乏体内合成中的交联过程,其耐水性极差、力学强度低、降解速度快[8],因此,需要对静电纺胶原纳米纤维进行交联处理,以提高其作为伤口敷料时在液态环境下的结构稳定性。
胶原常用的交联方式有物理交联和化学交联。物理交联包括紫外光交联、干热交联以及伽马射线交联等,整个交联过程中无化学物质引入,不会造成细胞毒性,但其交联效率过低,交联也不均匀[9]。化学交联是利用化学试剂对胶原进行交联,常用的化学试剂包括戊二醛(GA)、1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐/N-烃基琥珀酰亚胺(EDC/NHS)、京尼平等[9-11]。在这些交联剂中,GA是最常用最有效的交联剂,其反应活性高,产物稳定,但若不进行适当控制,易产生潜在的毒性。Akhshabi等[12]将胶原和硫酸软骨素进行混合静电纺丝,然后用GA蒸汽交联,结果表明GA交联会抑制细胞增殖,降低细胞活性。作为零长度交联剂,EDC/NHS在交联过程中只起到桥接作用,反应结束后,可顺利从反应体系中撤出,因此,具有良好的生物相容性[13]。但利用EDC/NHS水溶液交联时,由于胶原纳米纤维的高比表面积及优异的亲水性能,会迅速从周围环境中吸收大量水分,快速溶胀直至结构破坏,因此,需要对反应体系的溶剂进行改善,减少溶剂本身对纳米纤维结构的破坏。
本文通过静电纺丝技术制备了胶原基纳米纤维膜,采用EDC/NHS对纳米纤维膜进行交联改性并测试其交联度,同时对交联后纳米纤维膜的溶胀性能、干湿态下的拉伸性能、溶血以及凝血性能进行表征,探究了不同EDC/NHS浓度对纳米纤维膜结构和性能的影响,并与GA蒸汽交联纳米纤维膜的性能进行对比,确定合适的交联方案,为其在伤口敷料中的应用提供一定的理论参考。
1 实验部分
1.1 实验材料
胶原(Col,牛肌腱I型胶原,分子质量为300 ku),上海其胜生物制剂有限公司;聚氧化乙烯(PEO,分子质量为100 ku),美国陶氏化学公司;1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS),分析纯,阿拉丁试剂(中国)有限公司;无水氯化钙(分析纯)、磷酸氢二钠(分析纯)、冰乙酸(HAc, 分析纯)、盐酸(HCl,质量分数为37%),上海凌峰化学试剂有限公司;六氟异丙醇(HFIP,分析纯),梯希爱化成工业发展有限公司;无水乙醇(分析纯),常熟市鸿盛精细化工有限公司;戊二醛溶液(GA,质量分数为25%)、碳酸氢钠、甘氨酸,国药集团化学试剂有限公司;2,4,6-三硝基苯磺酸(TNBS,质量分数为5%)、磷酸盐缓冲液(PBS,pH值为7.47),美国Sigma公司。
1.2 试样的制备
1.2.1 Col/PEO纳米纤维膜的制备
将I型胶原与PEO粉末溶解在HFIP和HAc的混合溶液(二者体积比为1∶1)中,溶液的质量分数为4%,Col和PEO的质量比为4∶1。室温下,将混合溶液置于磁力搅拌器上搅拌24 h后获得均一稳定的纺丝溶液。然后,将纺丝液吸入5 mL的注射器中,选用20号的铜针钝针头进行静电纺丝。纺丝参数为:纺丝电压14~6 kV,推注速度1 mL/h,接收距离20 cm。纺丝8 h后获得的Col/PEO纳米纤维膜置于28 ℃的真空烘箱中干燥24 h,以去除未挥发的溶剂,置于干燥箱中备用,记为0#样品。
1.2.2 Col/PEO纳米纤维膜的交联改性
EDC/NHS交联改性:称取一定量的EDC和NHS溶解在无水乙醇溶剂中,制备成交联反应溶液。其中,EDC和NHS的量比固定为2∶1,EDC的浓度分别为0.05、0.1和 0.15 mol/L。将Col/PEO纳米纤维膜裁剪成直径为80 mm的圆形,浸泡在配制好的交联溶液中,密封后置于4 ℃环境下反应18 h取出。然后,用0.1 mol/L的磷酸氢二钠溶液浸泡2 h,以水解O-异酰基脲中间体。最后,用PBS缓冲溶液(pH值为7.4)清洗3次(每次5 min)后,将EDC/NHS交联改性的Col/PEO纳米纤维膜置于-18 ℃环境下冷冻12 h,然后冷冻干燥6 h后置于干燥箱中室温条件下备用。3种浓度交联的纤维膜分别记为1#、2#、3#。
GA交联改性:取10 mL的25%的戊二醛溶液,倒入密封好的干燥器底部,将裁剪好的Col/PEO纳米纤维膜(直径为80 mm)固定在聚四氟乙烯板上,悬空置于干燥器中(距离底部高度为15 cm),用凡士林涂抹干燥器四周进行密封,置于室温条件下反应18 h;将交联好的纳米纤维膜取出,浸泡在0.2 mol/L的甘氨酸溶液中,于28 ℃的烘箱浸泡12 h以去除未反应的戊二醛分子。随后,将纳米纤维膜用PBS缓冲溶液(pH=7.4)清洗3次(每次5 min);最后与EDC/NHS交联后的纳米纤维膜类似,在相同条件下进行冷冻干燥得到GA交联改性的Col/PEO纳米纤维膜,置于干燥箱中室温条件下备用,记为4#。
1.3 试样测试与表征
1.3.1 交联度测试
为定量表征交联发生的程度,本文用TNBS测试纳米纤维膜的交联度。将交联前后的样品裁剪,称量确保其质量在1.8~2.2 mg之间,每个样品设置3个平行样并置于10 mL的离心管中。将质量分数为5%的TNBS溶液稀释成质量分数为0.5%的反应液;称取一定量的碳酸氢钠固体溶解在去离子水中,配制成质量分数为4%的碳酸氢钠溶液。然后在每个离心管中加入1 mL的碳酸氢钠溶液和1 mL的TNBS反应液,在40 ℃水浴反应2 h。 随后,每个离心管中加入3 mL的HCl溶液(浓度为6 mol/L),于60 ℃水浴反应1.5 h。最后,加入5 mL去离子水进行稀释,混合均匀后等体积取混合溶液置于96孔板中,利用Infinite 200 PRO型酶标仪(德国Tecan公司)测试345 nm波长条件下的吸光度,并利用下式[14]计算交联度(C):
式中:Anc和Ac分别为交联前后样品在345 nm处的吸光度;mnc和mc分别为交联前后样品的质量,mg。
1.3.2 纳米纤维膜液态环境下结构稳定性测试
将交联后的纳米纤维膜裁剪成2 cm×2 cm规格,每个样品设置5个平行样。称取样品的初始质量,随后将其浸泡在PBS缓冲溶液(pH值为7.4)中7 d;最后取出样品冷冻干燥后称取质量,计算样品的质量损失率的平均值。然后用TM-3000型扫描电子显微镜(SEM,日本Hitachi公司)对纤维的微观形貌进行观察,并利用ImageJ软件统计其直径,获得纤维直径的溶胀率。
1.3.3 化学结构测试
采用Nicolet 6700型红外光谱仪(美国Thermo Fisher公司)测试交联前后纳米纤维膜的化学结构,扫描范围为4 000~600 cm-1。
1.3.4 热稳定性测试
采用DSC-4000型差示扫描量热仪(DSC,美国Thermo Fisher公司)测试交联前后纳米纤维膜的热稳定性,测试范围为25~200 ℃,升温速率为10 ℃/min。
1.3.5 拉伸力学性能测试
采用XF-1A型电子强力仪(上海利浦应用科学技术研究所)测试交联前后纳米纤维膜在干态和湿态环境下的拉伸力学性能。将交联前后的纳米纤维膜裁剪成5 mm×50 mm规格,并在测试前随机取5个点测量其厚度,取平均值,然后进行测试。干态环境:提前2 h将样品置于20 ℃、相对湿度为65%的恒温恒湿环境中。湿态环境:提前2 h将样品浸泡在PBS缓冲溶液中,测试前将样品表面水分吸干。测试时每个样品设置5个平行样,通过拉伸断裂曲线获得纳米纤维膜的断裂强度、断裂伸长率和弹性模量,拉伸速度均为10 mm/min。
1.3.6 溶血性能测试
本文实验中采用的全血均采自成年新西兰大白兔(体重约为2.5 kg)的耳朵静脉,采用的凝血剂为0.109 mol/L的柠檬酸盐,其与血液的体积比为1∶9。血液采集完成后立即混合均匀,冷藏,并在4 h内结束所有血液测试。
溶血测试参考Elahi[15]的测试方法:取含有抗凝血剂的全血5 mL,在1 500 r/min转速下离心5 min,用适量的PBS缓冲溶液清洗3次,取下层沉淀,随后按照1∶34的体积比对其进行稀释,获得红细胞悬浮液(RBCS)。实验时,每个样品设置3个平行样,每个平行样中加入1 mL的RBCS和4 mL的PBS缓冲溶液,阴性对照为1 mL的RBCS和4 mL的PBS缓冲溶液,阳性对照为1 mL的RBCS和4 mL的去离子水。所有的样品置于恒温水浴锅于37 ℃培养2 h后,在1 500 r/min转速下离心3 min,取等量上清液置于96孔板中,利用酶标仪测试在540 nm波长下的吸光度,并根据下式计算溶血率(Hp):
式中:Dt为待测样品的吸光度;Dpc和Dnc分别为阳性和阴性对照组的吸光度。
1.3.7 凝血性能测试
采用凝血指数(BI)对纤维膜的凝血性能进行评价。凝血指数测试参考Seon[16]的方法,分别测试样品在5和10 min时的BCI值。将样品裁剪成2 cm×2 cm规格,每组样品取3个试样,放置在12孔板中,将整个装置密封放在37 ℃的水浴锅中恒温2 h,尽可能保证样品在短时间的凝血测试中温度保持在37 ℃。随后,向每个孔的样品上加入100 μL的抗凝全血和20 μL的0.2 mol/L的CaCl2溶液开启再凝血机制。将整个装置密封并放在37 ℃的水浴锅中恒温培养5和10 min,培养结束后加入5 mL去离子水,重新放回水浴锅中培养5 min后取出。将上清液尽量取出置于离心管中,室温下静置15 min后,利用酶标仪在540 nm波长条件下测试其吸光度值,并按照下式计算凝血指数(BI):
式中:It为待测样品的吸光度;Iw为100 μL抗凝全血和5 mL去离子水混合后的吸光度。
2 结果与讨论
2.1 Col/PEO纳米纤维膜交联度分析
为定量表征交联程度的大小,采用TNBS作为显色试剂测试交联度,其在碱性条件下与氨基酸的游离氨基反应形成中间络合物,加入浓盐酸后中间络合物会水解,最终反应物在约345 nm处有明显的特征吸收峰,因此,胶原和TNBS反应后的溶液在345 nm波长条件下的吸光度可反映胶原中游离氨基的数量。无论是GA还是EDC/NHS交联,其交联作用的发生都会消耗胶原分子链上的自由氨基,因此,默认未交联前的胶原为0%交联,通过测量交联前后纳米纤维膜和TNBS反应后溶液的吸光度,可定量表征交联程度。
EDC/NHS和GA交联对Col/PEO纳米纤维膜交联度的影响如图1所示。可以看出,随着EDC浓度的增加,纳米纤维膜的交联度逐渐增加。当EDC的浓度从0.1 mol/L升高至0.15 mol/L时,纳米纤维膜的交联度从47.36%增加到49.63%,二者之间无显著性差异。在EDC浓度初始增加阶段,胶原分子链上有大量的羧基,EDC可与其快速进行反应,此时随着EDC浓度的提高,交联度迅速增加。随着交联的发生,胶原分子链上供EDC反应的羧基结合位点迅速降低,继续提高EDC的浓度,交联度增加变的缓慢。

图1 EDC/NHS和GA交联Col/PEO纳米纤维膜的交联度测试结果


图2 GA和EDC/NHS交联胶原的交联机制
2.2 Col/PEO纳米纤维膜结构稳定性分析
敷料在使用过程中不可避免地会接触到伤口渗出液,而胶原在细胞外基质中以50~500 nm的纤维形式存在,因此,胶原纳米纤维需要通过交联来维持其在液态环境下的纳米纤维结构,从而为伤口愈合提供适宜的微环境。为评价交联对纳米纤维结构稳定性的影响,对交联后纳米纤维在PBS缓冲溶液中浸泡后的形貌进行测试,结果如图3所示。

图3 PBS浸泡前后Col/PEO纳米纤维膜的形貌
由图3(a)可知,Col/PEO纺丝液经静电纺丝后可获得均匀连续的纳米纤维,但纳米纤维膜稳定性极差,在PBS缓冲溶液中浸泡30 min后即破碎成小块,其纳米纤维结构已经遭到极大的破坏,因此,交联处理对Col/PEO纳米纤维膜极其重要。从图3(b)~(e)可以看出,EDC/NHS交联对Col/PEO纳米纤维的形貌影响较小,而GA交联获得的纳米纤维膜在未浸泡之前,纤维之间有一定的溶胀和粘连,这是由于在GA交联过程中伴随着水的蒸发,纳米纤维膜会吸收一定的水分而溶胀,在纤维重叠地方产生粘连。
图3中右侧为Col/PEO纳米纤维膜经PBS浸泡后的形貌,其中,未交联纳米纤维膜的浸泡时间为30 min,交联后纳米纤维膜的浸泡时间为7 d。可以看出,经交联后的纳米纤维膜在浸泡7 d后均保留了部分纳米纤维结构,这进一步说明交联对液态环境下纳米纤维的结构稳定性提高明显。对于EDC/NHS交联来讲,随着EDC浓度的增加,浸泡后纤维的溶胀程度降低。其中,0.1和0.15 mol/L交联后的2#和3#样品在浸泡7 d后可保持良好的纳米纤维结构,其纤维直径的溶胀率分别为183%和141%。此外,为定量表征纤维膜的耐水性,测定了交联样品的质量损失率,浸泡7 d后1#~3#纳米纤维膜的质量损失率分别为(29.9±5.2)%、(33.8±2.7)%和(41.2±3.7)%,说明随着EDC浓度的增加,纤维膜的质量损失率逐渐降低。
2.3 Col/PEO纳米纤维膜化学结构分析
未交联、 EDC/NHS(EDC浓度为0.1 mol/L)以及GA交联的Col/PEO纳米纤维膜的红外光谱图如图4所示。

图4 交联前后Col/PEO纳米纤维膜的红外光谱图

2.4 Col/PEO纳米纤维膜热稳定性分析
胶原的三螺旋结构会随着温度的升高逐渐解开,最终变成3条无规则的肽链,造成其生物功能的急剧下降,因此,可利用DSC测试交联处理后Col/PEO纳米纤维膜的热稳定性。在胶原加热过程中会产生1个典型的热吸收峰,其峰值温度称为变性温度[18]。交联前后纳米纤维膜以及胶原的DSC升温特征曲线及变性温度如图5所示。可以看出,纯胶原的DSC曲线上有1个宽的特征吸收峰,而交联后的纳米纤维膜均出现了2个特征吸收峰,其中,51 ℃附近较弱的吸热峰是由于纳米纤维膜中一定量PEO的存在造成的。同时,第2个宽的特征吸收峰可表征胶原的热稳定性,胶原经过静电纺丝后,其变性温度降低了约10.8 ℃,这和静电纺丝的加工方式有关。有研究表明,静电纺丝加工方式会造成聚合物分子链的链节运动性增强,从而造成其变性温度降低[19]。

图5 胶原以及交联前后Col/PEO纳米纤维膜的DSC升温曲线
与未交联的Col/PEO纳米纤维膜(0#)相比,交联后Col/PEO纳米纤维膜的变性温度都有了不同程度的提高,其中GA交联纤维膜(4#)的变性温度升高近9.5 ℃,而采用EDC/NHS交联,当EDC浓度为0.1 mol/L时,交联纳米纤维膜(2#)的变性温度略高于未交联的纳米纤维膜。综合以上分析可以看出,GA交联处理提高了胶原的热稳定性,而EDC/NHS交联对于胶原的热稳定性无明显影响。不同交联方式对胶原热稳定提高的差异,可能是由于GA交联在交联位点上的交联间距大于EDC交联的,导致GA交联纤维膜中胶原产生较多的分子间交联,而EDC交联产生的分子间交联较少的缘故[20]。
2.5 Col/PEO纳米纤维膜力学性能分析
无论伤口敷料是外用保护皮肤伤口,还是作为内部伤口支撑,在使用过程中都需要承受一定的张力。交联前后Col/PEO纳米纤维膜的拉伸曲线如图6所示。从图6(a)可以看出:交联前后纳米纤维膜在干态环境下的应力-应变曲线相似,在拉伸的初始阶段,纳米纤维膜中的纳米纤维先伸直,表现为随着外力的增加,纳米纤维膜的应力应变均显著增加;当纳米纤维膜中的纤维完全伸直后,外力继续增加,纤维之间会产生相互滑移,表现为随着外力的增加,纳米纤维膜的应变逐渐增加,但应力变化很小;最后随着拉伸的继续,纤维的滑移逐渐减小,在拉伸作用下断裂,表现为随着外力的增加,纳米纤维膜的应变继续增加,但应力急剧下降。
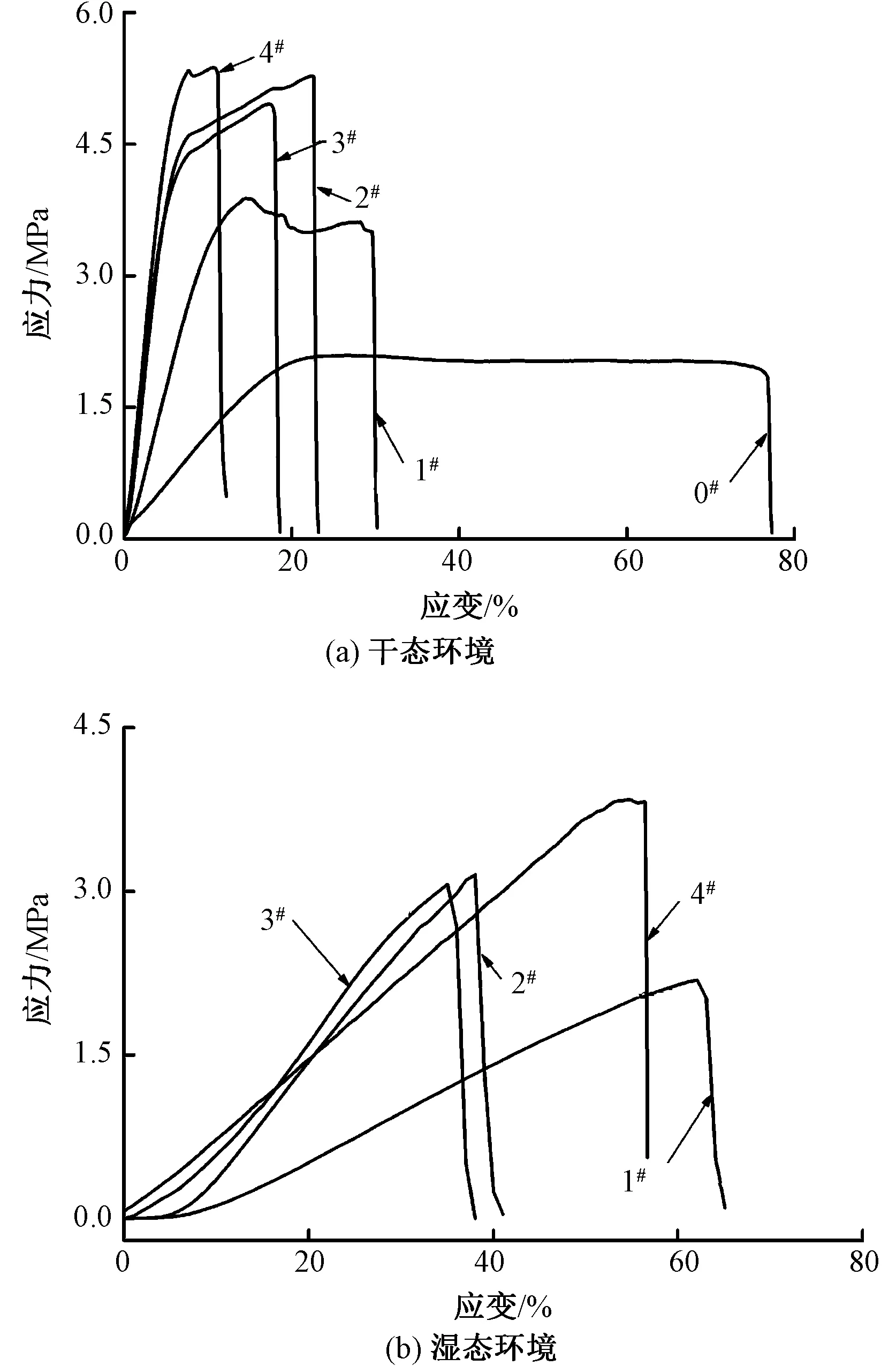
图6 交联前后Col/PEO纳米纤维膜的应力-应变曲线
从图6(b)可以看出,在湿态环境下,交联后Col/PEO纳米纤维膜的应力-应变曲线没有出现明显的屈服阶段,这可能是由于纳米纤维在湿态环境下吸水溶胀并产生一定的粘连,在拉伸作用下纤维之间的滑移阻力比较大,因此,应力随着应变的增加而逐渐变大。
表1示出交联后Col/PEO纳米纤维膜在干态和湿态环境下拉伸性能测试结果。未交联的样品在干态环境下的断裂强度为(2.18±0.43) MPa,断裂伸长率为(79.77±6.43)%。由表1可以看出,相对于未交联纳米纤维膜,交联会使其断裂强度增加,而断裂伸长率降低,这是由于交联作用增加了胶原分子间的作用力,降低了纤维膜的厚度,纤维膜断裂强度随之增加;此外,分子间作用力的增强会导致纤维之间产生滑移阻力,使断裂伸长率出现降低。此外,EDC/NHS交联中,当EDC浓度为0.1和0.15 mol/L时,交联后获得的Col/PEO纳米纤维膜(2#和3#)的力学性能指标无显著性差异。可以看出,相对于干态环境,湿态环境下纳米纤维膜的断裂强度显著降低(P<0.01),断裂伸长率显著提高(P<0.01)。断裂强度的降低是由于经过PBS浸泡后,水分子进入纤维内部,纤维膨胀造成其一定程度的解取向。此外,经过静电纺丝后纳米纤维并不是以最低能量的状态沉积在接收装置上,因此,浸泡后的纳米纤维会调整到最低能量状态,产生一定程度的卷曲,同时纤维集合体中水分的存在也会降低纤维之间的滑移阻力,最终使纤维膜断裂伸长率增加[21-22]。
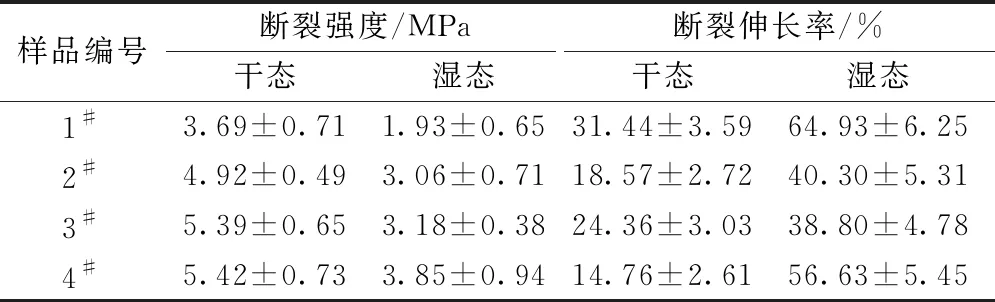
表1 交联后Col/PEO纳米纤维膜的力学性能
2.6 Col/PEO纳米纤维膜溶血性能分析
在伤口敷料的使用过程中,其会和血液中红细胞、血小板等直接接触,因此,血液相容性对伤口敷料的应用至关重要。溶血现象是指血液中的红细胞与生物材料接触时,红细胞破裂释放血红蛋白的现象,通过监测上清液的吸光度,可表征样品对红细胞的破坏程度。为直观检验交联处理后纳米纤维膜是否会破坏红细胞,溶血率检测后离心提取上清液观察,上清液的颜色越红,说明破坏的红细胞数量越多。溶血率测试后溶液的上清液外观图如图7(a)所示。可以看出,除阳性对照样以外,所有交联Col/PEO纳米纤维膜的上清液均呈现出和阴性对照样一样接近透明的颜色。
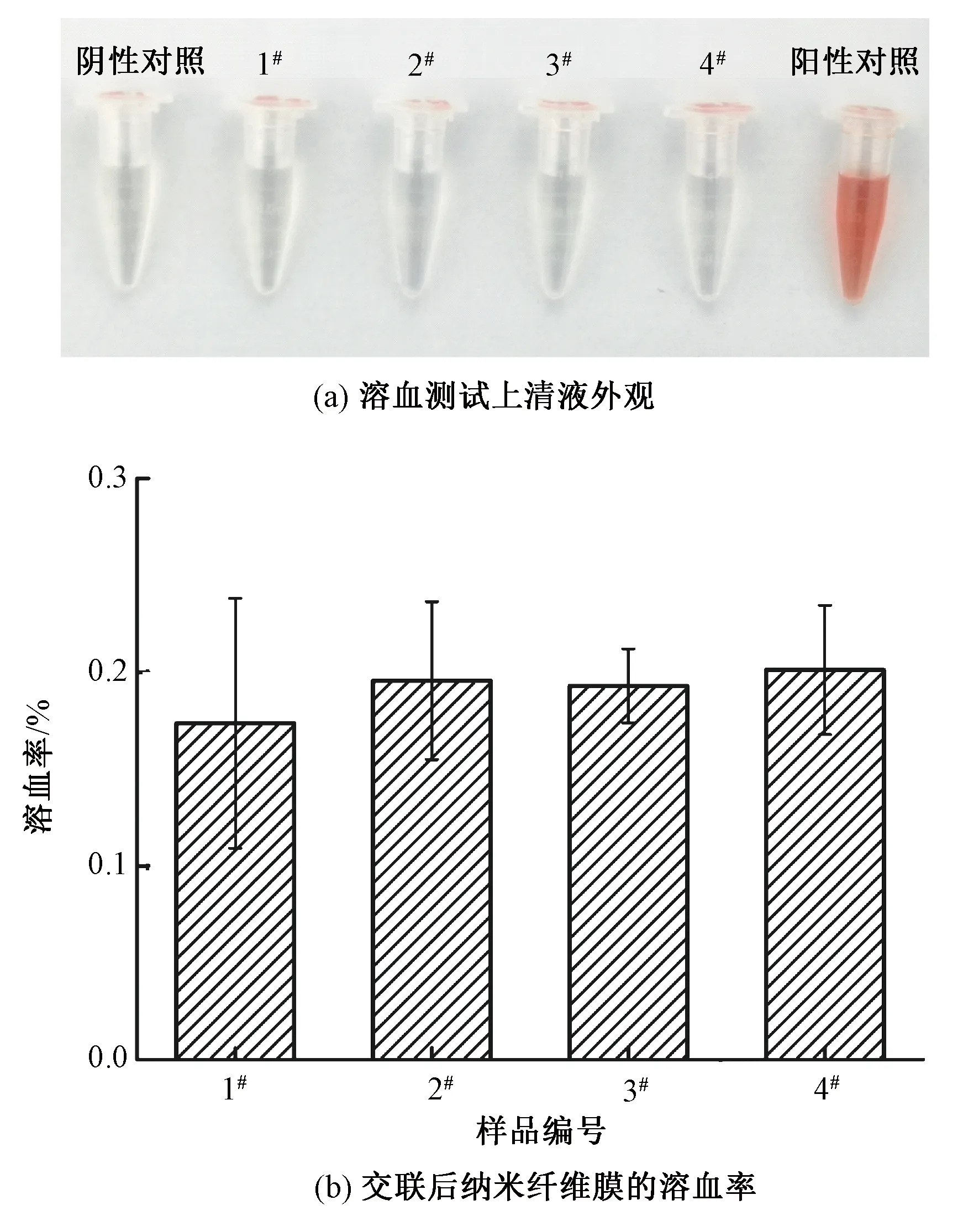
图7 Col/PEO纳米纤维膜溶血测试上清液外观图及溶血率测试结果
为定量表征Col/PEO纳米纤维膜的溶血率,通过对上清液的吸光度进行测试,计算纤维膜的溶血率结果如图7(b)所示。可以看出,所有交联后的Col/PEO纳米纤维膜的溶血率均在0.1%~0.3%之间。参考ASTM F756—2017《材料溶血性能评估的标准实施规程》可知,经过交联后纳米纤维膜均不溶血,这说明交联处理后的Col/PEO纳米纤维膜具有良好的血液相容性。
2.7 Col/PEO纳米纤维膜凝血性能分析
关于材料的凝血性能,有研究证明在无辅助方式的情况下,一般伤口均可在自身凝血系统的帮助下在10 min内实现凝血[16],因此,为在体外表征纳米纤维膜的止血效果,测试了所有交联样品在5和10 min时的凝血指数(BI),结果如图8所示。

图8 交联前后Col/PEO纳米纤维膜及医用纱布的凝血指数
由图8可以看出,所有样品在10 min时的BI值均显著低于5 min时的(P<0.01),这是由于随着凝血时间的延长,血液中的凝血块会越来越稳固,当加入去离子水时,破裂的红细胞会越来越少,BI值就越低。在相同的时间点,Col/PEO纳米纤维膜的BI值均显著低于医用纱布(图中5#)的(P<0.001),这表明Col/PEO纳米纤维膜在无外力帮助下,会显著促进血液凝固。此外,和未交联的Col/PEO纳米纤维膜相比,交联Col/PEO纳米纤维膜的BI值均显著降低(P<0.05),这表明交联处理可提高其凝血性能,但不同交联方式以及不同EDC/NHS浓度的交联样品之间无显著差异。
众所周知,胶原可促进血小板的黏附和聚集,从而促进凝血过程的发生[23-24],因此,对于Col/PEO纳米纤维膜来讲,其应该能够为血小板的黏附和聚集提供足够稳定的物理支持,以促进血小板黏附和凝血因子的结合,并最终迅速形成血凝块[23-24]。对于未交联的样品,纳米纤维接触到血液时会快速吸收水分并溶胀,纤维膜结构的完整性将被部分破坏,无法为凝血因子的黏附以及凝血块的形成提供有效的物理支持,因此,交联样品的BI值会显著低于未交联的样品。
3 结 论
本文采用1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐/N-羟基琥珀酰亚胺(EDC/NHS)为交联剂,对胶原/聚环氧乙烷(Col/PEO)纳米纤维进行交联。首先,探究了不同浓度EDC交联18 h后纳米纤维膜的交联度变化。结果表明,随着EDC浓度的增加,纳米纤维膜的交联度逐渐增加,0.1和0.15 mol/L交联Col/PEO纳米纤维的交联度之间无显著性差异。其次,对交联后纳米纤维膜在液态环境下的结构稳定性、力学性能和理化性能进行表征。结果表明,经交联后Col/PEO纳米纤维在液态环境下的溶胀明显降低,在PBS缓冲溶液中浸泡7 d后仍可保持比较好的纳米纤维形貌,力学性能也显著增加。最后,对交联Col/PEO纳米纤维的血液相容性进行测试。结果表明,交联后的纳米纤维对红细胞没有明显破坏,在体外可明显促进血液凝固。上述结果表明,Col/PEO纳米纤维膜经过EDC/NHS交联后,其在愈合周期长、愈合速度较慢的伤口护理中具备很大的应用潜力。
