黑鱼胶原溶液的流变、热稳定性及化学交联改性研究
2022-01-15刘文涛白聪沈里瑞
刘文涛,白聪,沈里瑞
(1.四川大学皮革化学与工程教育部重点实验室,四川 成都 610065;2.四川大学制革清洁技术国家工程研究中心,四川 成都 610065;3.四川大学轻工科学与工程学院,四川 成都 610065)
引言
胶原是构成细胞外基质的重要组分,是动物结缔组织的主要纤维蛋白,因其优良的生物相容性、生物降解性、低抗原性等性质,被广泛用于化妆品、制药、食品、医学等领域[1-3]。目前,商品化胶原主要取材于牛、猪等陆生哺乳动物的皮、腱、骨等结缔组织,但由于疯牛病、口蹄疫等人畜共患病在世界范围内的频繁爆发,导致哺乳动物胶原及其制品存在较大的生物安全风险[4-6]。因此,寻求能够完全或部分替代哺乳动物胶原的新型胶原材料是近年来的研究热点[7-9]。相对而言,从鱼加工废弃物中提取的鱼胶原具有生物安全性好、原料来源丰富且成本低廉等优势,因而当前围绕鱼胶原的制备、改性及应用的研究方兴未艾[10-12]。
I型胶原是动物皮(牛皮、鱼皮等)中含量最多的胶原类型[1]。不论是牛皮还是鱼皮,从中提取的I型胶原分子都具有由3条多肽链相互缠绕而成的三股螺旋结构,其分子长度约为300 nm,相对分子质量约为30万[1,10,13]。然而,胶原的氨基酸组成、热稳定性等性质与动物的种属及生存环境密切相关。一般而言,陆生哺乳动物胶原比鱼胶原的热稳定性更好,这主要是由于前者的亚氨基酸(脯氨酸和羟脯氨酸)含量更高,而亚氨基酸对于氢键的形成及三股螺旋结构的稳定都至关重要[13,14]。因此,基于鱼胶原和牛皮胶原结构与性能的异同,目前已有大量关于不同来源鱼胶原的研究报道,但其相关信息仍然不足以支撑鱼胶原的规模化开发利用。其一,鱼胶原在制备与应用过程中通常会涉及胶原溶液的加工处理(如萃取、胶凝、纺丝和成膜),故充分了解胶原溶液的流变性能非常重要[15-17],然而鲜见有关鱼胶原溶液的流变学研究。例如,Zhang等[18]测试了较高浓度(10~20 mg/mL)大鳍鳠鱼皮胶原溶液的流变性能,但也有必要了解较低浓度的鱼胶原溶液(如胶原提取液)的流变行为及其与牛皮胶原溶液的差异。其二,鱼胶原作为一类蛋白质材料,理解其热稳定性及与哺乳动物胶原的区别对其实际应用具有重要意义[19-22],但胶原的热稳定性测试高度依赖于样品状态和实验条件[10,14],甚至于针对同一来源鱼胶原的不同文献报道的胶原变性温度数值存在差异,从而缺乏在相同条件下对各种胶原材料热稳定性的比较研究。其三,与哺乳动物胶原相比,鱼胶原较差的热稳定性与机械力学性能限制了其实际应用[11],进而需要通过交联或共混策略强化材料的综合性能,但关于鱼胶原的改性研究较为少见。例如,已有报道采用“零长度”的碳化二亚胺交联剂增强鲑鱼胶原的热稳定性[11],然而关于交联剂分子长度对鱼胶原改性效果的影响尚不清楚。
本文对比研究了相同浓度(5 mg/mL)的黑鱼胶原与牛皮胶原溶液的流变和热稳定性,并考察了温度对黑鱼胶原的动态粘弹性以及成纤维性能的影响,最后分析比较了两种交联剂(己二酸-N-羟基琥珀酰亚胺酯、戊二醛)对黑鱼胶原溶液的交联改性效果,为黑鱼胶原的高值转化利用提供理论和技术参考。
1 实验部分
1.1 主要材料与仪器
1.1.1 主要材料
黑鱼鱼皮和牛皮I型胶原海绵均为实验室自制,分别参照文献方法制备[8,16];冰醋酸、己二酸、戊二醛、丙酮、二甲亚砜(DMSO)、乙二胺四乙酸二钠(EDTA)、十二烷基硫酸钠(SDS)、磷酸氢二钠、磷酸二氢钠、氯化钠均为分析纯,购自成都科龙化工试剂厂;高分子量标准蛋白为电泳级,购自美国BIO-RAD公司;N-羟基琥珀酰亚胺(NHS)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC·HCl)均为分析纯,购自上海共价化学科技有限公司;去离子水(自制);其它化学试剂为国产分析纯。
1.1.2 主要仪器
3700高速冷冻离心机,日本KUBOTA公司;FD-1冷冻真空干燥机,北京博医康实验仪器有限公司;DZF-300真空干燥箱,郑州长城科工贸有限公司;pHS-3C型pH计,上海精密科学仪器有限公司;Mini-PROTEAN 3 Cell Assembly电泳仪,美国Bio-Rad公司;Gemini 200动态流变仪,英国Malven公司;Lambda 25紫外可见分光光度计,美国PERKIN-ELMER公司;Nicolet iS10傅里叶变换红外光谱(FTIR)仪,美国Thermo Scientific公司;DSC 200PC差示扫描量热仪,德国NETZSCH公司;Agilent 400-MR DD2核磁共振波谱仪,美国Agilent Technologies公司。
1.2 实验方法
1.2.1 胶原溶液的流变测试
动态频率扫描:用0.1 mol/L醋酸分别配制相同浓度(5 mg/mL)的黑鱼鱼皮胶原和牛皮胶原溶液,在18℃下用动态流变仪检测弹性模量G‘、粘性模量G‘‘、损耗角正切Tanδ(G‘‘/G‘)和复数粘度η*随扫描频率的变化情况;采用锥形板夹具(锥角4°、直径40 mm),应变5%,扫描频率为0.01~10 Hz。
温度对胶原溶液动态粘弹性的影响:用上述动态流变仪对5 mg/mL黑鱼胶原溶液进行线性升温并扫描收集流变数据;固定频率1 Hz,应变5%,升温速率0.5℃/min,扫描温度区间18~40℃。
1.2.2 差示扫描量热(DSC)分析
分别以相同浓度(5 mg/mL)的黑鱼胶原和牛皮胶原溶液为测试对象,考察胶原热变性DSC曲线随升温速率的变化规律。样品参比为0.1 mol/L醋酸,氮气保护60 mL/min,升温速率采用2、5和8℃/min,温度区间4~60℃。
1.2.3 热动力学分析
采用热动力学分析手段(基于多重升温速率的等转化率法:Friedman法和OFW法)[21,22],分别对1.2.2获得的两种胶原的DSC曲线进行动力学分析,对比考察不同胶原热变性活化能随转化率的变化规律。
1.2.4 胶原成纤维浊度曲线测定
用0.01 mol/L醋酸配制5 mg/mL黑鱼胶原溶液,将其用含氯化钠的磷酸盐缓冲液进行稀释,最终所得胶原溶液的各项参数分别为:胶原浓度1 mg/mL、磷酸盐浓度10 mmol/L、氯化钠浓度80 mmol/L、pH值7.1。采用紫外可见分光光度计检测样品吸光度变化得到胶原成纤维浊度曲线,扫描波长为313 nm。根据浊度曲线分别计算达到最大吸光度值一半所需时间(t1/2)和达到平衡时吸光度的变化值(h),对比考察温度28、29、30、31和32℃对黑鱼胶原成纤维动力学的影响。
1.2.5 己二酸NHS酯的合成与表征
在文献报道合成方法[23]的基础上进行了调整:先用丙酮将己二酸和NHS溶解,然后向混合溶液中加入EDC·HCl,在常温下搅拌反应24 h后,减压旋转蒸发除去溶剂,采用结晶、真空干燥等方法对合成产物进行纯化,得到己二酸NHS酯。用核磁共振(NMR)对样品结构进行1H NMR表征;采用FTIR验证酯基官能团,扫描波数450~4000 cm-1,分辨率为2 cm-1。
1.2.6 黑鱼胶原溶液的交联改性
酸性条件下的交联改性:用0.1 mol/L醋酸配制5 mg/mL黑鱼胶原溶液,用DMSO配制0.125 mol/L己二酸NHS酯溶液,将其逐滴加入黑鱼胶原溶液中,使得NHS酯活性基团与胶原氨基的摩尔比为1,在18℃下分别反应24 h和72 h后,用甘氨酸中止反应并对0.1 mol/L醋酸进行透析,分别得到NHS酯改性黑鱼胶原SSC(a-N1)和SSC(a-N1×3);按照类似方法,采用0.125 mol/L戊二醛水溶液,制备得到戊二醛改性黑鱼胶原SSC(a-G1)和SSC(a-G1×3)。
碱性条件下的交联改性:将0.125 mol/L己二酸NHS酯溶液分别逐滴加入四份5 mg/mL黑鱼胶原溶液中,使得NHS酯活性基团与胶原氨基的摩尔比分别为1/6、1/2、1和1,快速搅拌均匀,再用NaOH调pH约为10,在18℃下分别反应24、24、24和72 h后,用甘氨酸中止反应,再用0.1 mol/L醋酸透析,分别得到NHS酯改性黑鱼胶原SSC(b-N1/6)、SSC(b-N1/2)、SSC(b-N1)和SSC(b-N1×3);按照类似方法,分别制备得到戊二醛改性鱼胶原样品SSC(b-G1/6)、SSC(b-G1/2)、SSC(b-G1)和SSC(b-G1×3)。
1.2.7 交联改性黑鱼胶原的表征
电泳测定:参照文献报道方法[12],将1.2.6所述12种改性鱼胶原样品分别与电泳样品处理液混合,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)手段考察不同的化学交联改性条件对黑鱼胶原结构的影响,以未改性胶原样品作为对照。
热分析:采用DSC对比考察改性前后黑鱼胶原样品的热变性情况,升温速率5℃/min,扫描温度区间4~70℃。
2 结果与讨论
2.1 黑鱼胶原溶液的动态流变性能
流变测试能够获得高分子材料在应力/应变条件下的动态粘弹性信息。图1展示了相同浓度的黑鱼胶原和牛皮胶原溶液的动态粘弹性参数(G‘、G‘‘、Tanδ和η*)随频率的变化规律。
由图1(a)和(b)可知,两种胶原溶液的弹性模量和粘性模量都随着扫描频率的增加而升高,而且在相同频率下(个别高频区除外)黑鱼胶原溶液的粘弹性模量均低于牛皮胶原溶液的相应模量。此外,从图1(c)和(d)发现,牛皮胶原和黑鱼胶原溶液由粘性流动转变为弹性流动的交叉点频率分别为0.88 Hz和1.51 Hz。在交叉点频率以下,两种胶原溶液的G‘<G‘‘,表现为似液体的粘性流动行为,而在交叉点频率以上,二者转变为似固体的弹性流动行为(G‘>G‘‘)。交叉点频率与分子链段的松弛特性有关,频率越大表明松弛越快,可见黑鱼胶原比牛皮胶原分子的链段松弛更快。相对而言,两种胶原溶液的损耗角正切都随着频率的增加而降低,且黑鱼胶原溶液的Tanδ均大于相同频率(当频率低于4 Hz)下牛皮胶原溶液的Tanδ(见图1(e))。当频率低于0.8 Hz时,Tanδ都大于1,表明此时两种胶原溶液都是粘性特征占主导地位,然而牛皮胶原比黑鱼胶原的Tanδ小,这可能是由于牛皮胶原分子链段缠结程度更高[16],链段运动时的内摩擦力更大,从而使链段运动受阻,表现为弹性特征相对略强。另外,两种胶原溶液的复数粘度也都随着频率增加而降低(图1(f)),呈现剪切变稀流变行为,且在相同频率下黑鱼胶原比牛皮胶原溶液的η*更小,说明黑鱼胶原比牛皮胶原分子缠结程度更低。

图1 黑鱼胶原(SSC)和牛皮胶原(BHC)溶液的G‘(a)与G‘‘(b)对频率的依赖关系;牛皮胶原(c)和黑鱼胶原(d)溶液的G‘与G‘‘的交叉点频率;胶原溶液的Tanδ(e)与η*(f)对频率的依赖关系Fig.1 The dependences of storage modulus(G‘)(a)and loss modulus(G‘‘)(b)for the snakehead skin collagen(SSC)and bovine hide collagen(BHC)solutions on dynamic frequency.The crossover frequency of dynamic modulus(G‘and G‘‘)for the BHC(c)and SSC(d)solutions.The dependences of loss tangent(Tanδ)(e)Ѳand complex viscosity(η*)(f)for the collagen solutions on dynamic frequency
流变和热稳定性是鱼胶原区别于哺乳动物胶原的两大显著特征[1]。在上述动态频率扫描的基础上,进一步考察了温度对黑鱼胶原溶液动态粘弹性的影响,结果如图2所示。
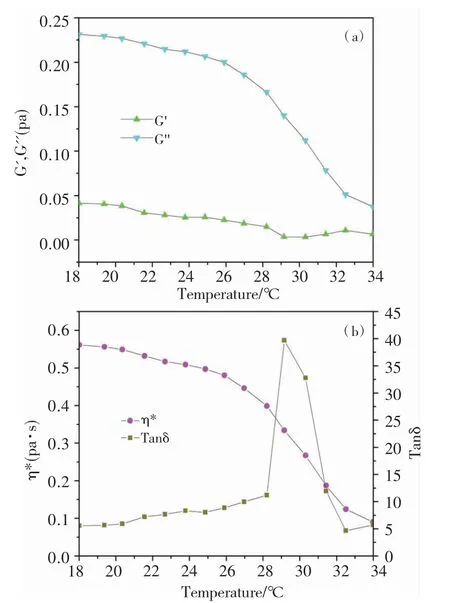
图2 黑鱼胶原溶液(5 mg/mL)的弹性模量G‘和粘性模量G"(a)以及复数黏度η*和损耗角正切Tanδ(b)对温度的依赖关系Fig.2 Temperature dependences of the dynamic modulus(G‘and G")(a)as well as the complex viscosity(η*)and loss tangent(tanδ)(b)for the snakehead skin collagen(SSC)solution(5 mg/mL)
从图中可看出,当温度低于26℃时,随着温度的上升,G‘‘和η*逐渐下降而G‘和Tanδ变化不大;当温度介于26~32℃,G‘‘和η*都快速下降,同时Tanδ出现最大峰值,这是由于温度诱导胶原构象发生转变,即从天然的三股螺旋结构变性为无规卷曲构象[16-18]。通常把升温流变测试时Tanδ的峰值对应的温度称为胶原的动态变性温度(Tdd),牛皮胶原、大鳍鳠胶原和黑鱼胶原的Tdd分别为32.6℃[16]、29.5℃[18]和29.2℃,表明黑鱼胶原的动态流变稳定性与大鳍鳠胶原相当,但二者都低于牛皮胶原。
2.2 黑鱼胶原溶液的热稳定性分析
本文从以下3个方面研究考察了黑鱼胶原溶液的热稳定性:1)比较相同浓度黑鱼胶原和牛皮胶原溶液在多个升温速率下的DSC曲线,见图3;2)基于等转化率法动力学分析,从活化能角度对比两种胶原溶液的热行为,见图4;3)考察不同温度对黑鱼胶原成纤维过程的影响,见图5。
由图3可知,两种胶原溶液的DSC吸热峰都随着升温速率的增加而向高温方向移动,说明二者的热变性都是动力学控制过程[21,22]。在相同升温速率下,黑鱼胶原的热变性DSC峰值温度明显低于牛皮胶原的相应数值,分别为2℃/min:31.1℃和39.3℃;5℃/min:32.3℃和40.4℃;8℃/min:32.9℃和40.9℃,说明黑鱼胶原的热稳定性相对牛皮胶原较弱。
为了进一步挖掘图3中DSC曲线的热动力学信息,采用等转化率法(Friedman法和OFW法)考察了胶原热变性活化能随转化率的变化规律。由图4可知,尽管两种等转化率法对于同一胶原样品的分析结果存在一定差异,但黑鱼胶原和牛皮胶原的热变性活化能随转化率的增加都是整体呈下降趋势,且近似于先凹后凸,这说明两种胶原的热变性过程都为多步复杂反应[21,22]。特别需要强调的是,在热变性的初始阶段(转化率小于0.5),相同转化率下黑鱼胶原的热变性活化能低于牛皮胶原的活化能,表明黑鱼胶原的热稳定性略差。

图3 黑鱼胶原(SSC)和牛皮胶原(BHC)溶液(5 mg/mL)在不同升温速率下的DSC曲线Fig.3 DSC curves of the snakehead skin collagen(SSC)and bovine hide collagen(BHC)solutions(5 mg/mL)at different heating rates

图4 黑鱼胶原(SSC)和牛皮胶原(BHC)溶液(5 mg/mL)热变性的等转化率法动力学分析Fig.4 Isoconversional kinetic analyses of the thermal denaturation of the snakehead skin collagen(SSC)and bovine hide collagen(BHC)solutions(5 mg/mL)
胶原在模拟生理条件下的自组装成纤维性质对于其高值应用十分重要[1]。由图5可知,随着温度的升高,黑鱼胶原成纤维的速度加快(t1/2逐渐下降),同时成纤维浊度的最大值呈现出先增加后降低的趋势(△h在30℃时达到峰值),这是由于胶原成纤维的主要驱动力是疏水作用,而升温有利于增强疏水作用[24],从而促使胶原成纤维进行,但当温度临近胶原的热变性温度时,胶原分子结构遭受破坏,进而阻碍了自组装胶原纤维的形成。可见,30℃是适于黑鱼胶原成纤维的较优温度条件,但该温度明显低于人体的正常生理温度。若想将黑鱼胶原在人体内进行原位自组装成纤维的应用,有必要通过改性手段提高其在生理环境下的结构稳定性。

图5 温度对黑鱼胶原成纤维的影响(a)胶原成纤维浊度变化曲线;(b)达到最大吸光度值一半所需时间(t1/2)以及达到平衡时吸光度的变化值(h)对温度的依赖关系Fig.5 Effect of temperature on the fibril formation of the snakehead skin collagen(SSC)(a)The turbidity curves for collagen fibril formation;(b)Temperature dependences of the rate of collagen fibril formation(t1/2)and total increase of absorbance(h)when equilibrium reached
2.3 黑鱼胶原溶液的化学交联改性
综合2.1和2.2所述可知,黑鱼胶原的结构稳定性比牛皮胶原差,在一定程度上限制了黑鱼胶原的应用,因而有必要通过化学交联等手段改性提升胶原材料的稳定性[10,11]。据报道,交联剂的分子长度对于有效稳固胶原三股螺旋结构非常关键[25],因而本文对比考察了两种分子碳链长度相当的交联剂对黑鱼胶原的改性效果:1)戊二醛,传统的胶原交联剂,反应活性高,但生物相容性较差[1,26];2)己二酸NHS酯,近年来新兴的蛋白偶联剂,反应活性和生物相容性都较好[1,14]。
图6为合成的己二酸NHS酯的1H NMR和FTIR图谱。由图6(a)可知,化学位移为2.775、2.707和1.675的氢个数分别对应为8、4和4,故总氢个数为16,证明己二酸与NHS成功反应生成了己二酸NHS酯。化学位移为2.467和3.360分别对应DMSO溶剂峰和水峰。此外,图6(b)在1739 cm-1、1210 cm-1和1065 cm-1等处显示了酯基的特征吸收峰,进一步验证了合成产物的分子结构。
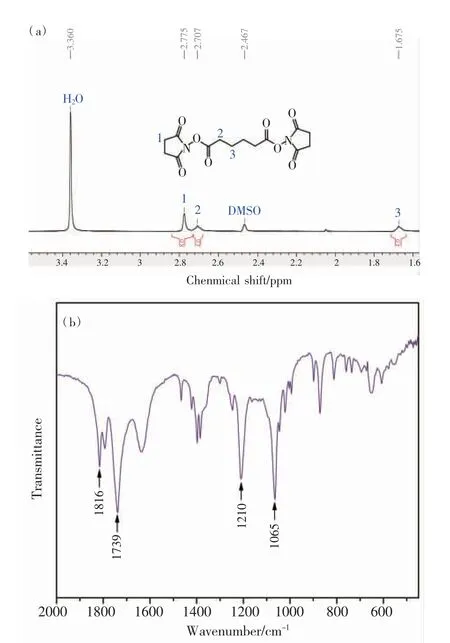
图6 己二酸NHS酯的核磁共振氢谱(a)和红外光谱(b)Fig.6 The 1H NMR(a)and FTIR(b)spectra of the adipic acid N-hydroxysuccinimide(NHS)ester
图7是在不同反应条件下己二酸NHS酯与戊二醛交联改性黑鱼胶原的电泳图谱。由图7(a)可知,在酸性条件下改性胶原的电泳条带跟未改性胶原相比几乎没有差别,而且延长反应时间对电泳图谱没有影响;在碱性条件下改性胶原的电泳条带明显不同于未改性胶原,当NHS酯活性基团与胶原氨基的摩尔比分别为1/6和1/2时,两条胶原α链的颜色都变浅,而且SSC(b-N1/2)比SSC(b-N1/6)的α链颜色更浅,同时均可见γ链以上组分出现,证明发生了分子间交联。可见,交联反应在碱性条件下更容易进行,而且胶原α链之间的缔合随交联剂用量的增加而更加明显。当NHS酯活性基团与胶原氨基的摩尔比为1时,样品的两条α链都消失,而只能看到少量γ链以上的条带,且延长反应时间对改性胶原的电泳图谱也没有影响,表明此时的交联剂用量可以获得足够高的交联强度,并且胶原分子间的交联占主导地位。

图7 (a)己二酸NHS酯交联改性黑鱼胶原的电泳图谱:条带1,未改性胶原;2,SSC(b-N1×3);3,SSC(a-N1×3);4,SSC(b-N1);5,SSC(a-N1);6,SSC(b-N1/2);7,SSC(b-N1/6);8,标准蛋白(b)戊二醛交联改性黑鱼胶原的电泳图谱:条带1,标准蛋白;2,SSC(b-G1/6);3,SSC(b-G1/2);4,SSC(b-G1);5,SSC(a-G1);6,SSC(b-G1×3);7,SSC(a-G1×3);8,未改性胶原Fig.7(a)SDS-PAGE patterns of the snakehead skin collagen(SSC)crosslinked by the adipic acid N-hydroxysuccinimide(NHS)ester.Lane 1,unmodified SSC;2,SSC(b-N1×3);3,SSC(a-N1×3);4,SSC(b-N1);5,SSC(a-N1);6,SSC(b-N1/2);7,SSC(b-N1/6);8,standard protein marker(b)SDS-PAGE patterns of the snakehead skin collagen(SSC)crosslinked by glutaraldehyde.Lane 1,standard protein marker;2,SSC(b-G1/6);3,SSC(b-G1/2);4,SSC(b-G1);5,SSC(a-G1);6,SSC(b-G1×3);7,SSC(a-G1×3);8,unmodified SSC
从图7(b)中可以看出,在酸性条件下以及在碱性条件下当醛基与胶原氨基的摩尔比分别为1/6和1/2时,戊二醛改性胶原的电泳图谱跟上述NHS酯改性样品的规律基本一致,唯一不同的是,SSC(b-G1/2)与SSC(b-G1/6)的电泳图谱差别比SSC(b-N1/2)与SSC(b-N1/6)的电泳图谱差别更为明显。此外,当醛基与胶原氨基的摩尔比为1时,反应24 h就看不到任何电泳条带,这说明戊二醛比NHS酯具有更强的交联反应能力。
图8为己二酸NHS酯与戊二醛交联改性黑鱼胶原溶液的DSC曲线。由图8可知,酸性条件改性胶原SSC(a-N1)、SSC(a-G1)与未改性胶原样品的热变性峰略有差别,但峰值温度都在32℃左右,而且改性后胶原的DSC曲线变得不规则,这可能是由于交联作用诱导溶液体系内部生成了少量胶原聚集体。相对而言,SSC(b-N1/2)与SSC(b-N1/6)的热变性峰可以分为两个区域:其一的峰值温度在32℃附近,与未改性胶原的热变性峰十分相似;其二的峰值温度在50℃左右,且形状不规则。SSC(b-N1)和SSC(b-G1)的热变性峰在整体上呈现为跨度很大的多重吸热峰,但在32℃附近没有单独的吸热峰。
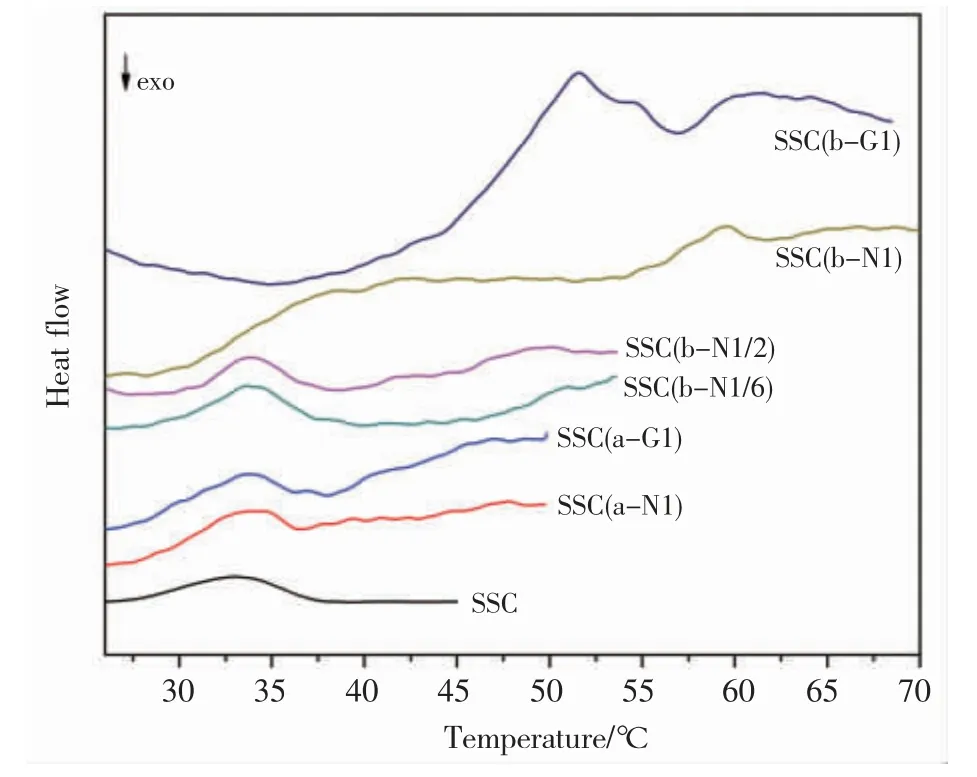
图8 不同交联改性条件处理黑鱼胶原溶液(5 mg/mL)的DSC曲线Fig.8 DSC curves of the snakehead skin collagen(SSC)solutions crosslinked by different conditions
综合上述电泳和DSC分析结果可知,交联改性鱼胶原的电泳图谱与其DSC吸热峰有所关联,即随着交联程度不断增加,改性胶原样品的热效应从以单一吸热峰为特征的胶原分子热变性,逐渐转变为以多重吸热峰为特点的交联胶原聚集体热变性,这与文献报道[25]牛皮胶原的交联改性结果一致。
3 结论
相同浓度的黑鱼胶原与牛皮胶原溶液的流变行为和热稳定性存在较大差别,黑鱼胶原的分子缠结程度更低、结构稳定性更差。在确保胶原不变性的前提下,通过改变温度能够有效调节黑鱼胶原的动态粘弹性与成纤维性能。尽管己二酸NHS酯的反应活性比戊二醛弱,但其更好的生物相容性以及足够高的交联改性程度,使其有望用于提升胶原材料的综合性能,以此推动鱼胶原基生物材料的产业化应用。
