晚期上皮性卵巢癌、输卵管癌、原发性腹膜癌患者新辅助化疗后Ki-67表达与预后的相关性分析*
2021-04-28刘玥曦令狐华
刘玥曦,令狐华
重庆医科大学附属第一医院妇科,重庆 400016
卵巢癌病死率居妇科恶性肿瘤首位[1],其发病隐匿,大多数患者就诊时已存在盆腔和腹腔的广泛转移[2],而输卵管癌和原发性腹膜癌的临床特点及诊疗方式均与卵巢癌相似,故通常将其共同研究[3]。晚期卵巢癌的标准治疗方式为初始肿瘤细胞减灭术,术后辅以化疗[4],对于手术风险高或难以获得满意减瘤效果的患者,新辅助化疗后行间期肿瘤细胞减灭术具有与初始手术相似的疗效,且术后并发症发生率更低[5-6]。疾病分期、肿瘤组织学特点及手术结局是目前公认的与上皮性卵巢癌患者预后相关的重要影响因素[7-8],此外,Ki-67基因编码的肿瘤增殖抗原作为一种增殖标志物,被认为是多种恶性肿瘤分类、治疗反应和预后预测的临床标志物[9-10]。近年来,越来越多试验致力于研究Ki-67在卵巢癌患者预后中的作用,但只有很少的研究报道了新辅助化疗后肿瘤组织Ki-67表达对卵巢癌患者预后的影响[9,11-13]。本研究通过回顾性分析本院新辅助化疗联合间期肿瘤细胞减灭术患者的临床病理资料,探讨Ki-67表达水平与晚期上皮性卵巢癌、输卵管癌及原发性腹膜癌患者临床病理特点及预后之间的关系,分析其评估接受新辅助化疗的患者预后情况的价值,以期为患者的个体化诊治提供参考。
1 资料与方法
1.1一般资料 选取2017年1月至2019年6月于本院就诊,并首次经探查手术或腹腔穿刺获得组织学或细胞学病理依据确诊为国际妇产科联合会(FIGO)Ⅲ/Ⅳ期恶性肿瘤患者,接受以紫杉醇联合铂类为基础化疗后完成间期肿瘤细胞减灭术,经术后病理学确诊为上皮性卵巢癌、输卵管癌或原发性腹膜癌,术后接受相同方案辅助化疗,并在初始治疗完成后通过门诊、住院或电话规律随访的患者作为研究对象。排除标准:(1)治疗过程中因个人因素放弃后续治疗,或因疾病进展未行间期肿瘤细胞减灭术;(2)术后病理检查提示为交界性或非上皮性肿瘤;(3)术后病理检查提示为其他部位来源恶性肿瘤;(4)病历资料不完善,缺乏研究所需的重要指标。共纳入132例患者作为研究对象。年龄29~73岁,中位年龄53岁;95例为FIGO分期Ⅲ期;随访时间4.0~39.3个月,中位随访时间15.0个月;91例患者在随访中出现复发,4例在随访过程中失访,失访率为3.0%。患者的临床病理资料见表1。本研究获得重庆医科大学生物医学伦理委员会批准(NO.2020-674)。
1.2方法
1.2.1治疗方法 自2017年1月起于本院首次经病理学确诊的上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,经2位及以上妇科主任医师综合评估后无初始手术机会,接受紫杉醇联合铂类为基础的新辅助化疗。具体给药方式:紫衫醇注射液175 mg/m2+顺铂90 mg/m2静脉滴注或紫衫醇注射液175 mg/m2+卡铂[剂量根据Calvet公式进行计算,其中曲线下面积(AUC)为5~6]静脉滴注,每周期的第1天给药,每21 d为1个周期。经临床医师综合评估,术前接受1~6个周期新辅助化疗。每周期新辅助化疗后,结合临床查体评估患者对化疗药物反应性及手术机会,有手术机会的患者在末次化疗后3~6周内接受间期肿瘤细胞减灭术。手术由工作10年以上或有妇科四级腹腔镜手术经验的妇科肿瘤医生参照美国国立综合癌症网络(NCCN)指南进行。术后予以原方案补充化疗至少3个周期,共化疗至少6个周期。初治结束后每2~4个月对患者进行随访,包括癌谱、胸部、腹部、盆腔影像学检查等,评估复发或转移情况。在最后一次随访时确认患者的存活及疾病进展情况,包括癌症进展或任何原因造成的死亡。

表1 患者的临床病理信息
1.2.2Ki-67检测方法 肿瘤细胞减灭术完成后采集标本,离体后30 min内采用甲醇固定,并送重庆医科大学临床病理部,HE染色后采用免疫组化S-P法检测Ki-67表达情况。根据美国临床肿瘤学会/美国病理学家学院(ASCO/CAP)指南,Ki-67定位于癌细胞核,阳性表达即细胞核有淡黄、棕黄或者棕褐色颗粒,Ki-67评分定义为恶性细胞总数中阳性染色细胞的百分比。
1.2.3临床资料收集及相关定义 通过本院病历系统回顾性收集患者的年龄、确诊及首次治疗日期、确诊病理学依据、FIGO分期、新辅助化疗方案及周期、间期肿瘤细胞减灭术记录(手术方式、手术结局)、术后病检报告等资料。通过门诊、住院资料及电话随访患者生存情况。满意的肿瘤细胞减灭术:术后残瘤最大径≤1 cm。疾病进展定义为任何影像学上出现的新发病灶或血清CA125水平持续上升至超过正常上限2倍。无进展生存期定义为初次接受治疗到出现疾病进展或者发生任何原因的死亡之间的时间,若随访截止时患者仍未出现结局,则无进展生存期定义为首次治疗到最后一次随访的日期。
1.3统计学处理 采用SPSS24.0和R-4.0.3统计软件进行数据分析。偏态分布的计量资料采用M(P25,P75)表示,组间比较采用秩和检验。计数资料采用百分数表示,组间比较采用χ2检验或Fisher精确检验。绘制时间依赖的受试者工作特征曲线(ROC曲线),选取灵敏度和特异度相加最大时Ki-67值为判断患者预后的最佳临界值(cut-off值)。Kaplan-Meier法绘制生存曲线,对可能影响预后的临床病理因素进行单因素COX回归分析,有统计学意义的变量以及具有重要临床意义的变量(如分期、肿瘤分级等)进入多因素COX回归分析,得到与复发相关的独立危险因素。以P<0.05为差异有统计学意义。
2 结 果
2.1Ki-67界值确定 时间依赖的ROC曲线分析结果显示,判断患者预后情况的Ki-67 cut-off值为20%(n=132,AUC=0.657,灵敏度=58.33%,特异度=70.83%,P=0.005)。
2.2Ki67与患者病理特征的关系 根据cut-off值将患者分为Ki-67<20%组和Ki-67≥20%组,患者年龄、原发部位、分期、病理学类型及手术结局在两组中的分布差异无统计学意义(P>0.05)。而病理分级不同的患者肿瘤组织Ki-67水平差异有统计学意义(P=0.003)。Bonferroni法对检验水准进行校正后提示病理分级为3级的Ki-67≥20%患者比例高于病理分级为1/2级患者,差异有统计学意义(P<0.05)。见表2。

表2 Ki-67与患者临床病理特征的关系[n(%)]
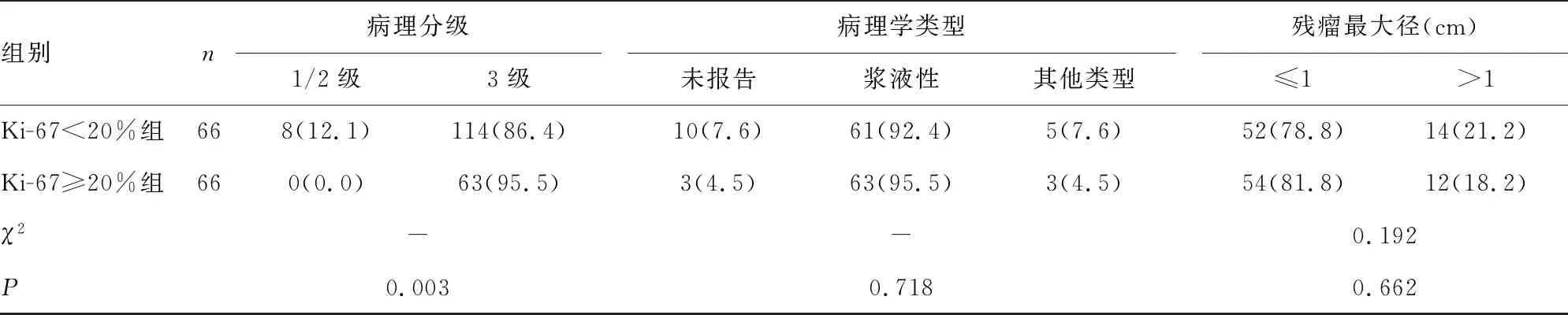
组别n病理分级1/2级3级病理学类型未报告浆液性其他类型残瘤最大径(cm)≤1>1Ki-67<20%组668(12.1)114(86.4)10(7.6)61(92.4)5(7.6)52(78.8)14(21.2)Ki-67≥20%组660(0.0)63(95.5)3(4.5)63(95.5)3(4.5)54(81.8)12(18.2)χ2--0.192P0.0030.7180.662
2.3Ki-67与患者预后之间的关系 Kaplan-Meier曲线,显示Ki-67≥20%组和Ki-67<20%组中位无进展生存期分别为13.5个月和22.0个月。单因素COX分析显示,两组患者的无进展生存期比较,差异有统计学意义(P=0.002),且化疗后Ki-67≥20%组无进展生存期较短。见图1。此外,对患者其余临床病理因素进行单因素分析,结果显示原发部位、手术方式和手术结局与无进展生存期相关,见表3,进一步多因素COX回归分析提示,在排除分期、肿瘤分级、原发部位、手术方式及手术结局等因素后,Ki-67水平为患者无进展生存期的独立影响因素(P=0.004)。原发部位(P=0.006)和手术方式(P=0.012)也为影响患者预后的独立危险因素。见表4。

表3 临床病理因素与患者无进展生存关系的单因素回归分析

续表3 临床病理因素与患者无进展生存关系的单因素回归分析
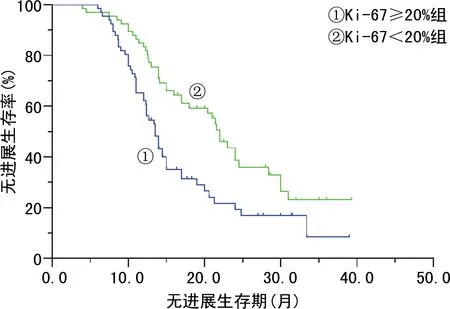
图1 新辅助化疗后不同Ki-67水平患者无进展生存期的Kaplan-Meier曲线分析

表4 临床病理因素与患者无进展生存关系的多因素COX回归分析
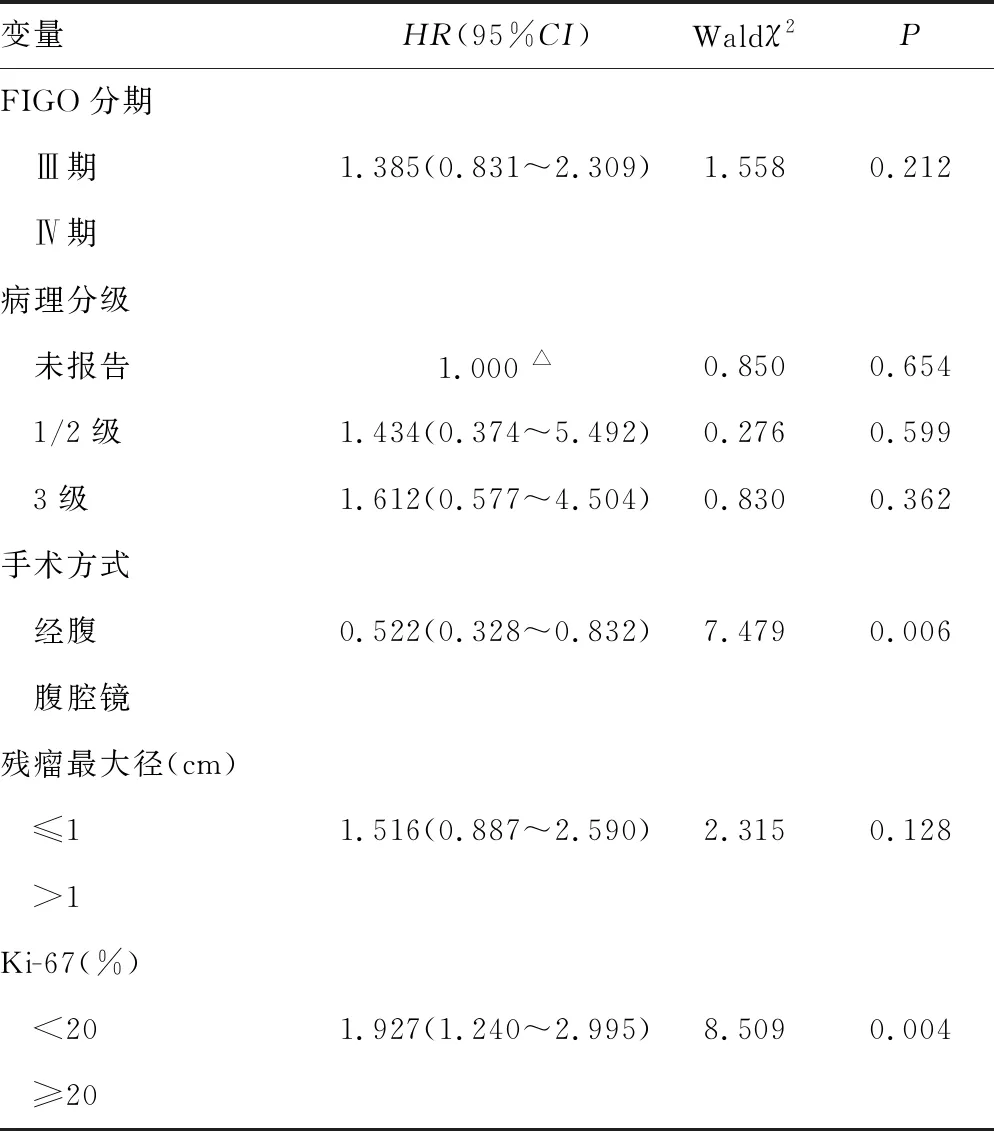
续表4 临床病理因素与患者无进展生存关系的多因素COX回归分析
3 讨 论
卵巢癌发病隐匿,大多数患者在就诊时已处于疾病晚期,预后差[14]。对于因合并症风险高,或评估初次减瘤可能不满意而不适宜立即手术的卵巢癌患者,新辅助化疗后行间期肿瘤细胞减灭术不仅同样有效[15],而且更为安全[16-21]。尽管大部分患者对初始治疗反应良好,但只有10%~30%的患者可获得长期生存,多数患者会在两年内出现复发[22]。因此,对复发危险因素进行研究对评估疾病预后具有重要意义。
Ki-67是一种核蛋白,表达于所有活跃的细胞周期阶段。Ki-67表达水平在G1期及S期早期较低,S期及G2期表达急剧增加,M期达到峰值,随后在细胞分裂后期和末期表达量迅速下降,且Ki-67半衰期短,细胞脱离增殖周期后迅速降解。上述特点使Ki-67成为良好的细胞增殖标志物,针对肿瘤组织Ki-67进行免疫组织化学检测是一项简单可行的辅助检查,可以增加重要的预后价值,目前广泛应用于评估肿瘤的恶性程度及其治疗及预后效果的判断[23]。
然而,有研究表明高水平Ki-67与患者不良预后相关[11],也有研究提示Ki-67升高的患者预后更好[12]。在不同研究中这些矛盾的结论阻碍了Ki-67表达在卵巢癌患者预后中的临床应用。有学者认为具有较高增殖能力的肿瘤预后往往也较差,然而,肿瘤的增殖指数越高,对大多数化疗药物的敏感性就越高[24]。此外,肿瘤的治疗是一个动态的过程,不同患者的肿瘤增殖水平及对化疗的敏感性等都可能在治疗过程中动态改变,这可能导致了不同试验结果的差异。VON MINCKWITZ等[25]进行的一项试验提示,相较使用于治疗前Ki-67水平或辅助化疗引起Ki-67水平变化对患者预后进行评估,Ki-67在化疗后的水平更能反映患者预后。
目前,部分研究报道了新辅助化疗后Ki-67水平对卵巢癌患者预后的影响,结果均提示化疗后高水平Ki-67与不良预后显著相关[26-27]。并且由于评估方法的差异,Ki-67临界值在不同试验中各不相同,本研究分析了新辅助化疗后Ki-67水平与患者临床病理因素及预后的关系,发现Ki-67≥20%组患者中肿瘤病理分级为3级者的比例明显较高,而患者年龄、原发部位、FIGO分期、病理学类型及残瘤最大径在不同Ki-67表达水平的两组患者中差异无统计学意义(P>0.05)。单因素分析显示,Ki-67≥20%的患者,其无进展生存期也短于Ki-67<20%患者(P=0.002)。此外,多因素COX回归分析进一步表明Ki-67水平是影响患者无进展生存期的独立影响因素(P=0.004),提示新辅助化疗后Ki-67≥20%与患者不良预后相关,可能倾向于早期复发。
同时,治疗后Ki-67水平高的患者提示当前的一线化疗方案抗肿瘤效应的有限性,针对这类患者,可以在术后采用个体化的治疗方案,如适度延长化疗疗程、调整化疗方案、加用靶向药物等,以期延长患者的疾病无进展生存时间及总生存时间。
本研究有以下局限性,首先本研究为单中心、回顾性研究,样本量相对较小,结果可能受混杂因素影响;其次,由于随访时间相对较短,难以评估总生存期是否存在差异;此外,Ki-67在整个肿瘤中的内源表达也分布不均,单一样本可能不能完全反映肿瘤的异质性[28]。本研究中Ki-67的表达是使用术后病理组织标本进行评估的,多部位取材并计算平均结果可能会减少这种差异。因此,Ki-67在卵巢癌患者预后中的预测价值尚需前瞻性随机对照试验进行验证。由于输卵管癌及原发性腹膜癌发病率明显低于卵巢癌,本研究中输卵管癌共14例,原发性腹膜癌共15例,在样本量限制下统计学意义有限,可在未来进一步扩大样本量的情况下针对输卵管癌及原发性腹膜癌患者中该指标的预后意义进行进一步研究。
