过敏性紫癜患儿血清骨桥蛋白、可溶性基质溶素-2、维生素A、维生素D检测的临床意义*
2021-04-28赵利平梁卫章刘秀珍徐宝元代宝春
赵利平,梁卫章,刘秀珍,姜 红,徐宝元,代宝春
河北省邯郸市中心医院儿科一病区,河北邯郸 056001
过敏性紫癜(HSP)是免疫介导的全身广泛性小血管炎、毛细血管炎症性变态反应性疾病,好发于学龄期儿童[1]。HSP发病机制仍未完全阐明,目前已知涉及免疫异常、炎症介质、细胞因子、凝血/纤溶机制异常等,其中免疫功能异常是公认的HSP发病机制之一[2],因此探讨与HSP发病以及免疫功能相关的分子机制有助于指导临床治疗。骨桥蛋白(OPN)是Th1型细胞因子,通过免疫细胞相互作用增加Th1介导的免疫反应,参与多种免疫因子介导的皮肤疾病[3]。可溶性基质溶素-2(sST2)是白细胞介素-33(IL-33)的诱骗受体,发挥免疫抑制作用[4]。维生素A(VitA)是一种具有促生长、繁殖,维持正常激素分泌的脂溶性维生素,VitA缺乏可导致抵抗力下降。25-羟维生素D3[25-(OH)D3]具有免疫调节功能,充足的VitA、25-(OH)D3有助于维持免疫系统稳定[5]。OPN、sST2、VitA、25-(OH)D3是否参与HSP发病和免疫系统机制异常尚待探讨,本研究检测HSP患儿血清OPN、sST2、VitA、25-(OH)D3水平,探讨其与HSP患儿免疫功能和HSP发病的关系,现报道如下。
1 资料与方法
1.1一般资料 选择2018年1月至2019年10月本院儿科收治的83例HSP患儿(HSP组)为研究对象,其中男49例,女34例;年龄3~17岁,平均(9.24±1.35)岁;单纯性紫癜19例,腹型紫癜36例,关节型紫癜20例,肾型紫癜8例;病因:近1个月食物过敏史16例,药物过敏史19例,猫狗接触史20例,甲醛接触史17例,幽门螺杆菌感染11例。纳入标准:(1)符合中华医学会儿科学分会免疫学组推荐的HSP诊断标准[6];(2)近期无过敏性疾病发生;(3)住院治疗,入院前未接受免疫抑制剂、抗菌药物、维生素治疗。排除标准:(1)特发性血小板减少性紫癜;(2)再生障碍性贫血、骨髓增生异常综合征导致的继发性血小板减少;(3)服用药物、风湿免疫性疾病导致的继发性血小板减少。另选择同期本院儿科门诊接诊的50例体检健康儿童为对照组,其中男29例,女21例;年龄2~15岁,平均(9.35±1.51)岁。两组受试者性别、年龄比较差异均无统计学意义(P>0.05)。本研究获得本院伦理委员会批准,患儿监护人均知情同意并签署同意书。
1.2方法
1.2.1血液标本的采集 采集所有研究对象清晨空腹静脉血10 mL(HSP组于入院24 h内发病急性期采集,对照组体检时采集),分别注入促凝试管、干燥试管和抗凝试管。
1.2.2血清OPN、sST2、VitA、25-(OH)D3的检测 待促凝试管中的血液凝固后取上层液于离心管,置于TDZ4-WS低速自动平衡离心机(长沙湘智离心机仪器有限公司)4 ℃、3 000 r/min离心15 min(离心半径10 cm),取血清保存于-70 ℃低温冰箱(日本三洋电器股份有限公司),48 h内完成检测。酶联免疫吸附试验检测血清OPN、sST2水平,仪器为瑞士Hamilton FAME全自动酶联免疫分析仪,试剂盒购自美国R&D公司。采用高效液相色谱法检测血清VitA、25-(OH)D3水平,仪器为HPLC-MS/MS液相色谱串联质谱仪(美国Sigma公司)。
1.2.3免疫指标的检测 干燥试管中的血液标本置于TDZ4-WS低速自动平衡离心机(长沙湘智离心机仪器有限公司)中以4 ℃、3 000 r/min离心15 min(离心半径10 cm),取血清保存于-30 ℃低温冰箱。采用免疫透射比浊法检测静脉血清免疫球蛋白(Ig)A、IgG、IgM,补体C3、补体C4,试剂盒购自美国Epitope Diagnostics公司。抗凝试管中的血液标本经EDTA抗凝后稀释,4 ℃、3 000 r/min离心15 min(离心半径10 cm),采用磷酸盐缓冲液洗涤后,收集离心细胞制成外周血单个核细胞液(PBMC)悬液。调整PBMC悬液的密度至1×104个/毫升,采用FACS Calibur型流式细胞仪(美国BD公司)检测T淋巴细胞(CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞)水平。上述检测均在本院检验中心实验室检测,实验室符合《医学实验室质量和能力的专用要求》。
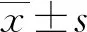
2 结 果
2.1两组血清OPN、sST2、VitA、25-(OH)D3水平、免疫功能指标比较 HSP组血清OPN、sST2水平高于对照组(P<0.05),VitA、25-(OH)D3水平低于对照组(P<0.05),HSP组补体C3、补体C4、IgA、CD4+T淋巴细胞水平低于对照组(P<0.05),两组IgG、IgM、CD3+T淋巴细胞、CD8+T淋巴细胞水平比较差异无统计学意义(P>0.05)。见表1。
表1 两组血清OPN、sST2、VitA、25-(OH)D3水平、免疫功能指标的比较
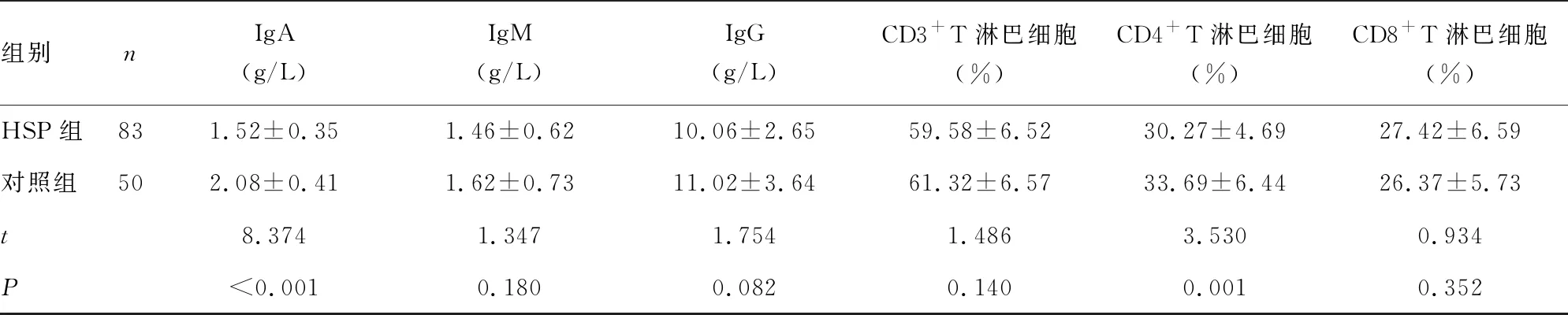
组别nIgA(g/L)IgM(g/L)IgG(g/L)CD3+T淋巴细胞(%)CD4+T淋巴细胞(%)CD8+T淋巴细胞(%)HSP组831.52±0.351.46±0.6210.06±2.6559.58±6.5230.27±4.6927.42±6.59对照组502.08±0.411.62±0.7311.02±3.6461.32±6.5733.69±6.4426.37±5.73t8.3741.3471.7541.4863.5300.934P<0.0010.1800.0820.1400.0010.352
2.2HSP患儿血清OPN、sST2、VitA、25-(OH)D3水平与免疫功能指标的相关性 HSP患儿血清OPN水平与CD4+T淋巴细胞水平呈负相关(P<0.05),sST2水平与CD4+T淋巴细胞水平呈负相关(P<0.05),VitA、25-(OH)D3水平与补体C3、补体C4、IgA、CD4+T淋巴细胞水平呈正相关(P<0.05),其他指标之间均无明显相关性(P>0.05),见表2。

表2 HSP患儿血清OPN、sST2、VitA、25-(OH)D3水平与免疫功能指标的相关性分析
2.3HSP发病的Logistic回归分析 建立HSP发病的多因素Logistic回归模型(因变量:1=HSP,0=无HSP),以患儿年龄、性别、食物过敏史、药物过敏史、猫狗接触史、甲醛接触史、幽门螺杆菌感染史、OPN、sST2、VitA、25-(OH)D3、补体C3、补体C4、IgA、IgG、IgM、CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞为自变量,单因素分析结果显示食物过敏史、药物过敏史、幽门螺杆菌感染史、OPN、sST2、VitA、25-(OH)D3、补体C3、补体C4、IgA、CD4+T淋巴细胞水平与HSP发病有关(P<0.05);多因素Logistic回归分析结果显示OPN、sST2水平升高,CD4+T淋巴细胞、VitA、25-(OH)D3水平降低是HSP发病的危险因素(P<0.05),见表3。

表3 HSP发病的单因素和多因素Logistic回归分析

续表3 HSP发病的单因素和多因素Logistic回归分析
3 讨 论
HSP是儿童常见的血管炎性疾病,以出血性皮疹为首发症状,部分伴腹痛、关节炎、血尿等临床表现,以免疫沉积、补体因子、中性粒细胞浸润,伴有血管炎症为病理特征。HSP病因尚不清楚,可能的诱因有感染、食物/花粉过敏、药物、蚊虫叮咬等[7],免疫系统功能异常是HSP发病的主要机制之一,研究与HSP免疫机制有关的细胞因子将有助于明确HSP发病机制,指导临床治疗。
辅助性T淋巴细胞亚群Th1/Th2失衡导致的免疫异常在HSP发病机制中发挥重要的作用[8]。OPN是一种Th1型促炎细胞因子,可介导细胞与细胞、细胞与基质间的相互作用,参与骨质代谢、细胞迁移、炎症基因调控,调节T、B淋巴细胞分化等。OPN通过影响Th细胞分化导致Th1/Th2失衡,在Th1介导的免疫反应中扮演重要角色,参与多种自身免疫性疾病的发病过程[9]。本研究发现HSP患儿血清中OPN水平显著高于对照组,提示OPN很可能参与HSP的发生发展,可能机制为OPN上调Th1细胞,促进Th1细胞因子表达,抑制Th2细胞因子表达,导致Th1/Th2免疫应答向Th1偏移,引起免疫应答紊乱,诱导肿瘤细胞坏死因子、IL-12、干扰素-γ等大量炎症细胞因子增加,介导血管炎性反应[10]。OPN通过增加氧化应激产物生成和氧自由基的氧化活性,消耗抗氧化酶,过度激活氧化应激反应,加重内皮细胞损伤和血管炎症[11]。本研究相关性分析结果显示,OPN与CD4+T淋巴细胞呈负相关,提示OPN参与了HSP免疫功能紊乱。OPN可影响CD4+T淋巴细胞及T淋巴细胞亚群分化,造成淋巴细胞亚群紊乱,引起体内免疫应答紊乱,CD4+T淋巴细胞也可产生大量OPN,导致小血管炎症和毛细血管炎症的发生[12]。
ST2是IL-1受体家族成员,广泛表达于巨噬细胞、肥大细胞、Th2细胞、心肌细胞等,sST2是ST2的可溶性形式和重要亚型之一[13]。sST2无跨膜和细胞内结构,可释放至细胞外入血。IL-33是IL-1家族成员,是ST2特异性配体,sST2可抑制IL-33诱导的肥大细胞、淋巴细胞、嗜酸性粒细胞等产生Th2细胞因子和趋化因子,介导Th1型细胞过度活化。在病原体感染、损伤应激下,IL-33广泛释放和分泌,sST2作为IL-33诱饵受体,可竞争性地与IL-33结合,产生炎性反应和免疫应答[14]。本研究发现HSP组血清sST2水平高于对照组,提示sST2参与了HSP发病过程,可能的机制为sST2通过IL-33/ST2信号通路介导血管炎性反应,导致HSP发病,HSP发生血管炎性反应的同时刺激巨噬细胞、肥大细胞、淋巴细胞释放sST2,形成恶性循环[15]。ST2与CD4+T淋巴细胞水平呈负相关,说明ST2参与了HSP免疫机制失衡过程,ST2持续升高与HSP免疫系统功能紊乱有关,提示IL-33/ST2轴参与了体液免疫反应过程[16]。
HSP患者免疫功能降低,VitA、维生素D可增强机体抵抗力和免疫力,在免疫系统疾病中发挥重要作用[17-18]。VitA具有促生长及繁殖、抗氧化、抗炎、协调免疫因子、增加抵抗力等多种生物学作用,VitA缺乏可导致上皮组织黏液分泌细胞被角蛋白生成细胞代替,破坏呼吸道、消化道、泌尿系统、上皮组织天然抗感染的屏障功能,降低免疫功能[18]。25-(OH)D3具有促使钙磷吸收、皮肤细胞生长、分化以及免疫调节等多种生物学效应,在钙内稳态调节、免疫细胞、细胞因子调控方面具有显著作用,25-(OH)D3缺乏可导致骨质软化、骨质疏松、佝偻病、哮喘、贫血、胰岛素抵抗等多种疾病[17]。本研究结果显示,HSP患儿VitA、25-(OH)D3水平显著降低,可能原因为患儿饮食摄入不足或光照不足,导致促进适应性免疫功能下降,诱导HSP发病。范丽等[19]在报道中指出HSP患儿25-(OH)D3水平越低,肾型HSP发病风险越高,住院时间越长。相关性分析显示,VitA、25-(OH)D3与补体C3、补体C4、IgA、CD4+T淋巴细胞水平呈正相关,说明VitA、25-(OH)D3具有协调免疫因子的作用。邹敏书等[20]发现补充25-(OH)D3可改善HSP患儿细胞和体液免疫功能,说明通过外源性补充25-(OH)D3可调节HSP免疫反应,提高机体抵抗力。
本研究回归分析结果显示OPN、sST2水平升高,CD4+T淋巴细胞、VitA、25-(OH)D3水平降低与HSP发病相关,说明过度免疫反应、免疫系统失衡导致的免疫功能紊乱是HSP发病的主要机制之一,OPN、sST2、CD4+T淋巴细胞、VitA、25-(OH)D3在HSP发病机制中扮演不同的角色,可能存在协同或抵抗作用,但具体机制目前尚不清楚。
综上所述,HSP患儿血清中OPN、ST2异常升高,VitA、25-(OH)D3缺乏可加重免疫功能紊乱,OPN、ST2水平升高,VitA、25-(OH)D3水平降低是HSP发病的危险因素,或可作为临床诊断HSP的辅助指标。
