第三代测序技术在遗传性耳聋基因拷贝数变异检测的临床应用
2021-04-25王秋权黄莎莎袁永一康东洋吴婕张昕戴朴
王秋权 黄莎莎 袁永一 康东洋 吴婕 张昕 戴朴
中国人民解放军总医院耳鼻咽喉头颈外科医学部,国家耳鼻咽喉疾病临床医学研究中心,聋病教育部重点实验室,聋病防治北京市重点实验室(北京 100853)
拷贝数变异(copy number variations,CNVs)广泛存在于人类基因组中,是遗传变异的重要来源。其遗传致病机制包括基因剂量效应、位置效应等多种分子机制[1-4]。已有研究表明,CNVs也是遗传性耳聋的一个重要原因,占所有非综合征性耳聋分子病因的五分之一[5-8],已成为遗传性耳聋分子诊断的主要检测内容之一。
过去研究人员提出的通过比较CNVs与标准参照基因之间相对值的检测技术,如多重链接探针扩增技术(Multiplex Ligation-dependent Probe Amplification,MLPA),染色体微阵列分析技术(Chromosomal Microarray Analysis,CMA),下一代测序技术(Next Generation Sequencing,NGS),尽管已经大幅提高了基因组的研究能力,但在分析CNVs等大片段结构性变异方面仍存在技术局限性。近年来出现的第三代测序技术(Third-Generation Sequencing,TGS)具有超长读长,快速,实时,高通量的优点,可以更直接有效准确地检测CNVs,确定CNVs片段长度等参考数据,精确定位CNVs位置,找到确切断点信息[9-11]。
本研究应用基于纳米孔(Nanopore)测序技术原理的TGS平台对1例耳聋伴有耳蜗分隔不全III型(Incomplete Partition type III,IP-III)的患者进行全基因组结构变异检测,发现并定位了一段位于Xq21.1(chrX:81079396-84457540)区 域 且 包 含POU3F4基因的半合子缺失变异,明确了该患儿遗传性耳聋的分子病因,为进一步遗传咨询及产前诊断提供了依据,现报告如下。
1 材料与方法
1.1 研究对象
先证者为一个3岁男童,父母听力正常,非近亲婚配,自然怀孕,足月生产,孕期正常。出生后双耳听力筛查未通过。其父母提供相关病史,家族史等信息,对其进行了相关临床评估,诊断性听力学检查,包括稳态听觉诱发电位(Auditory Steady State Potential Response,ASSR)、双侧畸变产物耳声发射(Distortion Product Otoacoustic Emission,DPOAE)、听性脑干反应阈值及潜伏期(Auditory Brainstem Response,ABR),及颞骨CT等。对患儿进行全外显子组测序后未检测到与临床表型相关的具有可能临床意义的变异,仅通过XHMM CNV软件预测到一段位于Xq21.1区域的半合子缺失变异,由于全外显子组测序的局限性及软件预测存在假阳性,并不能直接辅助临床诊断,因此我们对该患儿进行了TGS测序。该研究得到中国人民解放军总医院伦理委员会的批准(伦理编号:S2106-120-01)。
1.2 研究方法
1.2.1 基因组DNA提取及文库制备
签署知情同意书后,抽取先证者及父母外周血各2mL(EDTA抗凝),采用Genomic DNA提取试剂盒(Qiagen,Germany)并根据生产厂商提供的标准操作流程进行样品基因组DNA抽提,所得DNA使用NanoDrop One UV-Vis spectrophotometer(Thermo,USA)检测DNA纯度。样本质检合格后,使用BluePippin全自动核酸回收仪(Sage Science,USA)将大片段进行切胶回收,对DNA进行损伤修复,纯化后在DNA片段两端进行末端修复并进行加“A”反应,使用LSK109连接试剂盒(Oxford Nanopore Technologies,UK)中的接头进行连接反应,最后用Qubit 3.0 Fluorometer(Invitrogen,USA)对建好的DNA文库进行精确定量检测。
1.2.2 对先证者进行Nanopore测序
建库完成后将一定浓度和体积的DNA文库加入到1个Flow cell中,并将Flow cell转移到PromethION(Oxford Nanopore Technologies,UK)进行实时纳米孔单分子测序。
1.2.3 生物信息学分析
对Nanopore测序下机数据进行统计并进行过滤。对获取的数据用NGMLR-Sniffles流程进行结构变异检测。用ANNOVAR进行结构变异注释。应用1000 genome phase3、DGV gold standard CNV、dbVar nstd37和DESPICHER结构变异注释。根据疾病的表型调研OMIM、HPO和Clinvar等数据库,阅读相关文献,确定疾病相关基因。
1.2.4 结果验证
对患儿父母亲分别进行Sanger测序验证,验证CNVs的准确断点位置信息。
2.资源配置是改革发展的基石。供给侧改革就是对有限的资源配置进行优化,进而有高质量的产出,继续教育供给侧改革的资源配置首先要有制度的保障。现阶段,各地政府陆续出台了地方性的终身教育条例。在这些终身教育条例中,经费保障被写入条例中来。比如广东省的经费保障是常住人口每人每年不低于2元,上海市经费保障稍高些,达到了每人每年不低于5元的保障。有了必要的制度、经费、人员保障,继续教育项目的开发等要紧扣当地社会经济支柱产业的需求。比如,广东省将先进制造业等作为十大支柱产业,那么继续教育就要统筹好有限的资源,围绕这些支柱产业开发优质教育资源,为当地社会经济发展提供智力支持。
2 结果
2.1 临床结果
先证者ASSR显示双侧极重度感音神经性耳聋(图1a);双耳鼓室导抗图均为A型;双侧DPOAE在正常范围内均未引出;ABR阈值及潜伏期示双耳分别给与click声刺激,双耳在90dB(nHL)下见V波分化,均未见CM波分化。
颞骨CT显示双侧耳蜗顶转与中转融合,体积较小,蜗轴缺如,内听道与耳蜗相通,双侧内听道扩大,按照Sennaroglu分类[12],为 IP-III型,双侧前庭略扩大,双侧面神经管迷路段与鼓室段夹角增大(图 1b)。

图1 a.ASSR检查示示双侧极重度感音神经性耳聋;b.颞骨CT示双侧内耳畸形,蜗轴缺失并与内听道相通,为耳蜗分隔不全III型(IP-III)。Fig.1 a.ASSR examination showed bilateral severe sensorineural hearing loss;b.CT of the temporal bone showed bilateral inner ear malformation,cochlear axis missing and communicating with the internal auditory canal,which belonged to incomplete partition type III(IP-III).
2.2 基因检测结果
2.2.1 生物信息学分析
检测到先证者携带一段位于Xq21.1(chrX:81079396-84457540)区域的3.38Mb左右的半合子缺失变异,由于该变异缺失片段较长,无法同时得到正常DNA片段和发生变异DNA片段,故分别在缺失变异后的融合位点两侧(chrX:81078896-81079395,chrX:84457541-844578,图 2c中F-R引物)和断点两侧(chrX:84457254-84458046,图2c中f-r引物)设计引物扩增该家系样品后进行琼脂糖电泳实验。琼脂糖电泳显示患儿只扩增出突变型序列条带,其父亲只扩增出野生型序列条带,其受检者母亲既扩增出突变型序列条带也扩增出野生型序列条带(图2d)。一代验证结果表明该缺失变异来自于患儿母亲(图2e)。

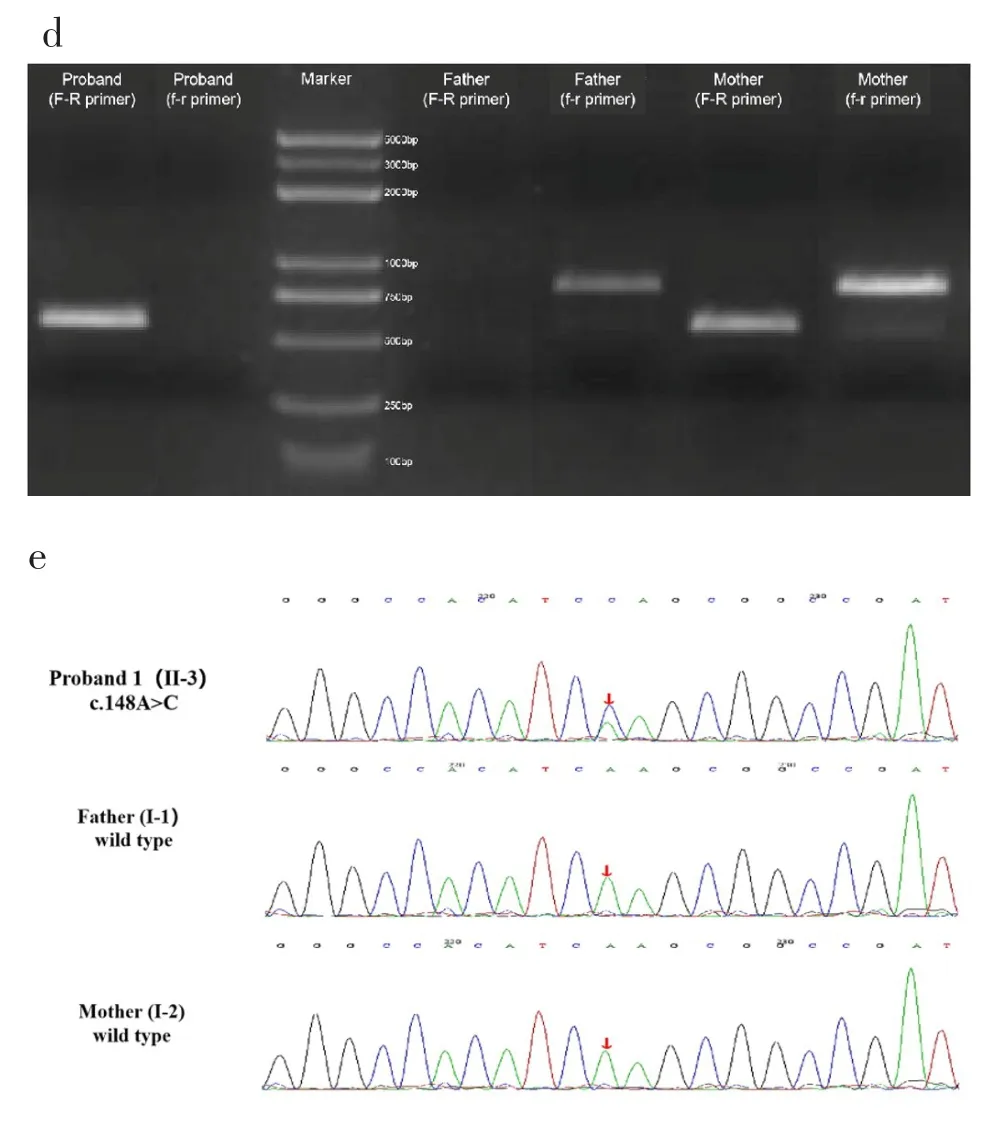
图2 a.家系图谱;b.Nanopore测序结果显示先证者携带一段位于Xq21.1(chrX:81079396-84457540)区域的3.38Mb左右缺失变异;c.缺失变异后的融合位点两侧和断点两侧设计引物;d.琼脂糖电泳显示受检者只扩增出突变型序列条带,其父亲只扩增出野生型序列条带,其母亲既扩增出突变型序列条带也扩增出野生型序列条带;e.Sanger测序验证结果表明该缺失变异来自于母亲。Fig.2 a.The pedigre;b.Nanopore sequencing results showed that the proband carry a 3.38 Mb deletion variant in theXq21.1(chrX:81079396-84457540);c.Primers were designed on both sides of fusion site and breakpoints after deletion of mutation;d.Agarose electrophoresis showed that the proband amplified only mutant sequence bands,father amplified only wild-type sequence bands,and mother amplified both mutant and wild-type sequence bands;e.Sanger sequencing validation results indicated that the deletion variant was derived from the mother.
2.2.2 致病性分析
该缺失变异覆盖了 APOOL、CYLC1、HDX、POU3F4、RPS6KA6、SATL1基因。除SATL1基因未被收录,APOOL、CYLC1、HDX、RPS6KA6基因在OMIM数据库中未收录相关疾病,因此排除上述基因致病性。此外,并未发现其他致病性单核苷酸变异。
该段缺失CNVs覆盖的POU3F4基因(OMIM:#300039)在OMIM数据库中明确记录为X-连锁耳聋2型(OMIM:#304400;DFNX2)的致病基因,该变异使POU3F4基因编码序列完全缺失,影响编码蛋白正常功能(PVS1)。通过查询DGV数据库和gnomADSVs数据库中均未见该变异的收录(PM2)。但在DESPICHER、ISCA及ClinVar数据库及相关文献中均有覆盖该变异区段或大部分重叠的缺失变异,并被定义为致病性或疑似致病性变异,相关临床表型均有听力障碍(PM3)。基于父母亲验证结果及以上证据,根据ACMG指南[13],判定该变异为致病性变异(PVS1+PM2+PM3),POU3F4基因为致病基因。
3 讨论
在多个耳聋患者中通过NGS等测序技术检出仅包含POU3F4基因全部序列的缺失变异,均位于本研究检测到的变异区间范围内,且本患者的临床特征与其中报道的耳聋男性患者表型一致[19-23]。该变异导致POU3F4基因序列全部丢失,使功能性POU3F4蛋白缺乏,从而破坏中耳和内耳结构的正常发育,导致听力障碍。
此外,也有多例Xq21区域的大片段缺失使POU3F4基因与相邻基因组成综合征型听力障碍的报道,具体表型取决于其CNVs大小和致病基因含量,主要为DFNX2、注意力缺陷、智力障碍和脉络膜出血等[24-28]。尽管本研究病例的缺失范围也覆盖其他基因,但该患者并未出现其他特殊的表型,且覆盖的其他基因目前并无明确的致病性证据,因此排除该患者为综合征型听力障碍。然而,并不能排除其他基因编码的蛋白质与已知致病基因可能存在相互作用,并产生与观察到的表型相关的功能变化,这需要我们进一步通过全基因组分析来鉴定。
POU3F4基因位于X染色体上的基因沙漠中,该区域并未覆盖有许多重要功能基因,且富含高度保守的非编码区,这可能导致POU3F4基因或相应区域较频繁发生CNVs[29]。而要阐明POU3F4基因CNVs发生的确切机制,需进一步对CNVs断点周围重复序列等分析,因此,断点的精确定位对探索POU3F4基因CNVs的发生机制并评估其功能影响至关重要。传统的检测方法对于CNVs断点的精确定位均有一定的局限性,需面对如断点所在区域富含复杂重复元件,高GC率或存在假基因、测序读长短,不能准确映射回正确基因组位置等问题[30,31]。本研究应用的Oxford Nanopor平台是一种基于纳米孔测序的第三代单分子基因测序技术。该技术不仅具有高通量特点,同时可以得到CNVs两端序列,即使断点出现在高度重复和复杂区域中,也可进行更精确的映射与基因组比较;而该技术的长读长测序,克服了传统检测技术短读长的诸多局限,使获得更大无间隙的全长基因组并对其进行结构序列分析成为可能[32,33]。
明确先证者CNVs致病性可对先证者母亲再次妊娠前准确的遗传咨询和产前诊断提供有力支持。本研究中先证者母亲再次妊娠,在孕19周通过采集羊水检查与超声检查对胎儿进行了产前诊断及性别鉴定,结果显示胎儿性别为女性,其携带该片段的杂合变异。对于X连锁隐性遗传疾病来说,单个致病性变异的女性携带者并不会发展为患者,只有当男性基因型为半合子,女性基因型为纯合子或携带复合杂合致病性变异(如反式)时才会导致耳聋的发生。因此,胎儿同其母亲一样均为该缺失变异的携带者,并不会重复其哥哥的表型。出生后经随访,该女婴听力正常。
4 结论
本研究通过TGS检测及Sanger测序验证的方法明确了一名伴有内耳畸形的遗传性耳聋患者的分子病因,并对先证者母亲再次妊娠胎儿进行了遗传咨询及产前诊断。本研究证明TGS用于遗传性耳聋基因中CNVs的临床应用是可行的,但仍面临着诸多问题,如单读长的错误率偏高,需重复测序以纠错;生物信息学分析软件不够丰富、数据积累少;价格成本高等,其有效性和准确度仍需大量数据的评估和验证。
