miR-190b通过PTEN/PI3K/AKT信号通路对肾母细胞瘤细胞SK-NEP-1增殖、迁移和凋亡的影响
2021-04-23张剑春刘俊启
张剑春, 陶 涛,刘俊启
1)驻马店市中心医院新生儿科 河南驻马店 463000 2)河南省人民医院妇产科 郑州 450003 3)河南省人民医院肿瘤科 郑州 450003
肾母细胞瘤又称肾胚肿瘤,是儿童最常见的恶性肿瘤,约占儿童所有实体瘤的8%[1]。尽管目前的研究[2]发现了一些关于肾母细胞瘤的相关基因,例如p53、WT1、WTX和CTNNB1,但肾母细胞瘤发生发展的分子机制仍不清楚。微小RNA(miRNA)是一种内源性RNA,长度为18~25个核苷酸[3]。研究[4]表明,miR-190b在多种肿瘤组织中异常表达。PTEN/PI3K/AKT信号通路是各种肿瘤生物学过程中的关键信号通路,靶向PTEN通路的分子已广泛用于肿瘤的治疗[5]。PTEN/PI3K/AKT轴构成了一条重要的途径,可控制多种生物信号传导过程,例如代谢、凋亡、细胞生长和细胞增殖[6]。然而,PTEN/PI3K/AKT信号通路对肾母细胞瘤发病机制和进展的影响仍然未知。本研究旨在探讨miR-190b对人肾母细胞瘤细胞SK-NEP-1增殖、迁移和凋亡的影响,为进一步阐明miR-190b在肾母细胞瘤中发挥的作用提供理论基础。
1 材料与方法
1.1主要材料组织标本:收集驻马店市中心医院2019年7~9月收治的20例肾母细胞瘤患者[男,8例,38~75(56.3±3.5)岁;女,12例,46~70(58.1±4.1)岁]的肿瘤组织、癌旁正常组织,保存在-80 ℃直至使用,患者均未在手术前进行化疗,并经术后病理确诊。患者均签署知情同意书,所有实验均获得本院伦理委员会的批准与监督。细胞:人肾母细胞瘤细胞系SK-NEP-1购自中国科学院上海细胞生物学研究所。主要试剂:DMEM培养基、胎牛血清购自美国Gibco公司;Trizol试剂、PrimeScriptTMRT Reagen试剂盒和SYBR®Premix EX TaqTMⅡ试剂盒购自日本TaKaRa公司;miR-对照(NC)、miR-190b模拟物、miR-190b抑制剂由Genepharma公司合成;Lipofectamine 3000购自美国Invitrogen公司;pmirGLO载体、双荧光素酶活性检测试剂盒和8 μm孔径的Transwell小室购自美国Promega公司;Annexin V-FITC/PI试剂盒、RIPA裂解液、BCA试剂盒购自美国Abcam公司;PTEN、PI3K、p-AKT、AKT、β-actin抗体和山羊抗兔IgG购自美国Cell Signaling Technology公司。
1.2细胞培养、分组与转染SK-NEP-1细胞用含体积分数10%胎牛血清的DMEM培养基于37 ℃、体积分数5% CO2培养,2 d更换一次培养基。取对数生长期SK-NEP-1细胞分为4组。空白对照组:不进行任何处理;miR-NC组:转染miR-NC质粒;miR-190b模拟物组:转染miR-190b模拟物质粒;miR-190b抑制剂组:转染miR-190b 抑制剂质粒。按照Lipofectamine 3000转染试剂说明书将100 nmol/L的miR-NC、miR-190b模拟物、miR-190b抑制剂分别转入SK-NEP-1细胞中,在37 ℃、体积分数5% CO2的培养箱中培养6 h后,更换新鲜的培养基继续培养。48 h后收集细胞进行后续实验。
1.3qRT-PCR测定组织标本或SK-NEP-1细胞中miR-190b的表达用Trizol试剂提取组织标本或细胞总RNA,检测总RNA的纯度和含量,使用PrimeScriptTMRT Reagen试剂盒将提取的RNA反转录为cDNA。miR-190b正向引物序列为5’-GGGT GATATGTTTGATAT-3’,反向引物序列为5’-CAGT GCGTGTCGTGGAGT-3’,产物大小214 bp;内参U6正向引物序列为5’-CTCGCTTCGGCAGCACA-3’,反向引物序列为5’-AACGCTTCACGAATTTGCGT-3’,产物大小227 bp。PCR反应条件:94 ℃预变性10 min,94 ℃变性15 s,57 ℃退火45 s,72 ℃延伸75 s,40个循环。采用2-ΔΔCt法计算miR-190b的相对表达量。细胞实验重复3次。
1.4免疫组化SP法测定组织中PTEN、PI3K、p-AKT蛋白的表达切取小块组织,固定、常规脱水、透明、浸蜡、石蜡包埋,并制成5 μm厚的石蜡切片。切片在抗原修复液(96~98 ℃)中放置15 min。将切片放入新鲜配制的体积分数3% H2O2溶液中8 min,使内源性过氧化物酶灭活。接着滴加体积分数10%山羊血清封闭液,室温孵育20 min后,用滤纸吸取多余液体。滴加PTEN、PI3K、p-AKT一抗(稀释度1∶500),4 ℃孵育过夜。之后滴加相应的二抗(稀释度1∶1 000),室温孵育2 h。DAB显色,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察并采集图像。目标蛋白呈棕黄色,则为阳性表达。高倍镜下计数500个细胞中的阳性细胞数,计算阳性细胞百分比。
1.5miR-190b与PTEN靶向关系的预测和鉴定通过TargetScan数据库分析miR-190b的靶基因。将PTEN 3’UTR野生型(WT)/突变型(MUT)克隆到pmirGLO载体中,然后将miR-NC或miR-190b模拟物与pmirGLO-PTEN-WT或pmirGLO-PTEN-MUT共转染至SK-NEP-1细胞中,48 h后应用双荧光素酶活性检测试剂盒测定细胞的荧光素酶活性。实验重复3次。
1.6细胞集落形成实验测定SK-NEP-1细胞的增殖能力各组细胞经处理48 h后,收集并接种到60 mm的培养皿中,2 d更换一次培养基。14 d后,用结晶紫染色,计数含有≥50个细胞的集落,并进行拍照。实验重复3次。
1.7SK-NEP-1细胞侵袭、迁移能力的测定细胞侵袭能力测定:采用Transwell侵袭实验。收集处理48 h后的各组细胞,消化后制成细胞悬液,调细胞密度为1×105个/mL。将Transwell小室之间用基质胶分隔,上室接种200 μL细胞悬液,下室加入600 μL完全培养基。然后将Transwell小室置于37 ℃、体积分数5% CO2细胞培养箱中孵育12 h。取出基质胶,用棉签擦去胶和顶室上的细胞,然后用40 g/L多聚甲醛固定并用结晶紫染色。200倍视野下选择5个区域计数入侵细胞的数量并取平均值。实验重复3次。
细胞迁移能力测定:采用Transwell迁移实验。方法同上,但不用基质胶。实验重复3次。
1.8SK-NEP-1细胞凋亡率的测定收集处理48 h后的各组细胞,离心并重悬于缓冲液中。将细胞依次用Annexin V溶液10 μL和PI溶液10 μL染色,室温下黑暗中孵育30 min,然后使用流式细胞仪测定凋亡率。实验重复3次。
1.9Western blot法检测SK-NEP-1细胞中PTEN、PI3K、AKT、p-AKT蛋白的表达处理48 h后的各组细胞用RIPA裂解,提取总蛋白,按照BCA法进行定量。蛋白样品经变性后上样,按照实验步骤进行电泳、转膜、封闭(50 g/L脱脂奶粉液)、一抗孵育[PTEN、AKT、p-AKT、兔抗β-actin(稀释度1∶2 000)或PI3K抗体(稀释度1∶1 000),4 ℃过夜]、二抗孵育[山羊抗兔IgG(稀释度1∶1 000),室温1 h]、显影曝光。采用Image-Pro Plus图像分析系统对蛋白条带进行灰度值测定,目的蛋白相对表达量为目的蛋白与内参条带灰度值的比值。实验重复3次。
1.10统计学处理采用SPSS 19.0进行数据分析。
肾母细胞瘤及癌旁正常组织中miR-190b相对表达量及PTEN、PI3K、p-AKT蛋白阳性细胞百分比的比较采用配对资料的t检验;两组双荧光素酶活性的比较采用两独立样本的t检验;不同组间SK-NEP-1细胞miR-190b相对表达量、集落形成数、迁移细胞数、侵袭细胞数、凋亡率,PTEN、PI3K蛋白相对表达量及p-AKT/AKT的比较均采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1两组组织中miR-190b表达的比较结果(表1)显示,肾母细胞瘤组织中miR-190b的相对表达量高于癌旁正常组织。
2.2两组组织中PTEN、PI3K、p-AKT蛋白表达的测定结果(图1和表1)显示,PTEN和PI3K主要在细胞质中表达,而p-AKT主要在细胞核中表达。肾母细胞瘤组织中PTEN的阳性细胞百分比低于癌旁正常组织,PI3K和p-AKT的阳性细胞百分比高于癌旁正常组织。
2.3miR-190b与PTEN靶向关系的预测和鉴定TargetScan预测miR-190b和PTEN之间的结合位点见图2。双荧光素酶报告实验结果(表2)显示,PTEN 3’UTR WT和miR-190b模拟物共转染的SK-NEP-1细胞中的荧光素酶活性降低。
2.4各组SK-NEP-1细胞中miR-190b相对表达量的比较结果(表3)显示,miR-190b模拟物组中miR-190b相对表达量高于空白对照组和miR-NC组,miR-190b抑制剂组中miR-190b相对表达量低于空白对照组和miR-NC组。
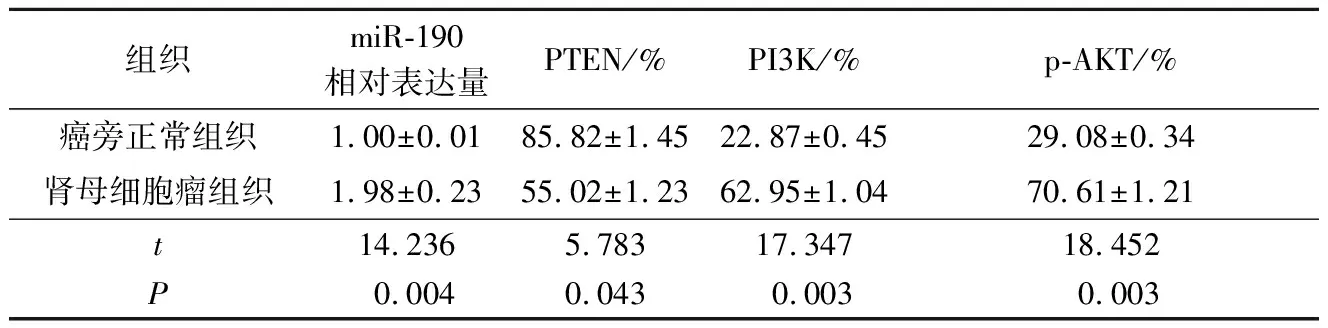
表1 两组组织中miR-190b相对表达量及PTEN、PI3K、p-AKT蛋白阳性细胞百分比的比较(n=20)
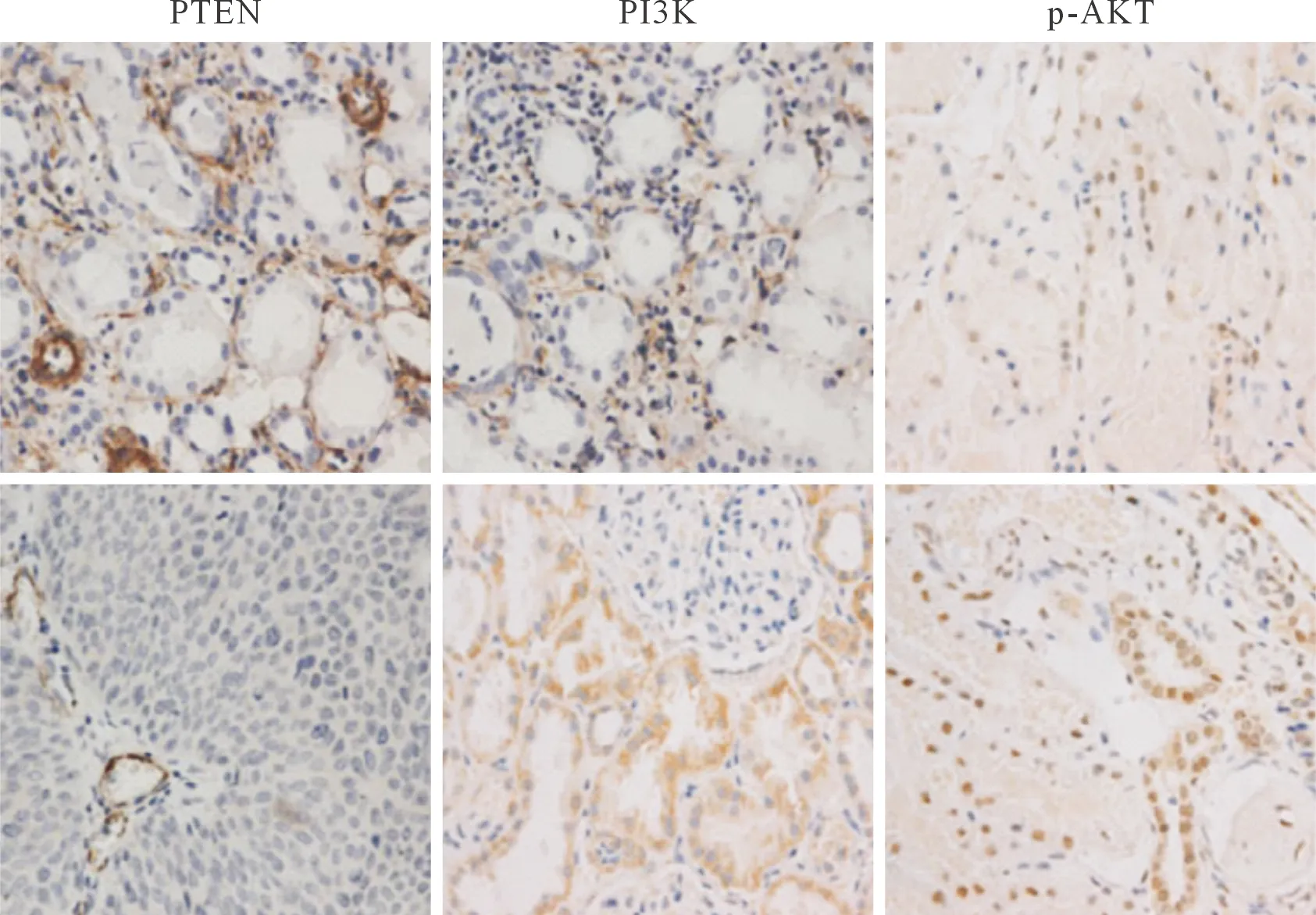
图1 癌旁正常(上排)及肾母细胞瘤(下排)组织中PTEN、PI3K、p-AKT蛋白表达的检测(SP,×200)
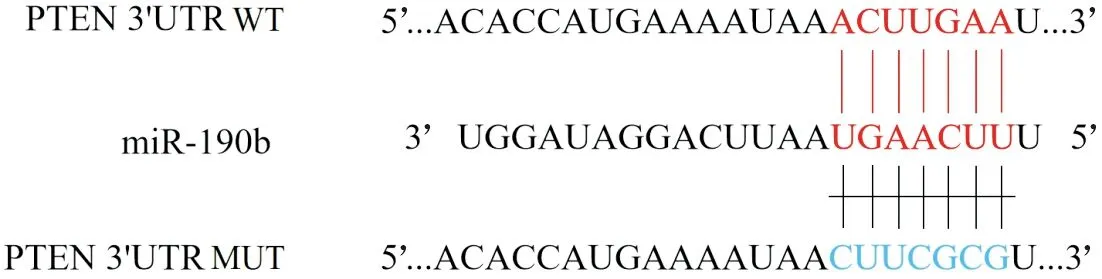
图2 miR-190b与PTEN之间的结合位点
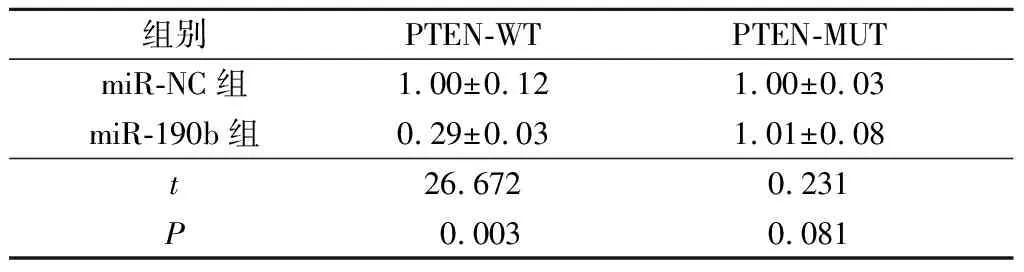
表2 双荧光素酶报告实验荧光素酶活性测定结果(n=3)

表3 各组SK-NEP-1细胞中miR-190b相对表达量的比较(n=3)
2.5各组SK-NEP-1细胞增殖、侵袭与迁移能力及凋亡率的比较细胞集落形成实验结果(图3和表4)显示,与空白对照组和miR-NC组相比,miR-190b模拟物组SK-NEP-1细胞增殖能力提高,miR-190b抑制剂组增殖能力下降。细胞侵袭、迁移实验及凋亡率检测结果(表4)显示,与空白对照组和miR-NC组相比,miR-190b模拟物组的迁移和侵袭能力提高,凋亡率下降;miR-190b抑制剂组的迁移和侵袭能力下降,凋亡率上升。
2.6各组SK-NEP-1细胞中PTEN、PI3K蛋白相对表达量及p-AKT/AKT的比较Western blot结果(图4和表5)表明,与空白对照组和miR-NC组相比,miR-190b模拟物组中PTEN蛋白表达下调,而PI3K和p-AKT/AKT上调;miR-190b抑制剂组PTEN蛋白表达上调,PI3K和p-AKT/AKT下调。
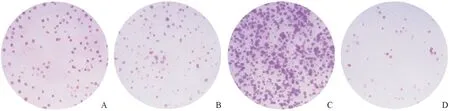
A:空白对照组;B:miR-NC组;C:miR-190b模拟物组;D:miR-190b抑制剂组
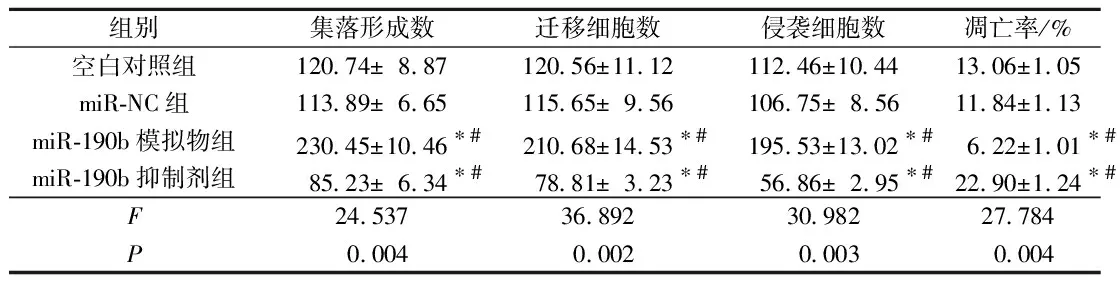
表4 各组SK-NEP-1细胞集落形成数、迁移细胞数、侵袭细胞数、凋亡率的比较(n=3)
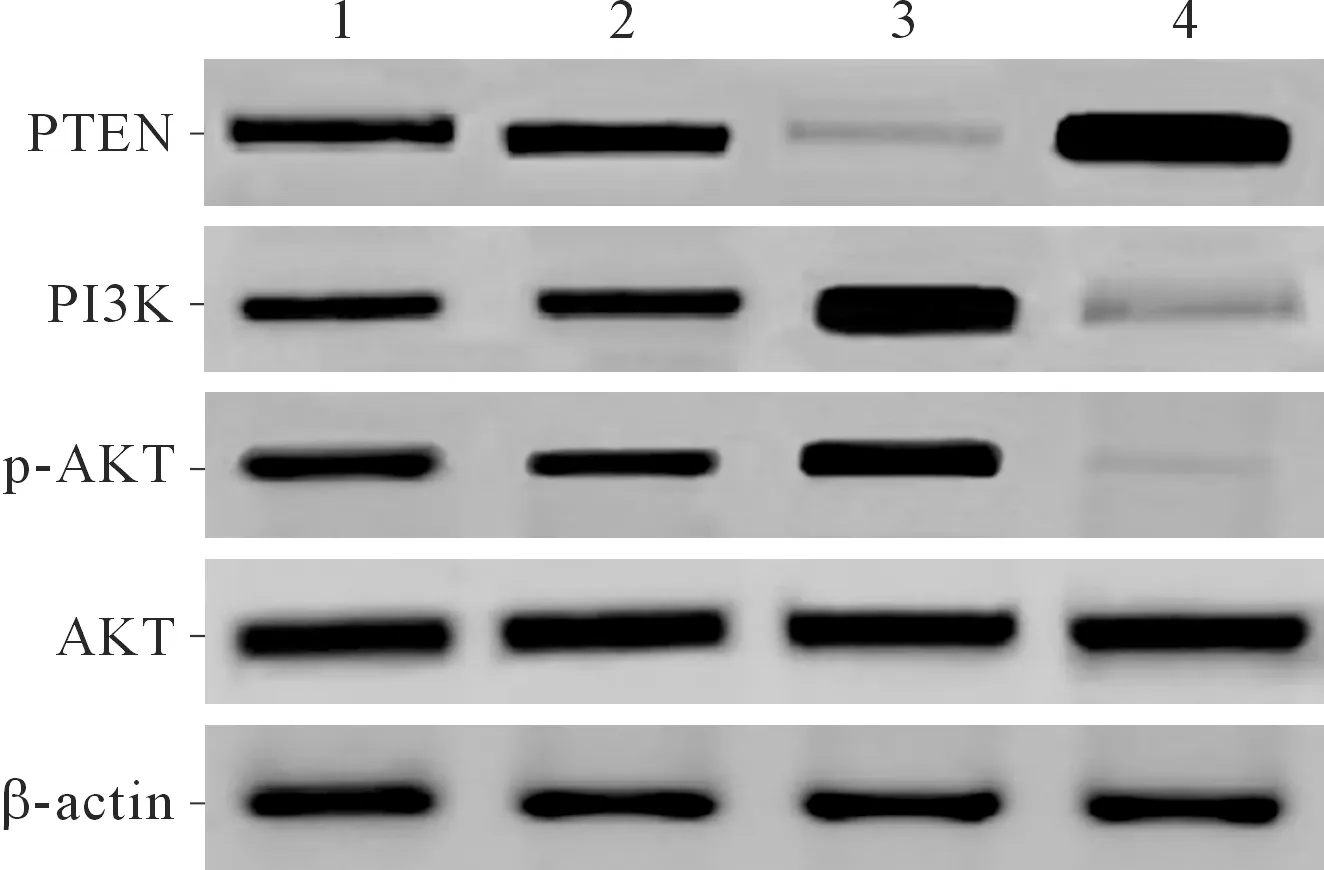
1:空白对照组;2:miR-NC组;3:miR-190b模拟物组;4:miR-190b抑制剂组

表5 各组SK-NEP-1细胞中PTEN、PI3K蛋白相对表达量及p-AKT/AKT的比较(n=3)
3 讨论
肾母细胞瘤是一种好发于儿童的胚胎性恶性肿瘤,是小儿外科手术中最常见的恶性实体瘤。尽管其诊断和治疗的技术手段已迅速发展,但现有方法仅适用于具有一定肿瘤体积的患儿。随着生物学标记的发现,miRNA被鉴定为多种癌症的调节剂和标记物[7]。miRNA是一种非编码RNA,可以与目标基因的3’UTR特异性结合,从而导致目标蛋白表达水平的降低。miRNA可以作为几种癌症的诊断和预后生物标志物,也可以作为肿瘤生物学治疗的潜在靶标[8]。已知,miR-140-5p通过直接靶向TGFBR1基因来缓解肾母细胞瘤的侵袭性发展[9];miR-613通过靶向FRS2减弱肾母细胞瘤的增殖、迁移和侵袭[10]。miR-192、miR-194、miR-215、miR-200c和miR-141通过靶向WT9-14中的特定癌基因来抑制肿瘤的生长和进展[11]。miR-190b已被证实是一种致癌基因,可在多种癌症中促进肿瘤的发生和发展。在人类肝细胞癌中,miR-190b通过IGF-1诱导胰岛素抵抗[12]。本研究发现,在肾母细胞瘤组织中miR-190b高表达,与上述文献报道一致;且过表达miR-190b可促进肾母细胞瘤细胞的增殖、迁移、侵袭能力,抑制细胞凋亡;敲低miR-190b表达可抑制肾母细胞瘤细胞的增殖、迁移、侵袭能力,促进细胞凋亡。因此,miR-190b可能调控肾母细胞瘤细胞的生物学行为。
研究[13]表明,PTEN/PI3K/AKT信号通路与恶性细胞的生长、增殖、迁移和侵袭密切相关。PTEN为抑癌基因,且是miR-190b的靶标,miR-190b可能通过负调控PTEN在神经胶质瘤的发生中发挥致癌作用[14]。而且PTEN/PI3K/AKT途径被认为是肝癌侵袭和转移的诊断和预后指标以及肝细胞癌的治疗靶标[15]。在本实验中我们发现,PTEN是miR-190b的靶基因,且miR-190b负调控PTEN的表达,促进肾母细胞瘤的增殖。
综上所述,miR-190b通过调节PTEN/PI3K/AKT信号通路来促进肾母细胞瘤细胞的增殖、迁移、侵袭能力,抑制其凋亡。