基于PI3K/AKT/mTOR信号通路的胶质母细胞瘤复发标记物的筛选
2021-04-23潘起晨班允超
潘起晨,班允超,刘 源,王 刚
中国医科大学附属第一医院神经外科 沈阳110001
胶质母细胞瘤(glioblastoma multiforme, GBM)是最常见的脑内原发肿瘤类型[1]。即使积极治疗,GBM患者的预后仍较差,诊断后中位生存期仅为14~15个月,5 a生存率仅为5.3%,且易发生侵袭[2]。目前关于GBM患者不良预后的标记物包括在microRNA和外泌体等不同水平上的多种标记物。microRNA-21(miR-21)和miR-10b对GBM具有良好的预后预测价值[3-4]。 Sox2是miR-21的重要靶标,对预后具有重要意义[5]。但针对GBM复发的标记物却很少见。本研究以GBM复发为结局,采用基因集富集分析(gene set enrichment analysis,GSEA)和基因集变异分析(gene set variation analysis,GSVA)两种分析方法同步验证了 PI3K/AKT/mTOR信号通路在GBM复发和未复发患者之间存在明显差异,然后在该通路中筛选了5个基因 (MAP2K3、MAP2K6、MAPK1、PTEN和RAC1),建立了包含这5个基因mRNA表达水平的GBM复发风险评分模型,并对该模型对GBM复发的预测价值进行了评估。
1 资料与方法
1.1病例信息来源从癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库中提取149例GBM患者的相关数据集。149例中,复发85例,无复发64例。
1.2目标mRNA的获取从TCGA数据库中提取和整理GBM患者的mRNA表达谱数据,经log2(基因表达量)标准化处理后,进行GSEA和GSVA分析(http://www.broadinstitute.org/gsea/index.jsp),以检验水准α=0.05为标准,筛选出复发和无复发患者之间存在显著差异的细胞通路。
1.3GBM复发风险评分模型的建立及评价使用Cox回归分析,从差异表达的细胞通路中筛选出与总生存(overall survival,OS)相关的基因。利用筛选出的基因表达水平的线性组合并经Cox回归系数加权处理,构建GBM复发风险评分模型。风险评分=∑基因n表达水平×βn。使用Cox回归分析,以复发为终点事件,以风险评分为自变量,评估两者的关联性。所有统计分析均使用SPSS 18.0和GraphPad Prism8完成。
2 结果
2.1患者基本信息149例GBM患者中,男96例(64.4%),女53例(35.6%);年龄≥60岁79例(53.0%),<60岁70例(47.0%);亚型分布:经典型37例(24.8%),间质型49例(32.9%),神经元型26例(17.4%),原神经细胞型37例(24.8%)。治疗资料完整124例,其中接受放疗41例(33.1%),化疗107例(86.3%)。IDH基因突变检测147例,其中8例(5.4%)阳性。MGMT甲基化检测119例,其中55例(46.2%)阳性。
2.2细胞通路的GSEA和GSVA筛选见图1。GSEA分析结果显示,8种细胞通路在复发和无复发组患者之间存在显著差异,且富集在复发组。GSVA分析结果显示,PI3K/AKT/mTOR信号通路在两组患者之间存在显著差异,未发现其他差异性通路。选定在两种分析方法中均存在明显差异的PI3K/AKT/mTOR信号通路作为目标通路进行下一步分析。
2.3与GBM的OS相关基因的筛选首先以149例为研究对象,以OS为终点事件,应用单因素Cox回归分析对PI3K/AKT/mTOR信号通路中的105个基因进行筛选,结果显示有12个基因与GBM的OS显著相关;然后经多因素Cox回归分析筛选出(α入=0.1)5个基因(表1),其中MAP2K6、MAPK1和PTEN为保护型基因,MAP2K3和RAC1为风险型基因。利用这5个基因的mRNA表达水平及其多因素回归的回归系数建立复发风险评分模型。风险评分=0.377 1×MAP2K3基因表达水平+(-0.269 0)×MAP2K6基因表达水平+(-0.488 7)×MAPK1基因表达水平+(-0.325 6) ×PTEN基因表达水平+0.794 5×RAC1基因表达水平。
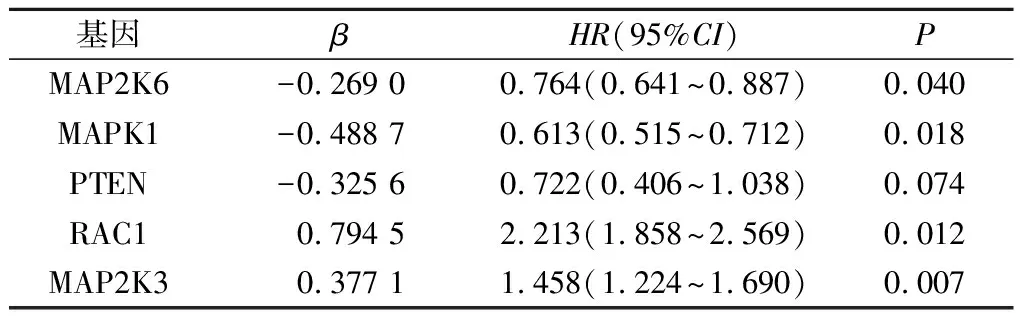
表1 多因素Cox回归分析结果
2.4风险评分的预后预测价值以复发为终点事件,以GBM患者的风险评分,年龄分段,是否放疗、化疗,IDH基因突变,MGMT甲基化状态,以及亚型为自变量,进行Cox回归分析,结果见表2。结果显示,风险评分对GBM的复发有预测价值。
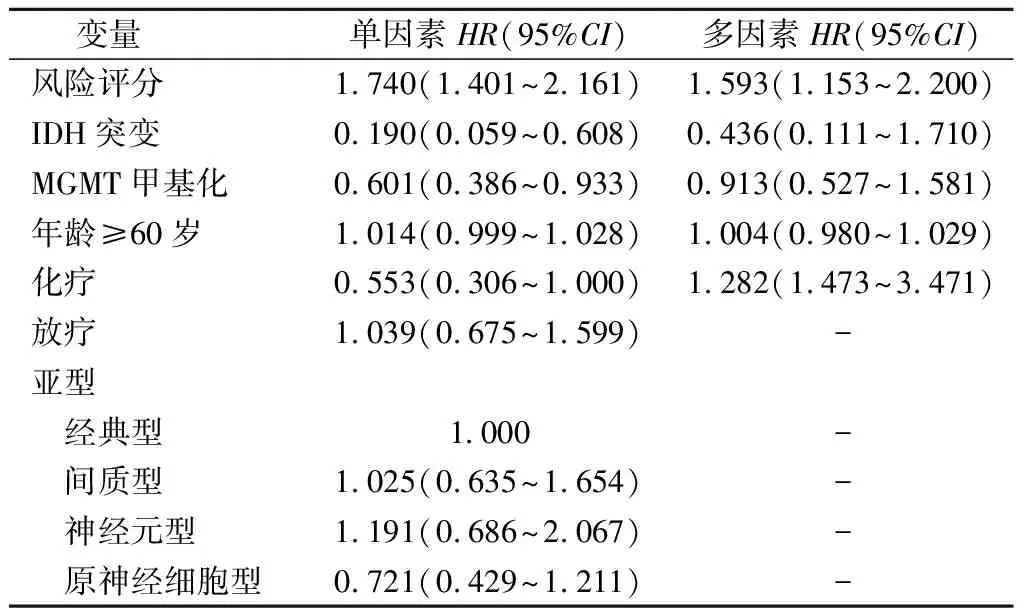
表2 GBM复发影响因素的Cox回归分析结果
2.5高风险与低风险患者差异通路富集分析对149例患者进行GBM复发风险评分,高于评分中位数为高风险,低于中位数为低风险。通过DAVID Bioinformatics Resources 6.8(https://david.ncifcrf.gov/)在线对两组患者进行差异通路富集分析。如图2所示,KEGG通路富集分析结果显示,共有12个细胞通路在两组患者之间存在差异。
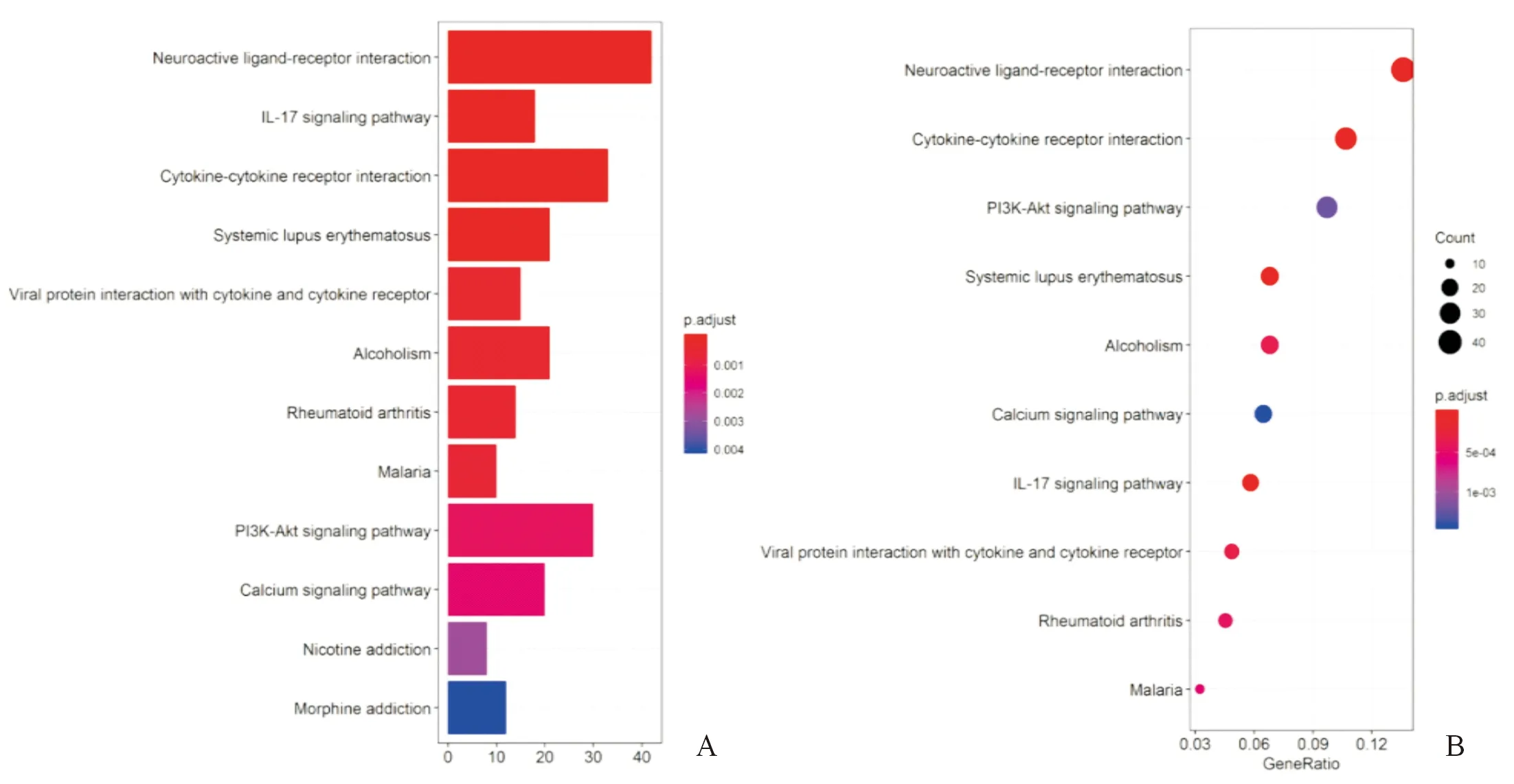
图2 高风险和低风险人群之间差异基因的功能和途径富集分析
3 讨论
GBM具有浸润性生长的特点,手术难以完全切除肿瘤,80%~90%的患者会在原发灶位置复发而导致预后极差[1]。GBM复发已是临床研究中需重点解决的问题。
本研究利用TCGA数据,以GBM是否复发将患者分为两组,采用GSEA和GSVA两种分析方法寻找差异表达的信号通路,筛选出PI3K/AKT/mTOR信号通路;然后应用单因素Cox回归分析从105个PI3K/AKT/mTOR信号通路中筛选出12个与GBM的OS显著相关的基因;再经多因素Cox回归分析筛选出MAP2K6、MAPK1、PTEN、MAP2K3和RAC1等5个基因。PI3K/AKT/mTOR信号通路与炎症反应关系密切[6-7]。多篇文献证实PI3K/AKT/mTOR信号通路与GBM的进展密切相关:有研究[5]提示上皮膜蛋白1通过PI3K/AKT/mTOR信号通路可促进GBM的进展。PI3K可能是GBM治疗的靶标,PI3K抑制剂可用于GBM的治疗[8-9]。这些为本研究选择该通路基因构建风险评分模型提供了理论基础。
本研究最终基于MAP2K6、MAPK1、PTEN、MAP2K3和RAC1构建了GBM复发风险评分模型。已有文献证实作为预测模型主体的5个基因与肿瘤的治疗存在一定联系。MAP2K3,丝裂原活化的蛋白激酶激酶3,已成为一种新的抗癌治疗靶点[10]。MAP2K6-FP可诱导肿瘤细胞自噬,从而增强卵巢癌细胞对紫杉醇的敏感性[11]。调节MAPK1表达可以抑制子宫颈癌细胞的增殖、迁移和侵袭能力[12]。PTEN为肿瘤抑制基因,其功能丧失与多种肿瘤的发生发展有关[12-15],其与GBM的DNA甲基化密切相关[16]。RAC1在胃腺癌上皮到间充质转化和癌症干细胞样细胞表型中起到重要作用[17]。本研究基于这5个基因建立了GBM复发风险评分模型,回归分析结果表明该风险评分是GBM的预后预测因子,其HR(95%CI)为1.593(1.153~2.200)。
虽然风险评分可以作为GBM复发的独立预测因素,但是由于本研究样本量和试验条件的限制,该模型的实用性仍需要扩大样本量进一步验证。这5个基因是否可以作为GBM治疗的靶点也需要通过实验来进一步验证。我们利用该模型将GBM患者分为高风险和低风险组,对两组进行差异通路富集分析,找到12条差异通路,这些通路将为未来的研究提供方向。