棉花类表皮特异性分泌糖蛋白基因GhA01EP1 的克隆和功能分析
2021-04-16李丹赵存鹏赵丽英刘旭刘素恩王凯辉王兆晓耿军义郭宝生
李丹,赵存鹏,赵丽英,2,刘旭,刘素恩,王凯辉,王兆晓,耿军义*,郭宝生*
(1.河北省农林科学院棉花研究所/ 农业部黄淮海半干旱区棉花生物学与遗传育种重点实验室/ 国家棉花改良中心河北分中心,石家 庄 050051;2.河北工程大学园林与生态工程学院,河北 邯郸 056038)
在长期进化过程中,植物应对不断变化的生物胁迫和非生物胁迫,发展出独特的、高度复杂的生物调控机制来精确地控制其生长发育,研究人员对此机制已进行了许多探索。 但是,与细胞内信号传导通路的组成和效应相比,植物分泌蛋白在植物胁迫反应中的作用还未引起足够重视[1]。分泌蛋白作为植物与外界信息、物质、能量交流和交换的重要载体,对植物生理活动的调控起着非常重要的作用,因此,对分泌蛋白的研究有助于完善对植物抵抗环境胁迫调节机制的认识。
分泌蛋白调控作用涉及一个关键的生物学系统——细胞分泌系统。 细胞分泌系统就是将细胞内产物释放进入细胞外空间。 细胞外空间通常指质膜以外的所有区域,其中的液体称为细胞外液[2],细胞外液由分泌蛋白、代谢产物、离子和许多其他物质组成。 分泌蛋白在细胞壁结构形成、细胞间相互作用、细胞外/细胞内信号传递、细胞对环境刺激的响应和病原体防御等方面具有重要的生物学功能,目前研究较多的是分泌蛋白在植物逆境适应中的作用[3-8]。
许多研究已证实,环境胁迫能够明显地影响分泌蛋白的质量和数量[9],盐[10]、低温[11]、水杨酸[12]、金属毒害[13]和病原菌入侵[14]等都对植物分泌蛋白质组具有较大影响。Song 等[15]比较了水稻盐处理和对照的分泌蛋白质组, 鉴定出37 种差异表达分泌蛋白, 它们主要参与碳水化合物代谢、氧化还原、蛋白质的加工和降解等。 对沙棘的分泌蛋白质组分析鉴定出61 种响应低温的蛋白, 其中34 个上调表达的蛋白质主要包括信号传导、氧化还原调节和防御相关蛋白[16]。李元宝[17]对棉花响应大丽轮枝菌侵染的质外体蛋白质组学进行了分析,共分离到49 个差异蛋白,这些差异蛋白参与活性氧代谢、防御反应、细胞壁修复、信号传导等多个生物学过程。 在质外体蛋白质组学研究不断深入的同时,抗逆相关质外体蛋白的功能研究也取得了一些进展。张磊[18]研究表明,质外体蛋白OsAPRLK1 在水稻抗盐反应中起着调控作用。 Wang 等[19]发现大豆细胞质外体定位BURP结构域蛋白GmRD22 的表达增强了植株对非生物胁迫的耐受性。 李元宝发现质外体蛋白GbNRX1 和GbCRR1 能够提高植物对病原菌的抗性[17]。小麦中定位于细胞质、细胞膜和质外体的TaXTH-7A 蛋白可以提高转基因拟南芥(Arabidopsis thaliana)的抗旱性[20]。 孙金月等[21]和简令成等[22]研究发现,在环境胁迫下,抗逆性强的品种细胞表面分泌的糖蛋白增多增厚,而敏感型品种细胞表面糖蛋白则会变少甚至脱落。 在盐胁迫下,逆境诱导转录因子DREB转基因小麦叶片的细胞表面糖蛋白层更致密,野生型植株叶片的细胞表面糖蛋白层出现细胞壁外缘脱落现象[23]。 这些研究表明:在逆境条件下,细胞分泌蛋白的增加对提高植株抗逆性具有重要作用。
本研究室前期测定了耐旱棉花品种冀2658根系干旱胁迫应答早期(胁迫后1 h)的蛋白质组(数据未发表),发现一个推测为类表皮特异性分泌糖蛋白EP1 的蛋白质(Access:1050567811)差异表达倍数较高。 通过参考基因组定位和序列比对,我们将编码此蛋白的基因命名为GhA01EP1,用实时定量聚合酶链式反应(Quantitative realtime PCR,qRT-PCR) 证实GhA01EP1在干旱胁迫后12 h 差异表达倍数最大。 为了研究GhA01EP1在干旱胁迫中的作用, 我们对该基因的结构、表达模式、功能等进行了初步分析,探究GhA01EP1的特性以及在植物抗旱中的作用,为进一步解析GhA01EP1的抗旱分子机制提供基础。
1 材料与方法
1.1 试验材料
试验材料为河北省农林科学院棉花研究所培育的品种冀2658,经中国农业科学院棉花研究所鉴定为耐旱品种。
1.2 GhA01EP1 基因的克隆
利用Seqhunter[24]软件将蛋白质对应的基因序列在陆地棉TM-1 基因组[25]中进行位置预测,然后提取该基因所在位置的核苷酸序列,用软件Premier 5 在开放阅读框 (Open reading frame,ORF)前后设计引物(正向引物:GGAATCCAATGTGCCTTTATTG;反向引物:CAAATACTTAATAGGGATTCCCG), 以冀2658 根部组织的cDNA 为模板克隆基因。
1.3 GhA01EP1 基因表达分析
将种子种植在灭菌的蛭石中,待子叶完全平展,将幼苗转移至水培箱,生长到二叶一心时,取植株的根、茎和叶片分析GhA01EP1组织特异性表达,每个组织取3 个生物学重复。
将长至二叶一心的植株用13%(质量分数)PEG6000 溶液处理(模拟干旱胁迫),取胁迫后0 h、0.25 h、0.50 h、1 h、3 h、6 h、12 h、24 h 的幼苗根部组织提取RNA 进行反转录, 利用qRT-PCR检测GhA01EP1在干旱胁迫前后表达量的变化,每个时间点取3 个生物学重复。
1.4 RNA 提取和qRT-PCR 检测
用BioFlux Plant Total RNA Extraction Kit(DNA-free)试剂盒(购自BioFlux)按照说明书制备总RNA。 第一链cDNA 合成和qRT-PCR 分别采用HiScript IIQ RT SuperMix for qPCR(+gDNA wiper)试剂盒(购自诺唯赞)和SuperReal PreMix Plus(SYBR-Green)(购自天根)进行。 在Biorad CFX96 实时荧光定量PCR 仪中进行qRT-PCR,以1 μL 合成的cDNA 为模板, 以棉花Actin1作为参考基因。 基因的相对表达量采用2-ΔΔCt法分析,设3 次技术重复。 利用Premier 5 软件设计基因特异性引物,GhA01EP1的正向引物ATTTACGGGTATTACAGCAGTCCA, 反向引物为TGAACATTTCCAATCAACTCCG; 内参基因Actin1正向引物为ATCCTCCGTCTTGACCTTG,反向引物为TGTCCGTCAGGCAACTCAT。
1.5 生物信息学分析
通过KEGG(http://www.genome.jp/kegg/)数据库分析GhA01EP1 可能参与的主要代谢途径。利用在线软件ExPASy-ProtParam(https://web.ex pasy.org/protparam/)对GhA01EP1 蛋白的理化性质进行分析;运用SignalP 5.0 Server(http://www.cbs.dtu.dk/services/SignalP)和TMHMM Server 2.0(http://www.cbs.dtu.dk/services/TMHMM)分别进行信号肽及跨膜结构预测; 利用PSI-predictor(http://bis.zju.edu.cn/psi/) 进行亚细胞定位预测;运用SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=np%20sa_sopma.html)和Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index) 分别进行GhA01EP1 蛋白二级结构和三维模型的预测;在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)分析GhA01EP1 蛋白结构,并利用Blastn(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM = blastn&PAGE _ TYPE = BlastSearch&LINK_LOC=blasthome 对GhA01EP1基因的同源序列进行聚类分析。
1.6 亚细胞定位
本试验所用载体为pCAMBIA2300-GFP,经SacI 和XbaI 双酶切后,回收大片段,与目的基因连接转化。 采用农杆菌转化法将构建好的过表达载体CaMV 35S∷GhA01EP1-GFP 转化农杆菌菌株GV3101。按照烟草瞬时转化方法,将合适浓度的农杆菌菌液注射进完整且厚的烟草叶片中,然后将烟草放在黑暗处过夜。一般注射后2~3 d 表达量最高,切取侵染区域,撕下表皮制片,用显微镜观察。
1.7 转基因拟南芥的获得和检测
利用农杆菌蘸花法进行拟南芥野生型(Col-0)转化,将灭菌的T0代转基因拟南芥种子置于含50 mg·L-1卡那霉素的MS 培养基平板上筛选,选取长势较好的植株转移至基质中,待长出7~8 片真叶时,以野生型拟南芥为阴性对照,取最底端叶片用于PCR 检测, 正向引物CCTTCGCAAGACCCTTCCTC,反向引物CCACCCCGGTGAACAGC。 然后用同样的方法筛选获得T2代和T3代阳性转基因拟南芥种子。
1.8 干旱胁迫下转基因拟南芥表型及根长测定
将Col-0 种子和T3代转基因纯系(共5 个株系:D1、D2、D4、D7、D8)种子(种子存放在4 ℃,不再春化处理)灭菌后种在MS 培养基上(22 ℃,16 h 光照/8 h 黑暗), 待子叶完全展开后将长势一致的幼苗分别转移至含有0 mmol·L-1、250 mmol·L-1、300 mmol·L-1D-甘露醇的MS培养基, 垂直放置于人工培养箱中培养,8 d 后观察并测定野生型和转基因拟南芥株系的根长。
1.9 干旱复水法鉴定转基因拟南芥的抗旱性
Col-0 和转基因拟南芥种子消毒后在MS 培养基上培养1 周,然后转移至土壤中,每个品系种24 棵植株,设3 个重复。 在人工培养箱中(条件同1.8)继续培养,待幼苗生长较健壮时,停止浇水,随时观察拟南芥生长状态;等幼苗出现严重干枯、萎蔫时,对植株进行复水并观察拟南芥生长状态。
2 结果与分析
2.1 GhA01EP1 的克隆与序列分析
利用同源克隆法从冀2658 中克隆得到GhA01EP1的ORF 序列, 序列全长1 371 bp,编码456 个氨基酸。GhA01EP1位于A01 号染色体上。 在NCBI 上对氨基酸序列进行结构分析,发现序列包含B-lectin、Plant PAN/APPLE-like 2 个结构域。
2.2 GhA01EP1 的表达分析
取植株的根、茎和叶片对GhA01EP1进行组织特异性表达分析,结果显示(图1),GhA01EP1在根、茎和叶片中均表达,且在根中表达量最高。为验证GhA01EP1与干旱胁迫的相关性,对干旱胁迫前后GhA01EP1在根部表达量的变化进行了分析,GhA01EP1的表达量在胁迫初期(胁迫后0.25 h 和0.50 h)呈下降趋势,但1 h 后明显上升,12 h 后达到峰值(图2),说明GhA01EP1响应干旱胁迫。
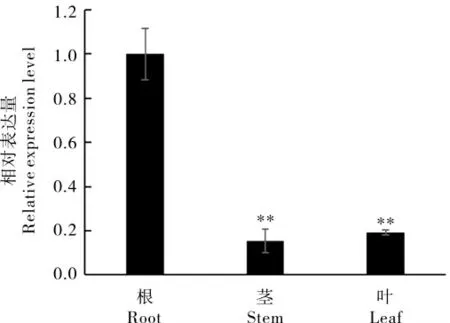
图1 GhA01EP1 的组织表达分析Fig. 1 The expression levels of GhA01EP1 in roots,stems, and leaves
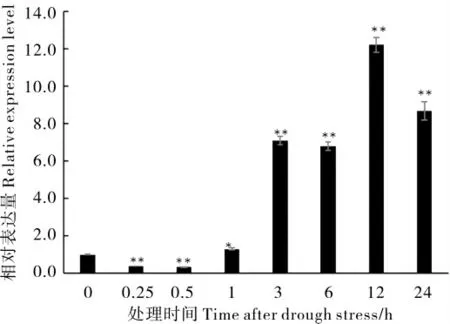
图2 GhA01EP1 在干旱胁迫下根部的表达变化Fig. 2 Expression pattern of GhA01EP1 under drought stress in root
2.3 GhA01EP1 的代谢通路分析
根据蛋白质组KEGG 通路分析发现,GhA01EP1在7 种代谢途径中上调表达, 包括甘氨酸、丝氨酸和苏氨酸代谢、苯丙氨酸代谢、异喹啉类生物碱的生物合成、β- 丙氨酸代谢、 莨菪烷类、哌啶、吡啶生物碱生物合成、酪氨酸代谢和mRNA 监视通路等,其中前两种代谢途径可信度较高。 在甘氨酸、 丝氨酸和苏氨酸代谢途径中,GhA01EP1参与合成甲基乙二醛(Methylglyoxal,MG)(附图1)。近几年的研究表明,高浓度的MG是一种细胞毒素,而低浓度的MG 作为一种信号分子,在植物遭受胁迫时含量迅速上升,可调节多种生理过程和抗逆性[26-29]。 苯丙氨酸代谢途径是植物生成木质素和芪类化合物等次级代谢产物的重要途径[30],木质素是细胞壁的重要组成部分,木质素填充于纤维素构架中增强植物的机械强度,利于输导组织的水分运输、抵抗不良外界环境的侵袭[31]。这表明,GhA01EP1可能通过以下2 种途径响应干旱胁迫: 一是通过合成积累MG响应胁迫信号,二是通过细胞壁增厚协助输导组织水分运输来抵抗干旱胁迫。
2.4 GhA01EP1 的生物信息学分析
利用ExPASy-ProtParam 分析得到GhA01EP1蛋白的分子式为C2257H3464N602O684S21; 分子质量为50 649.21 D;理论等电点为6.61;不稳定指数为37.20,为稳定性蛋白;总亲水性平均数为-0.235。GhA01EP1 蛋白包含456 个氨基酸, 其中亮氨酸占10.1%,丝氨酸占9.9%,苏氨酸占7.2%,甘氨酸占7.5%。
生物信息学分析显示,GhA01EP1 蛋白N 端存在信号肽的概率为68.7%, 信号肽剪切位点位于第42 个与第43 个氨基酸之间(附图2);预测不存在跨膜区域; 亚细胞定位预测结果为GhA01EP1 定位在细胞外的概率为75%(附图3)。
预测显示,GhA01EP1 蛋白质二级结构中α-螺旋占8.55%,延伸主链占32.02%,无规则卷曲占53.29%,β-折叠占6.14%。 三维模型预测结果见图3,模型的置信度达到100%,氨基酸序列的覆盖度达到83%,因此,可以认为该蛋白结构的预测是可靠的。
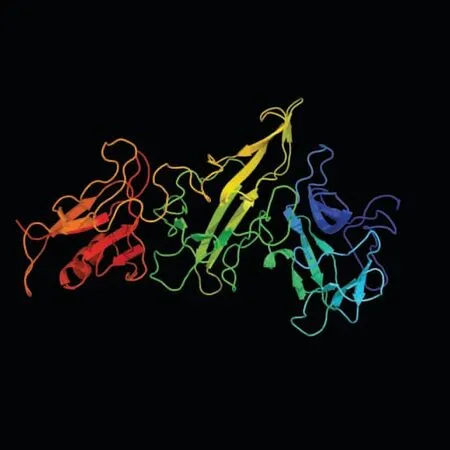
图3 GhA01EP1 蛋白三维模型Fig. 3 The 3D model of GhA01EP1 protein
2.5 GhA01EP1 同源蛋白比较和同源基因聚类分析
将GhA01EP1 蛋白序列在UniProt(https://www.uniprot.org/)网站进行检索比对,发现编号为A0A1U8KDH7 的序列和GhA01EP1 同源性最高, 只有1 个氨基酸差异 (图4)。 经分析,A0A1U8KDH7 为来自于墨西哥棉和陆地棉的Epidermis-specific secreted glycoprotein EP1-like,但A0A1U8KDH7 基因功能尚未被注释。此外,我们在NCBI 上进行Blastn 比对,选取相似度较高且来源于不同物种的序列进行了聚类分析 (图5),这些序列明显被分成了3 大类,来源于棉属的序列被分成同一类,木槿(Hibiscus syriacus)被单独分为一类, 榴莲 (Durio zibethinus)、 可可(Theobroma cacao) 和哥伦比亚锦葵(Herrania umbratica)被分为一类,这些物种都属于锦葵目。

图4 GhA01EP1 和A0A1U8KDH7 蛋白序列比对Fig. 4 Sequence alignment of GhA01EP1 and A0A1U8KDH7 protein
2.6 GhA01EP1 的亚细胞定位
对GhA01EP1 进行亚细胞定位分析, 对照35S∷GFP 的绿色荧光分布在整个细胞中; 在正常状态下(质壁分离前),GhA01EP1 与GFP 融合蛋白的荧光定位于细胞膜和/ 或细胞壁上,经质壁分离发现,GhA01EP1 与GFP 融合蛋白被分泌到胞外,定位于细胞壁和细胞膜之间(图6),这与在线预测结果一致。
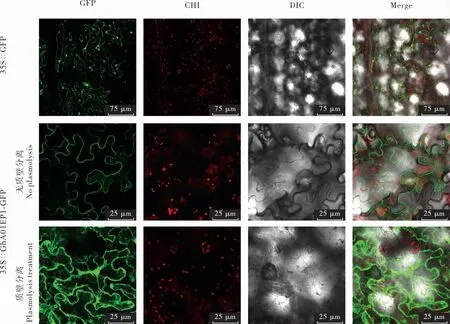
图6 GhA01EP1 的亚细胞定位Fig. 6 Subcellular localization of GhA01EP1 protein
2.8 干旱胁迫下转基因拟南芥抗旱性分析
用农杆菌蘸花法转化拟南芥, 经筛选获得5个T3代纯系(图7)。 对Col-0 和转基因拟南芥进行干旱处理,比较其抗旱性。 从图8 可以看出,在0 mmol·L-1D- 甘露醇处理下,Col-0 和转基因株系的根长没有明显差异; 在250 mmol·L-1和300 mmol·L-1D- 甘露醇MS 培养基中,Col-0 和转基因株系生长受到抑制,根系变短、叶片变小,而且随着浓度的增加抑制程度更强,但转基因株系比Col-0 植株根系长。 在250 mmol·L-1D- 甘露醇胁迫下,D4 和D7 株系与Col-0 根长呈极显著差异(图8E)。 在300 mmol·L-1D-甘露醇胁迫下,D1、D2 和D8 与Col-0 根长呈显著差异,D4和D7 株系与Col-0 根长呈极显著差异(图8F)。同时, 我们观察到300 mmol·L-1D- 甘露醇胁迫下Col-0 和转基因株系之间植株大小存在差异,于是我们将拟南芥根部切除,根部以上部分固定在干净的MS 培养基上(图8G),从图中可以看出,株系D1、D2 和D8 的植株明显比野生型拟南芥偏大,但D4 和D7 株系与野生型差异不明显,可能D4 和D7 株系中更多营养向根系供给。
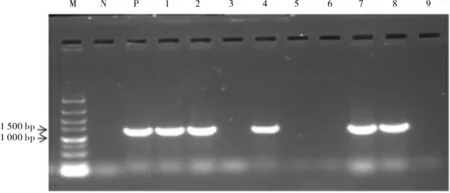
图7 拟南芥株系的PCR 检测结果Fig. 7 Identification of GhA01EP1 by PCR in transgenic A. thaliana
为了对转基因拟南芥株系进行抗旱鉴定,对正常生长条件下生长3 周左右的Col-0 和转基因拟南芥植株进行干旱处理, 停止浇水后30 d,几乎所有植株都受到胁迫影响,叶片发黄、干枯、萎蔫,但是转基因植株受影响程度较低(图8H)。 复水后5 d, 部分转基因植株可以恢复正常生长状态,存活率为33%~50%;而Col-0 植株的存活率只有16.7%。以上结果表明,GhA01EP1可以提高干旱胁迫下转基因拟南芥的抗旱性。
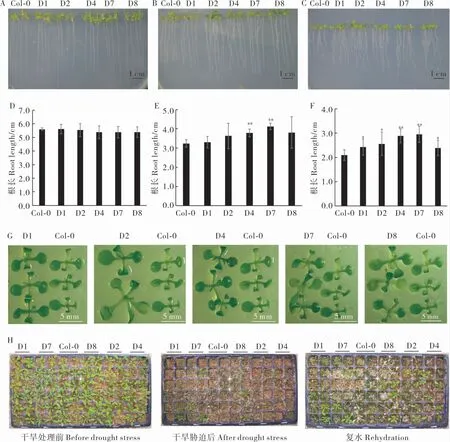
图8 转基因拟南芥抗旱性分析Fig. 8 Drought stress tolerance of transgenic Arabidopsis
3 讨论
植物质外体作为连接环境和植物原生质体的纽带, 在植物代谢和信号传递中具有多重功能[32]。 作为质外体的重要组成部分,分泌蛋白调控许多生理和生物学过程,如信号传导、细胞扩张、应激反应和细胞间相互作用等。 本研究发现GhA01EP1 蛋白被分泌到细胞膜和细胞壁之间,为分泌蛋白。 利用转GhA01EP1的拟南芥证实,GhA01EP1能够提高转基因植株的抗旱能力,与抗旱调控相关。
将GhA01EP1 蛋白在UniProt 进行blast 比对,共比对到250 条序列,只有2 条经过验证,分别是来自拟南芥(Arabidopsis thaliana)的类EP1糖蛋白3 (Entry:Q9ZVA4) 和类EP1 糖蛋白4(Entry:Q9ZVA5), 它们和GhA01EP1 的一致性分别是50.9%和51.3%。 类EP1 糖蛋白3 定位在细胞壁[33-34],可能参与细胞间程序性细胞死亡信号机制[35]。 类EP1 糖蛋白4 定位在细胞壁[34]和细胞外区域[36],GO(Gene Ontology)功能注释显示,此蛋白可以和糖结合。类EP1 糖蛋白3 和4 虽已证实定位在细胞壁上, 但其具体功能仍然未知。本研究中,KEGG 通路分析GhA01EP1 蛋白参与苯丙氨酸代谢,与木质素的合成有关,而木质素是细胞壁的重要组成部分,所以GhA01EP1 蛋白可能参与细胞壁合成,调节细胞壁代谢以适应干旱胁迫环境。
另外,GhA01EP1基因还调节甘氨酸、丝氨酸和苏氨酸的代谢,参与合成MG。 MG 被认为是一种细胞毒害剂[26,37-38],而近几年的研究显示,低浓度的MG 是植物响应环境胁迫的信号。乙二醛酶系统包括乙二醛酶Ⅰ(glyoxalaseⅠ,GlyⅠ)、乙二醛酶Ⅱ(glyoxalaseⅡ,GlyⅡ)及乙二醛酶Ⅲ(glyoxalase Ⅲ,GlyⅢ)[26-27],是植物保护机制之一。 乙二醛酶系统参与MG 的主要清除途径,不仅可直接清除过量的MG,还能通过增强抗氧化酶、抗氧化剂等抵抗MG 胁迫和由MG 引发的氧化胁迫[27,39-40]。 研究发现,外源MG 能提高NaCl 胁迫下小麦幼苗体内GlyⅠ和GlyⅡ的活性,减轻NaCl 对小麦的抑制作用。 同时,MG 可以提高小麦细胞中超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶和谷胱甘肽还原酶的活性,并提高谷胱甘肽和抗坏血酸水平, 降低NaCl 胁迫下超氧化物自由基、过氧化氢和丙二醛的含量[41]。 在玉米中,MG 可诱导玉米幼苗的耐热性, 抗氧化系统(抗氧化酶和非酶抗氧化剂)和乙二醛酶系统(GlyⅠ和GlyⅡ)在其中发挥重要作用[42]。
综上所述, 在棉花抵御干旱胁迫的过程中,GhA01EP1上调表达可能导致MG 合成增多,激活乙二醛酶系统和过氧化酶系统提高植株的抗旱性。棉属及其近缘种属中有关GhA01EP1功能的研究尚未见报道, 虽然本研究证实了GhA01EP1可以提高转基因拟南芥的抗旱能力,但其作用机理尚不明晰。 需要进一步验证内源MG 作为信号分子是通过激活乙醛酶系统和抗氧化系统调控植株适应性,还是通过苯丙氨酸代谢促进木质素合成、提高细胞壁厚度控制水分流动提高抗旱性。
4 结论
本研究通过陆地棉根部蛋白质组测序发现,一个被预测为类表皮特异性分泌糖蛋白EP1 的蛋白质在干旱胁迫下上调表达, 我们将控制其合成的基因命名为GhA01EP1。对过表达GhA01EP1的转基因拟南芥进行抗旱鉴定发现,转基因拟南芥相比Col-0 抗旱性增强, 胁迫复水后更容易恢复到正常生长状态,说明GhA01EP1对提高植物抗旱性起积极作用。
附图:
详见本刊网站(http://journal.cricaas.com.cn)本文网页版。
附图1 GhA01EP1 参与甘氨酸、丝氨酸和苏氨酸代谢
Fig. S1 GhA01EP1 is involved in glycine, serine and threonine metabolism
附图2 GhA01EP1 信号肽预测
Fig.S2 The prediction of signal peptide of GhA01EP1
附图3 GhA01EP1 亚细胞定位预测结果
Fig.S3 The prediction result of subcellular localization of GhA01EP1
