卵泡发育中晚期添加HMG可改善妊娠结局:基于682例高龄卵巢储备减退患者
2021-04-14吴晓敏陈映雪周星宇张笑菲陈士岭
吴晓敏,陈映雪,周星宇,张 俊,黎 莹,李 欣,张笑菲,陈士岭
南方医科大学南方医院妇产科生殖医学中心,广东 广州510515
在全球范围内,促性腺激素释放激素拮抗剂(GnRH-ant)方案已经成为辅助生殖治疗最常用的控制性促排卵方案之一,GnRH-ant方案疗程简化,治疗时间短,明显降低卵巢过度刺激综合征的风险[1],对垂体抑制程度减轻,停药后卵巢功能恢复迅速,因此被广泛地应用于高龄人群与卵巢储备减退(DOR)患者。
高龄DOR群体周期取消率高,妊娠率低[2],DOR是一个渐进性发展的过程,促卵泡刺激素(FSH)的升高早于黄体生成素(LH)的变化[3],导致基础FSH/LH的比值升高。已有研究表明,≥35岁的DOR患者,LH/FSH与卵母细胞数量正相关,加之使用GnRH-ant后内源性LH被抑制,预测卵巢反应性较差,提示可以考虑通过给予HMG,提高LH与FSH的比例,以降低刺激不良风险[4]。有证据显示GnRH-ant方案中添加HMG可以显著提高胚胎种植率和临床妊娠率[5],亦有相反的观点认为患者应用GnRH-ant后的内源性LH仍足以维持对卵泡发育的刺激作用,需要重新评估添加的必要性[6-7],目前对GnRH-ant方案中添加HMG的研究较少且结论各异,国内对于特定高龄DOR群体的应用缺乏文献报道,需要进一步探索。
本研究旨在分析应用GnRH-ant方案过程中,高龄DOR患者添加HMG是否受益以及HMG添加时机对妊娠结局的影响,以探求更好的用药方案,为提高高龄DOR群体临床促排卵治疗的有效性提供参考依据。
1 资料和方法
1.1 研究对象
回顾性分析2014年1月~2019年12月于本中心采用GnRH-ant方案行常规体外受精/卵胞浆单精子显微注射受精(IVF/ICSI)助孕的高龄DOR患者,纳入标准:年龄≥35岁,且满足以下2项标准中的任意一项:(1)双侧卵巢基础窦状卵泡数(AFC)≤5;(2)基础FSH≥10 U/L,和(或)基础FSH/LH>3.6。
1.2 促排卵方案及分组
所有患者均采用GnRH-ant方案,于月经周期第2-4天评估卵巢基础状态,给予FSH制剂(注射用重组人促卵泡素,默克雪兰诺;重组促卵泡素β注射液,默沙东;注射用尿促卵泡素,丽珠)150~300 U/d启动促排卵治疗,根据HMG(注射用尿促性素,丽珠)的添加时机,共分为3组。无添加组:不添加HMG,仅使用FSH至扳机日;早期添加组:Gn第1日开始每日添加HMG 75~150 U至扳机日;中晚期添加组:主导卵泡直径约10~14 mm时每日添加HMG 75~150 U至扳机日,同时减少相应FSH剂量。Gn使用第5或6日时皮下注射GnRH-ant 0.25 mg/d直至扳机日,当2~3个优势卵泡直径≥18 mm时给予HCG 5000~10 000 U或联合促性腺激素释放激素激动剂(GnRH-a)0.2 mg扳机,诱发排卵36~38 h后行经阴道超声引导下取卵术,取卵日开始黄体支持。
1.3 胚胎培养及孕期监测
根据男方精液质量及患者病情决定行IVF或ICSI,取卵后第3天或第5天行新鲜胚胎移植,若患者不适合鲜胚移植(因内膜因素、孕酮升高等)则行全胚冷冻。移植12 d后检测血β-绒毛膜促性腺激素水平,移植后4周通过超声观察到一个或多个孕囊及胎儿心管搏动确定为临床妊娠。优质胚胎标准为2PN来源、卵裂球数目7~8个且评分Ⅰ、Ⅱ级(Edwards标准)的D3胚胎[8]或评分≥3BB的囊胚(Gardner评分法)。
1.4 统计学分析
数据采用SPSS 22.0软件进行统计分析。计量资料用均数±标准差表示,采用单因素方差分析或Kruskal-Wallis检验;计数资料用率表示,采用χ2检验。P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 患者基础情况比较
本研究共纳入682例≥35岁的DOR患者,其中无添加组371例,早期添加HMG组139例,中晚期添加HMG组172例。3组患者女方年龄、不孕年限、体质量指数(BMI)、原发不孕比例、继发不孕比例、基础FSH、LH、E2、P、AFC、AMH差异均无统计学意义(P>0.05,表1)。

表1 患者基础情况比较Tab.1 Baseline characteristics of the patients
2.2 卵巢刺激情况和促排卵结局
3组扳机日LH、E2、P水平、扳机日子宫内膜厚度、扳机日直径≥14 mm、≥16 mm、≥18 mm的卵泡个数、受精率、卵裂率、优质胚胎数差异均无统计学意义(P>0.05);早期添加组、中晚期添加组Gn用量高于无添加组,中晚期添加组获卵数高于早期添加组,中晚期添加组成熟卵子数、可利用胚胎数均高于无添加组及早期添加组(P<0.05,表2)。

表2 卵巢刺激情况及促排卵结局Tab.2 Outcomes of controlled ovarian hyperstimulation in the patients
2.3 新鲜移植周期妊娠结局
3组间新鲜周期种植率、早期流产率、异位妊娠率、活产率比较均无统计学差异(P>0.05)。中晚期添加组临床妊娠率高于无添加组(P<0.05),但早期添加组与无添加组及中晚期添加组比较均无统计学差异(P>0.05,表3)。
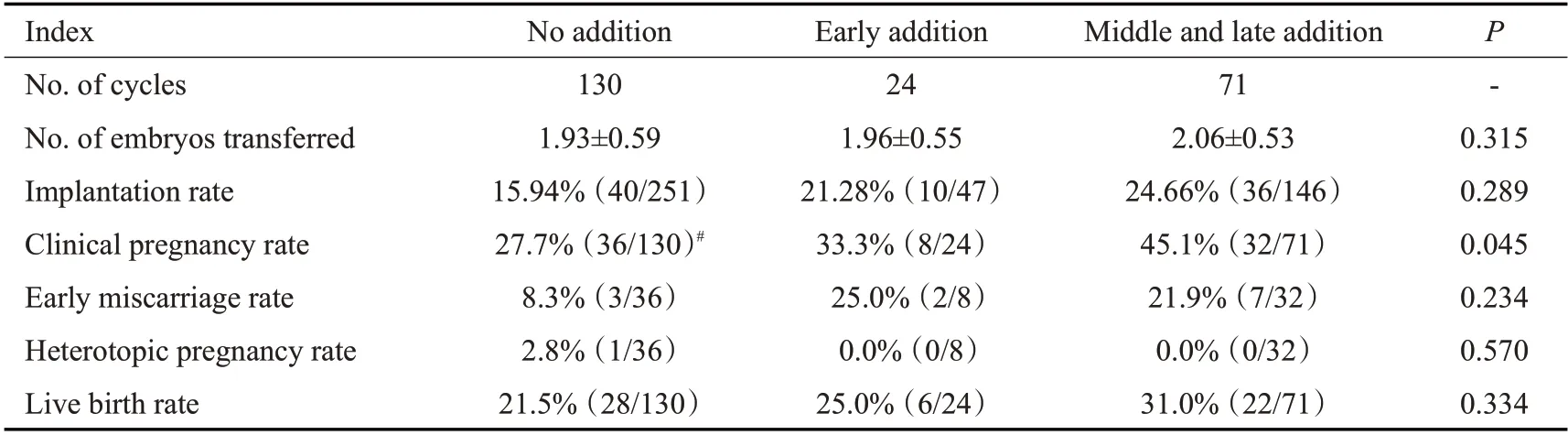
表3 新鲜移植周期妊娠结局Tab.3 Clinical outcomes of fresh embryo transfer cycle
2.4 全胚冷冻周期首次冻融胚胎移植(FET)妊娠结局
中晚期添加组临床妊娠率较早期与无添加组妊娠率稍高,但未达到统计学差异,3组间种植率、早期流产率、异位妊娠率、活产率比较均无显著性差异(P>0.05,表4)。
3 讨论
本研究资料显示,中晚期添加组的成熟卵子数、可用胚胎数、新鲜周期临床妊娠率明显升高,提示GnRHant方案中中晚期添加HMG能改善高龄DOR人群的促排卵结局和新鲜周期临床妊娠率。此外,无添加组扳机日的LH水平为4.52±5.18 IU/L,与早期和中晚期添加组相比无显著差异,表明添加HMG后不影响血清LH水平,不能够通过血清LH水平反应添加HMG后的LH水平。
HMG是外源性LH制剂的一种,是从绝经期妇女尿中提取的促性腺激素(Gn),含FSH∶LH 比例1∶1,HMG中LH的活性主要由hCG驱动[9],与LH相比,hCG半衰期更长[10],与黄体生成素/人绒毛膜促性腺激素受体(LHCGR)亲和性更高[11],其分泌不受性激素反馈调节机制的影响,能够为卵泡生长提供更稳定的刺激环境。
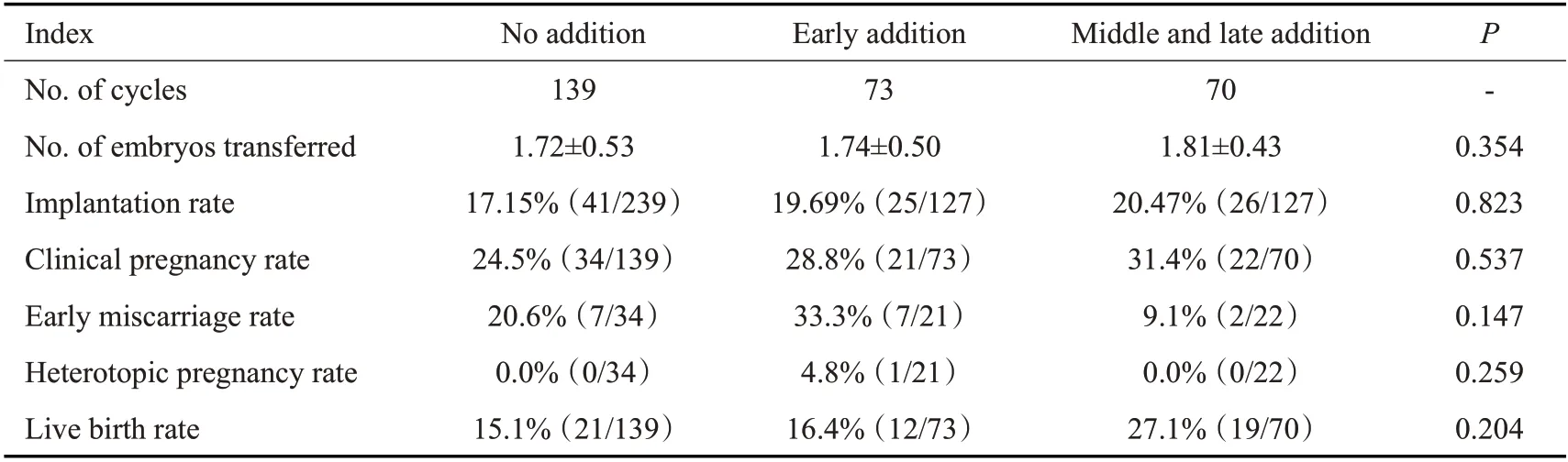
表4 全胚冷冻周期首次FET妊娠结局Tab.4 Clinical outcomes of the first frozen-thawed embryo transfer cycle with a"freeze-all"strategy
女性35岁以后LH的生物活性下降[12],使用GnRHant会导致卵泡液中LH、AMH水平显着降低,而AMH与卵母细胞的着床潜力正相关,补充HMG能诱导卵泡分泌雄激素,刺激AMH分泌,改善卵母细胞质量[13],对于高龄DOR患者,推测添加HMG能增加IVF成功率[14-15]。有学者观察到,高龄患者添加rLH与单用rFSH相比,获卵数、种植率、流产率等均无差异,并无额外益处[16-18]。Alviggi[19]则提出,补充外源性LH制剂可能对两类患者有利,包括预期对卵巢刺激反应较迟钝者以及36~39岁者,与本文研究结果一致。既往研究多集中于长方案以及rLH添加与否对妊娠结局的影响,本文根据添加时机进行分组,首次明确阐述了GnRH-ant方案中高龄DOR患者中晚期添加HMG可获益。
本研究中,与中晚期添加组相比,早期添加组的患者扳机后获卵数偏少,差异有统计学意义。根据LH窗[20]和LH ceiling学说[21],甾体激素的合成及优势卵泡的继续生长需要在合适的LH作用水平下,即达到LH阈值,但不能超过一定的LH范围,过低或过高均不利于卵泡发育。不同发育阶段的卵泡LH上限不同,与未成熟卵泡相比,成熟卵泡的LH上限更高。考虑早期添加组获卵数下降可能是由于GnRH-ant方案允许内源性LH的早期作用,再添加HMG会使得LH活性超过上限值,早卵泡期,未成熟卵泡耐受性较低,LH活性过高,将会抑制颗粒细胞增殖,造成过早黄素化或卵泡闭锁[22]。一方面,颗粒细胞功能丧失和过早黄素化,会导致许多与卵母细胞发育有关的细胞因子如抑制素、胰岛素样生长因子等合成受阻,干扰卵丘-卵母细胞复合体的成熟过程[23];另一方面,获卵数的减少造成最终可利用的胚胎数少,这可能是早期添加组成熟卵子数、可利用胚胎数均低于晚期添加组的原因。
生理状态下,卵泡早期,FSH刺激卵泡募集,使小窦状卵泡免于凋亡。卵泡中期,血液中升高的E2通过负反馈机制抑制FSH,但被选择的优势卵泡依然可以进一步发育生长,很大程度上是由于卵泡逐渐依赖于LH[24],该阶段颗粒细胞开始表达自身LHCG受体并能直接对LH产生应答,同时卵母细胞、颗粒细胞和卵泡膜细胞产生的卵泡内调节因子使得颗粒细胞对FSH敏感性降低,LH的作用日益增大。高龄DOR患者处于生殖功能的老化阶段,颗粒细胞有丝分裂速度减慢,凋亡比例增高[25],LHCG受体敏感性下降。在卵泡中后期,当生长的卵泡处于对类固醇生物合成刺激和最终成熟的最大需求时,内源性LH水平快速下降,可能会对卵子正常发育造成不利影响[26]。此时添加HMG符合生理需求,中晚期添加HMG能上调FSHR和LHR的表达,增加芳香化酶的活性,增加颗粒细胞对FSH的敏感性[27-28],刺激雄激素-AMH轴,从而改善卵子发育能力,提高胚胎质量[29]。因此无添加组及中晚期添加组在获卵数上虽无差异,但在成熟卵子数及可利用胚胎数上中晚期添加组明显更高,这与国内外学者研究一致,卵泡中后期添加HMG可以弥补内源性LH活性不足带来的负面影响,促进卵母细胞发育成熟[30-31]。
研究中观察到,中晚期添加组鲜胚移植周期临床妊娠率明显高于无添加组,除了由于中晚期添加HMG促进卵子发育成熟,子宫内膜上存在LHCG受体[32],研究证实,HMG中的hCG成分对蜕膜化、着床、血管生成等过程具有重要的旁分泌作用[33-34],hCG可以直接作用于内膜调节蜕膜代谢,诱导基底层成纤维细胞中与蜕膜化相关的α-平滑肌细胞肌动蛋白合成,调节血管内皮生长因子、巨噬细胞集落刺激因子、胰岛素样生长因子结合蛋白1等的表达,同时保护内膜基质细胞免于氧化应激相关的凋亡[35]。此外,当子宫内膜过早或过久暴露于hCG作用时,会触发LHCG受体下调和下游信号减敏,细胞外信号调节激酶1/2磷酸化消除,内膜细胞的粘附能力和紧密连接调节受损,继而影响妊娠率,与Evans等的研究一致[36],中晚期适量添加HMG能改善内膜容受性,但过早添加反而削弱hCG的生物学作用,这可能是早期添加组临床妊娠率高于无添加组,而低于中晚期添加组的原因。3组中,中晚期添加组活产率仍最高,比无添加组高9.5%,但差异无统计学意义,考虑与中晚期添加组样本量较少有关,有待扩大样本量进一步研究。
新鲜移植周期中晚期添加组临床妊娠率高于无添加组,而在全胚冷冻周期两组差异在统计学上不显著,推测可能原因是卵巢刺激周期中,中晚期添加HMG能改善子宫内膜的接受能力,促进内膜血管化,而冻胚移植可能消除了HMG 对内膜的积极作用。Andersen等[37]的研究也表明,促排卵过程使用HMG会使血清和卵泡产生不同的激素水平波动,继而影响内分泌反应和子宫内膜接受性。
本研究中,早期添加组与中晚期添加组Gn使用量均高于无添加组,可能是由于HMG含有较多的尿蛋白杂质,制剂批次间差异较大,其生物活性存在内变异,不如通过基因工程单克隆技术合成的FSH制剂纯度高,生物活性和均一性好。但国产的HMG 价格仅为进口rFSH的1/9,仍然不失为是一种经济有效的促排卵药物选择。
综上所述,应用GnRH-ant 方案时,中晚期添加HMG促进卵泡发育,可能可以提高子宫内膜的容受性,有利于改善高龄DOR患者的新鲜周期临床妊娠率。本研究为回顾性研究,有待于严谨的前瞻性随机对照试验进一步分析,在药代动力学和分子水平上对其调控机制进行验证。